ATP荧光微生物快检法中不同材质及孔径微孔滤膜细菌截留效果的评价*
2015-11-20侯玉柱田雨柯润辉尹建军宋全厚
侯玉柱,田雨,柯润辉,尹建军,宋全厚
(中国食品发酵工业研究院,北京,100027)
食品生产用水、医疗用水等微菌含量样品中细菌总数的测定是目前微生物测定的难点之一[1]。多数微生物快速检测技术都是利用膜过滤方法富集细菌后进行测定,膜过滤富集细菌的主要机理是机械筛分作用和吸附截留作用[2-4],尺寸较大的微生物(大多数细菌)主要通过机械筛分作用截留细菌,尺寸较小的微生物(大部分病毒)则依靠吸附截留作用。对于膜过滤富集方法而言,影响膜过滤的因素众多,例如滤压、pH 值、滤液温度、过滤体积等[5],然而操作条件能够通过成型的操作规范或标准进行约束,膜孔径及膜材质等客观因素是膜过滤效果的主要影响因素。本文通过对比不同材质、不同孔径的微孔滤膜的细菌截留效果及测定结果,优选出适用于ATP微生物快检法滤膜富集、膜上测定法测定微菌含量样品中的细菌总数[6]。
1 仪器与试剂
1.1 仪器与设备
ATP荧光检测仪(SF0012型),中质赛福(北京)科技仪器有限公司;恒温培养箱、涡旋振荡器、高压灭菌锅、移液枪(5~50 μL)、一次性注射器(50 mL);过滤器(适用于直径13 mm的微孔滤膜,可重复使用,先用75%酒精浸泡,用无菌水反复冲洗,无菌条件下晾干备用);小镊子(塑料材质,用酒精浸泡再用无菌水冲洗,晾干后备用)。
1.2 试剂
复合荧光试剂(ZF0011),中质赛福(北京)科技仪器有限公司;PCA培养基、5%生理盐水(自配);待滤样液(用未消毒台面涂抹洗脱菌悬液自配,以GBT4789.2-2010[7]检测细菌总数,用无菌生理盐水稀释2倍、4倍和10倍,原液及稀释液备用)。
2 材料与方法
2.1 实验材料
混合纤维素酯膜(d=13 mm,孔径0.22 μm和0.45 μm);聚碳酸酯膜(d=13 mm,孔径 0.2 μm 和0.4 μm);醋酸纤维素膜(d=13 mm,孔径 0.22 μm和0.45 μm);硝酸纤维素膜(d=13mm,孔径0.22 μm 和0.45 μm)。
2.2 实验方法
2.2.1 细菌富集方法
将0.22 μm孔径和0.45 μm孔径的4种滤膜分别装入清洗干净的塑料滤器中,旋紧压平,包装,灭菌后待用(0.1 MPa,121.5℃灭菌20 min),用50 mL无菌注射器吸取50 mL按1.2小节制备的4倍稀释备用液,将灭菌滤器的入口在无菌条件下,以无菌操作方式连接于装有待滤溶液的注射器上,将针头与出口处连接并插入带橡皮塞的无菌试管中。将注射器中的待滤溶液加压缓缓挤入过滤到无菌试管中,滤毕,将针头拨出。压滤时,每次用力要一致且适当,不可太猛太快,以免压力变化太大影响截留效果,每种滤膜做5次平行试验。
2.2.2 细菌截留率计算
将2.2.1小节中带橡皮塞的无菌试管中的滤液用涡旋振荡器振荡均匀,以GB4789.2-2010方法测定滤液中残留的细菌总数。
滤膜细菌截留率/%=[(待滤样液细菌浓度×过滤体积)-(滤液细菌浓度×过滤体积)]/(待滤样液细菌浓度×过滤体积)×100
2.2.3 ATP荧光微生物快检法
将2.2.1小节中过滤器无菌状态打开,用无菌小镊子将滤膜取出,转移至ATP荧光检测特制样品杯中,用移液枪滴加25 μL复合荧光试剂至膜上,再加200 μL无菌水至膜上,用移液枪来回吹吸4~5次,推入仪器测定,得出膜上细菌总ATP荧光值,考察各种材质滤膜膜上裂解测定的重复性。
2.2.4 梯度实验验证
将按1.2小节中配制好的4个浓度的待滤样液,每个浓度均用2.2.1中所述细菌富集方法,用0.22 μm孔径的混合纤维素酯膜过滤富集50 mL待滤样液后,用2.2.3中所述的ATP荧光微生物快检法检测的荧光值,对结果做线性相关性分析。
3 结果与分析
3.1 截留效果统计及分析
1.2中用未消毒台面涂抹洗脱自配的菌悬液经过GB4789.2-2010测定,结果见表1。

表1 制备菌悬液细菌总数含量 单位:CFU/mLTable 1 Total bacteria number of prepared suspension
从表1国标测定的结果可以得出,自制菌悬液浓度为42 CFU/mL,由此可以推算出不同稀释倍数后的稀释液的含菌量,为后面梯度实验效果的计算提供数据。
按照2.2.1中描述的方法过滤待滤样品,按照2.2.2中所描述的方法计算截留率,得出4种滤膜在相同的操作条件下过滤50 mL样液所得细菌截留率统计结果见表2所示。

表2 四种滤膜截留效果统计分析表Table 2 Statistical analysis of four kinds of membrane intercept effect
从表2中可以得出,在相同的操作条件下,同一材质滤膜孔径为0.22 μm(或0.2 μm)的截留效果优于 0.45 μm(或 0.4 μm)的,因此选择 0.22 μm(或0.2 μm)孔径的滤膜过滤细菌更为可行。再对不同材质的0.22 μm孔径滤膜做比较:实验中0.22 μm混合纤维素酯膜的平均截留率为100%,优于聚碳酸酯膜的94%、醋酸纤维素膜的84%以及硝酸纤维素膜的72%,由此可以得出,孔径为0.22 μm的混合纤维素酯膜对细菌的截留效果最好。
3.2 ATP荧光法膜上裂解测定重复性评价
从表3可以得出,经过5次平行测定,混合纤维素酯膜上 ATP荧光值的相对标准偏差(RSD)为5.0%,低于聚碳酸酯膜、醋酸纤维素膜及硝酸纤维素膜的相对标准偏差(后3者 RSD分别为6.1%、14.1%和19.5%),具有更好的重复性。因此,在以ATP生物发光法测定低菌含量液体样品中的细菌总数时,孔径为0.22 μm的混合纤维素酯膜最适合用于过滤截留液体样品中的细菌。
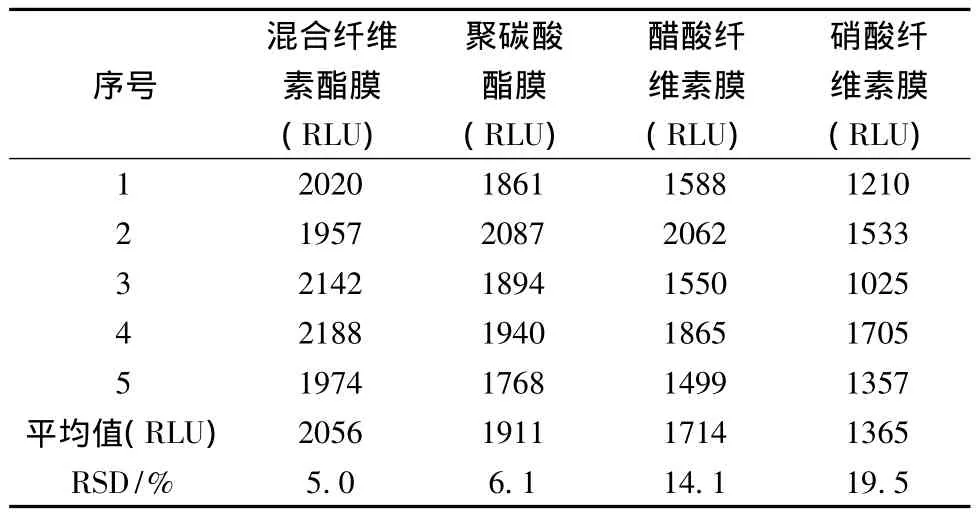
表3 0.22 μm孔径膜上总ATP测定重复性分析(n=5)Table 3 Total ATP measurement repeatability analysis of membrane in 0.22 μm aperture(n=5)
3.3 梯度实验验证效果分析
从图1可以得出,在其他操作条件相同的情况下,使用0.22 μm孔径的混合纤维素酯膜过滤不同浓度的菌悬液,膜上的ATP荧光值与待测样液的细菌含量的相关系数R2为0.954 3,说明二者之间具有良好的线性相关性。

表4 不同浓度待滤样液过滤后膜上测定荧光值Table 4 Fluorescence value from membrane filtrate samples of different bacteria concentration

图1 梯度实验验证效果线性分析图Fig.1 Linear analysis of gradient experiment results
4 结论
目前,膜过滤技术已经发展得比较成熟。罗祎[8]、刘弋青[10]、Parveen[11]、嵇志远[12]、Namvar[13]等专家和学者均曾用微孔滤膜进行微生物检测,但仅评价了单一特定滤膜的细菌截留效果,并未对不同材质、孔径的微孔滤膜做对比研究。本研究在相同操作条件下,分析了微孔滤膜材质及孔径等客观因素对细菌截留效果的影响,此项研究在业内尚属首次。
在相同的操作条件下,0.22 μm孔径的混合纤维素酯膜能够100%截留低菌含量水中的细菌,其细菌截留率和ATP荧光测定重复性皆优于其他常用材质和孔径的微孔滤膜,ATP荧光值与国标方法测定结果的线性相关性较好,线性相关系数R2>0.9。以上结论说明,0.22 μm孔径的混合纤维素酯膜最适用于ATP荧光微生物测定中细菌的富集与测定。
[1]杨笑鹤,郭淼,杨昊,等.ATP发光法在微菌含量样品测试中的集菌方式与测试方法的研究[J].生物医学工程研究,2011,30(4):226 -228.
[2]Madaeni S S.The application of membrane technology for water disinfection[J].Water Research,1999,33(2):301-308.
[3]徐建英.水消毒处理中膜技术的应用[J].环境污染治理技术与设备,2001,2(2):86 -90.
[4]蒋绍阶,石长恩,江志贤.膜过滤技术用于饮用水消毒可行性探讨[J].重庆环境科学,2003,25(4):52 -55.
[5]郑祥,吕文洲,杨敏,等.膜技术对污水中病原微生物取出的研究进展[J].工业水处理,2005,25(1):1 -5.
[6]尹子波,侯玉柱,尹建军,等.ATP生物发光技术在微生物检测中的应用[J].食品研究与开发,2012,33(2):228-232.
[7]GBT4789.2-2010.食品微生物学检验 菌落总数测定[S].
[8]罗祎,赵晋府,周尔明.微生物检测国标法和滤膜法的比较[J].食品工业科技,1999,20(6):54 -56.
[9]Sakakibara T,Murakami S,Imai K.Enumeration of bacterial cell numbers by amplified firefly bioluminescence without cultivation[J].Analytical Biochemistry,2003,312(1):48-56.
[10]刘弋青,吕维敏,刘魁武,等.基于滤膜上细菌直接计数法的细菌总数快速检测[J].生物医学工程研究,2009,28(1):60 -62.
[11]Parveen S,Kaur S,David S A,et al.Wilson D,et al.Evaluation of growth based rapid microbiological methods for sterility testing of vaccines and other biological products[J].Vaccine,2011,29(45):8 012 -8 023.
[12]嵇志远,翁天楚.3种方法测定水中粪便污染指示菌比较研究[J].工业水处理,2013,33(10):79 -82.
[13]Azadeh Namvar,Haq I,Shields M,et al.Extraction of Bacillus endospores from water,apple juice concentrate,raw milk and lettuce rinse solutions using tangential flow filtra- tion[J].Food Control,2013,32(2):632 - 637.
