老年2型糖尿病患者外周血内皮祖细胞的功能及数量
2015-11-20毛文文尹列芬田伟盟陈国强申政磊昆明市第二人民医院老年科云南昆明65004
毛文文 尹列芬 田伟盟 陈国强 周 宁 申政磊 (昆明市第二人民医院老年科,云南 昆明 65004)
内皮祖细胞(EPCs)亦称内皮前体细胞,是指能分化增殖为成熟内皮细胞的一群祖细胞〔1〕。目前,EPCs介导的血管再生及损伤血管修复已经成为糖尿病(DM)、心血管疾病、肿瘤等疾病中的研究热点,2型糖尿病(T2DM)中血管损伤机制的揭示受到许多学者的关注〔2,3〕。本研究观察T2DM患者外周血EPCs数量及其功能,探讨二者在T2DM发生发展中的作用。
1 材料与方法
1.1病例选择 我院2009年9月至2012年10月老年科住院患者,共30例,男15例,女15例,年龄60~76岁,中位年龄65.2岁。经检查确定无冠心病、高血压、感染病史。正常老年对照组 10例,男7例,女3例,年龄60~75岁,中位年龄64.1岁,无糖尿病、冠心病、高血压、近期感染等病史。
1.2材料与试剂 人淋巴细胞分离液、胎牛血清、M199培养液、二甲基亚砜(DMSO)、人纤维连接蛋白、流式细胞仪、DiI乙酰化低密度脂蛋白(ac-LDL)、FITC标记荆豆凝集素Ⅰ(FITC-UEA-Ⅰ)(云南省肿瘤研究所);CD45-Cy5,CD133-RPE等标记(上海生物科技有限公司)。
1.3EPCs分离、鉴定、黏附数目检测
1.3.1EPCs分离 取外周血10 ml,肝素抗凝,密度梯度离心法获取单个核细胞。将单个核细胞接种在24孔板。M199培养基(含20%胎牛血清)培养4 d,用磷酸盐缓冲(PBS)液洗掉非贴壁细胞,换培养液继续培养至7 d,PBS液洗掉非贴壁细胞,贴壁细胞进行细胞鉴定。
1.3.2EPCs细胞鉴定 分离出外周血单个核细胞,按(2~3)×106/ml接种在纤连蛋白包被24孔板及6孔板(内置细胞爬片),细胞爬片于培养第4天取出,收集细胞,流式细胞仪鉴定FITC标记荆豆凝血素Ⅰ(FITC-UEA-I)和DiI标记的乙酰化低密度脂蛋白(DiI-acLDL)双阳性细胞为正常分化的EPCs。
1.3.3EPCs黏附数目(TNE-A)检测 用0.25%胰蛋白酶消化收集贴壁细胞,悬浮在500 μl培养液并计数,然后将同等数目的EPCs铺在24孔板,在37℃5%CO2孵箱培养1 h后,计数贴壁细胞。计数15个随机200倍视野中贴壁细胞。
1.4EPCs的数量检测(TNE)
1.4.1细胞表面标志 采用CD45-Cy5,CD133-RPE等标记。EPCs:CD133+/CD45-。
1.4.2检测方法 采用荧光抗体标记,流式细胞仪检测。抽取外周血3 ml,抗凝,血标本用PBS液2倍稀释,Ficoll分离,1 800 r/min离心20 min,PBS洗2次。将细胞加入96孔板中,每孔5 ×105个细胞,加入抗体 5 μl,4 ℃ 孵育 30 ~60 min,用PBS液洗涤标本2次,100 μl的1%多聚甲醛固定,流式细胞仪检测。
1.5统计学方法 采用SPSS13.3统计软包,数据以s表示,组间比较采用方差分析,相关分析采用Spearman相关分析及Logistic多因素回归分析。
2结果
2.1T2DM各组检测指标与正常对照组情况 T2DM患者TNE-A(细胞数/200倍视野)较正常对照组显著减少,并且血管病变各组间也有差异(t=2.185、2.099;P<0.05)。T2DM患者外周血TNE较正常对照组减低(t=2.179;P<0.05),但血管病变各组间无差异(t=1.857;P>0.05)。见表1。
表1 各组检测指标水平比较(s)
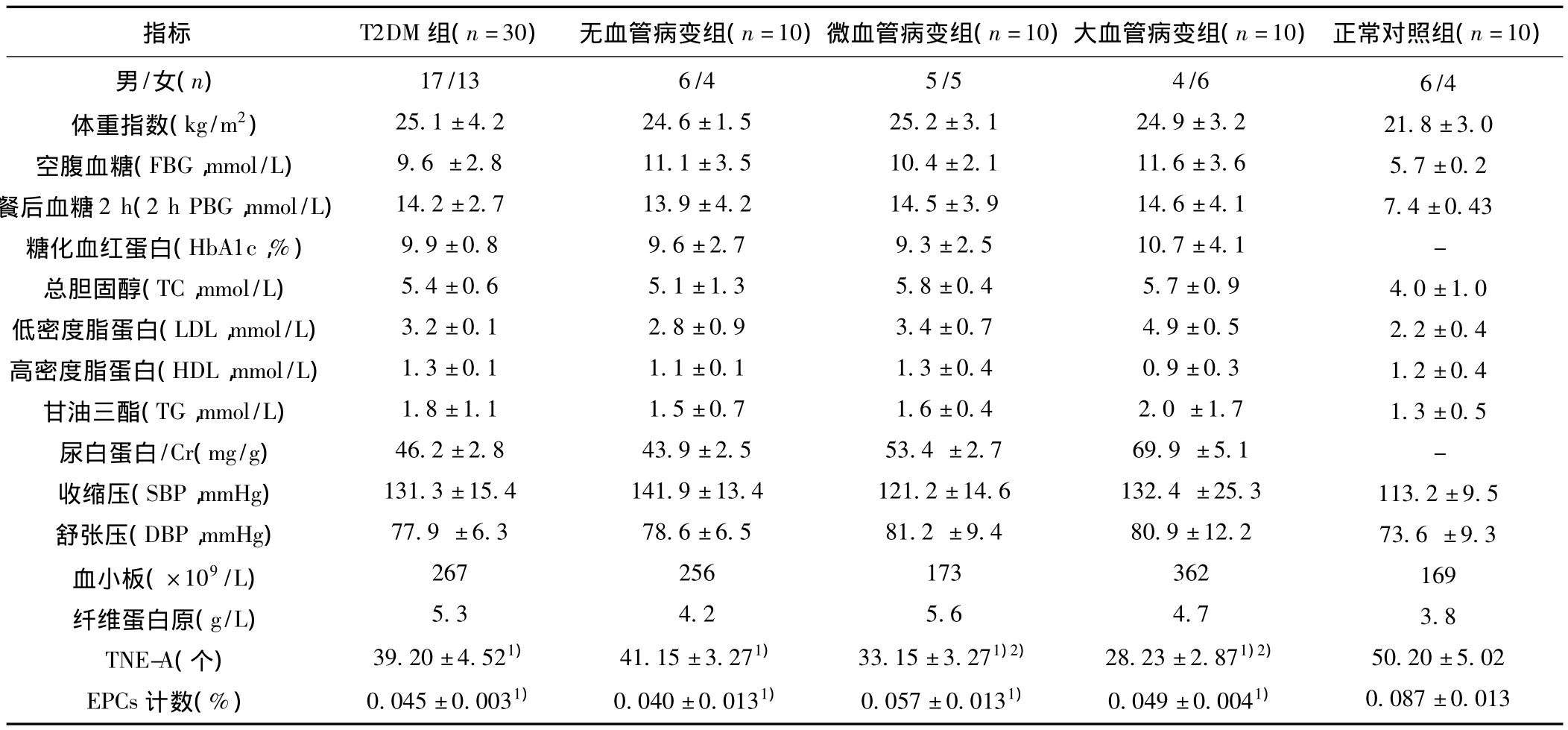
表1 各组检测指标水平比较(s)
与正常对照组比较:1)P<0.05;与T2DM组及无血管病变组比较:2)P<0.05
指标 T2DM组(n=30)无血管病变组(n=10)微血管病变组(n=10)大血管病变组(n=10)正常对照组(n=10)男/女(n)体重指数(kg/m2)空腹血糖(FBG,mmol/L)餐后血糖2 h(2 h PBG,mmol/L)糖化血红蛋白(HbA1c,%)总胆固醇(TC,mmol/L)低密度脂蛋白(LDL,mmol/L)高密度脂蛋白(HDL,mmol/L)甘油三酯(TG,mmol/L)尿白蛋白/Cr(mg/g)收缩压(SBP,mmHg)舒张压(DBP,mmHg)血小板(×109/L)纤维蛋白原(g/L)TNE-A(个)EPCs计数(%)6/4 21.8±3.0 5.7±0.2 7.4±0.43-4.0±1.0 2.2±0.4 1.2±0.4 1.3±0.5-113.2±9.5 73.6±9.3 169 3.8 50.20±5.02 0.087±0.013 17/13 25.1±4.2 9.6±2.8 14.2±2.7 9.9±0.8 5.4±0.6 3.2±0.1 1.3±0.1 1.8±1.1 46.2±2.8 131.3±15.4 77.9±6.3 267 5.3 39.20±4.521)0.045±0.0031)6/4 24.6±1.5 11.1±3.5 13.9±4.2 9.6±2.7 5.1±1.3 2.8±0.9 1.1±0.1 1.5±0.7 43.9±2.5 141.9±13.4 78.6±6.5 256 4.2 41.15±3.271)0.040±0.0131)5/5 25.2±3.1 10.4±2.1 14.5±3.9 9.3±2.5 5.8±0.4 3.4±0.7 1.3±0.4 1.6±0.4 53.4±2.7 121.2±14.6 81.2±9.4 173 5.6 33.15±3.271)2)0.057±0.0131)4/6 24.9±3.2 11.6±3.6 14.6±4.1 10.7±4.1 5.7±0.9 4.9±0.5 0.9±0.3 2.0±1.7 69.9±5.1 132.4±25.3 80.9±12.2 362 4.7 28.23±2.871)2)0.049±0.0041)
2.2T2DM患者(按FBG分组)与正常对照组TNE-A对比 见表2。T2DM患者TNE-A较正常对照组显著减少(t=2.872,P<0.01);T2DM随血糖升高,TNE-A逐渐降低,组间也有统计学差异(t=2.122,P<0.05)。T2DM患者外周血TNE-A较正常对照组减低(t=2.855,P<0.01);T2DM患者随血糖升高,TNE-A也逐渐降低,组间有统计学差异(t=2.103,P<0.05)。
表2 不同FBG水平的T2DM患者EPCs检测结果(s)

表2 不同FBG水平的T2DM患者EPCs检测结果(s)
与正常对照组比较:1)P<0.01;与其他组比较:2)P<0.05,下表同
FBG(mmol/L)TNE-E(个)EPCs计数(%)<7.8(n=7)39.20±4.521) 0.060±0.0101)7.8~11.1(n=11)33.15±3.271) 0.055±0.0111)>11.1(n=12)28.23 ±2.871)2) 0.034±0.0211)2)正常对照组(n=10)50.20±5.02 0.087±0.013
2.3T2DM患者(按HbA1c分组)与正常对照组结果对比T2DM患者 TNE-A较正常对照组显著减少(t=2.985,P<0.01);T2DM患者随HbA1c升高,TNE-A逐渐降低,组间有统计学差异(t=2.105,P<0.05)。T2DM患者外周血TNE数较正常对照组减低(t=2.861,P<0.01);T2DM患者随HbA1c升高,TNE数逐渐降低,组间有统计学差异(t=2.175,P<0.05)。见表3。
表3 不同HbA1c水平T2DM患者EPCs检测结果(s)

表3 不同HbA1c水平T2DM患者EPCs检测结果(s)
HbA1c水平 TNE-A(个)EPCs计数(%)<8%(n=9)40.35±4.291) 0.071±0.0351)8% ~12%(n=10)32.21±4.011) 0.049±0.0251)>12%(n=11)25.22±2.451)2) 0.030±0.0191)2)正常对照组(n=10)52.12±4.14 0.087±0.013
2.4T2DM患者相关性以及预后因素分析 Spearman相关分析显示,TNE-A水平与LDL、DBP呈负相关(r分别为-0.40、-0.39,P <0.01),与 2hPBG、HbA1c也呈负相关性(r分别为-0.21、-0.24,P<0.05)。而外周血TNE数与FBG、HbA1c蛋白呈负相关(r分别为-0.231、-0.267,P<0.05)。两者与上述其他因素无关联。以T2DM为整体,有血管病变为因变量(有 =1,无 =0),以年龄、性别、SBP、DBP、BMI、HbA1c、TG、TC、LDL-C、HDL-C、FPG、2hPG、血小板计数、纤维蛋白原、TNEA、TNE数目等因素为自变量,进行Logistic回归分析。最后SBP、TNE-A 进入回归方程,常数为 -14.617、21.632。
3讨论
目前研究发现,T2DM患者,特别在并发大血管病和微血管病时,体内循环内皮细胞(CECs)、EPCs均发生数量和功能的变化。糖尿病的严重程度与血管内皮损伤和功能障碍的程度密切相关〔1〕。大量研究显示黏附分子、细胞因子、糖基化终末产物、脂类代谢紊乱等在分子水平上参与T2DM新生血管的形成,其中与上述因素有着密切关系的内皮细胞、EPCs的研究正成为热点〔2,3〕。本研究参考国内外研究成果,从 EPCs入手,从其功能与数量两方面探讨其在T2DM患者体内的变化,并与相关临床因素对比分析。
T2DM患者体内EPCs黏附细胞数可以反映其黏附功能,其参与血管生成、血管损伤修复等,在糖尿病血管病变发生中占有重要地位。而外周血EPCs的数量反映了内皮在各种因素刺激下的调控。本研究发现T2DM患者体内EPCs黏附细胞数较正常对照组显著减少,并且随血糖、血脂、血压有一定的关联。目前相关文献〔4〕显示糖尿病患者体内一些指标如可溶性细胞间黏附分子1、血浆假性血友病因子等参与糖尿病血管病变,但分析发现它们与血脂、血压相关联,而与血糖及HbA1c水平无明显相关性,从而认为它们不是血糖升高的直接后果,而可能与DM患者体内蛋白质非酶糖化反应及氧化应激增强等因素有关。结合本研究结果提示EPCs的功能变化可能是体内代谢变化的联系环节。同时,本研究外周血EPCs细胞数目与血脂、血压等反映血管病变的因素相关性较低或无相关性的结果可能从另一个侧面也支持上述结论。本研究提示EPCs细胞数目受到影响因素较多,早期代偿机制是其数目增加的主要因素,随着病变加重,代偿机制失控,一方面数量会降低,另一方面即便数量增多,功能上存在缺陷,无法起到其应具有的功能,导致恶性循环,病情进展。因此针对 T2DM 的 EPCs移植治疗〔5,6〕上,在保证EPCs数量的同时,其内在功能更应该受到重视。鉴于EPCs的研究刚刚起步,其生物学功能仍需进一步研究。
1 Gao D,Nolan DJ,Mellick AS,et al.Endothelial progenitor cells control the angiogenic switch in mouse lung metastasis〔J〕.Science,2008;319(5860):195-8.
2 Qiu XF,Li XX,Chen Y,et al.Mobilisation of endothelial progenitor cells:one of the possible mechanisms involved in the chronic administration of melatonin preventing erectile dysfunction in diabetic rats〔J〕.Asian J Androl,2012;14(3):481-6.
3 Bhaskar A,Gupta R,Kumar L,et al.Circulating endothelial progenitor cells as potential prognostic biomarker in multiple myeloma〔J〕.Leuk Lymphoma,2012;53(4):635-40.
4 Yue WS,Lau KK,Siu CW,et al.Impact of glycemic control on circulating endothelial progenitor cells and arterial stiffness in patients with type 2 diabetes mellitus〔J〕.Cardiovasc Diabetol,2011;20(10):113.
5 王红娟,王 娟,李 楠,等.大鼠骨髓和外周血早晚期内皮祖细胞的分离培养和鉴定(英文)〔J〕.中国组织工程研究,2013;17(6):1056-63.
6 彭 艳,徐 玲,徐 勇.脐血内皮祖细胞治疗糖尿病大鼠下肢缺血的实验研究〔J〕.中国糖尿病杂志,2013;21(1):76-9.
