依达拉奉对阿尔茨海默病大鼠行为学和核因子-κBp65及Caspase-3蛋白表达的影响
2015-11-20杨晓帆赵维娜杨印东
杨晓帆 安 宁 赵维娜 杨印东 陈 培
(牡丹江医学院红旗医院神经内科,黑龙江 牡丹江 157011)
目前关于阿尔茨海默病(AD)的具体发病机制没有定论,氧化应激及其凋亡机制已经引起神经病学专家广泛关注,β淀粉样多肽(Aβ)已被证实可作为构成AD特征性病变老年斑(SP)的核心成分〔1~6〕。依达拉奉(MCI-186)作为一种新的特异性较强的自由基清除剂,能够利用强大的对·OH的清除能力,来阻止毒性羰基化合物的生成,发挥其抗氧化作用〔7〕。本研究探讨MCI-186治疗对AD大鼠行为学和核因子(NF)-κB p65及Caspase-3蛋白表达的影响。
1 材料与方法
1.1材料 Aβ25~35(北京博奥森生物技术有限公司生产);MCI-186(北京达科为生物技术有限公司,SIH-152-250MG);小牛血清清蛋白(美国,Sigma公司),胰蛋白酶、D-Hanks液(美国,伯乐Bio-Rad公司);细胞培养基(DMEM)、乙二胺四乙酸(EDTA)(美国,Gibco公司)。
1.2动物处理 Wistar大鼠,雄性,3~4个月龄,体重200 g左右,自由饮水及摄食。首先给予水迷宫试验,筛选活动正常者,随机分为正常对照组(不给予任何处理)、假手术组(只钻颅、不给予 Aβ1~40注射)、AD组(给予双侧海马多点位注射Aβ1~40)、小剂量组(侧脑室注射 MCI-186,0.2 μg/μl,10 μl)、中剂量组(0.5 μg/μl,10 μl)、大剂量组(0.8 μg/μl,10 μl)。每组30只。
1.3AD大鼠模型的建立 大鼠给予腹腔麻醉并固定,于双侧海马(中线旁开2.2 mm、前囟点后1.4 mm)7个不同部位注射预先在 37℃ 恒温箱中孵育 7 d的 Aβ1~40,每个位点注射3 nmol/d×7 d。在首次实验时在背侧丘脑前方显微注射10 ng转化生长因子β,以促进Aβ沉积。
1.4给药方法 MCI-186组:痴呆模型制备7 d后开始侧脑室注射,连续14 d。假手术组和AD组均于造模成功后给予注射生理盐水10 μl。注射持续10 min左右,待完毕仍应缓停拔针2 min。正常对照组实验结束给予注射亚甲蓝溶液2 μl。
1.5行为学测定 采用Morris水迷宫法,进行定位航行实验和空间探索实验,分别与造模前、造模后第1~6天测定大鼠找到平台所需时间(即逃避潜伏期)和2 min内跨越原平台所在位置的次数,每日2次取平均成绩。
1.6Caspase-3、NF-κB P65基因的mRNA表达的测定 按Trizol试剂盒说明提取总 RNA。利用 RT-PLR检测 Caspase-3、NF-κB P65基因的 mRNA表达,用紫外分光光度仪测定A260 nm/A280 nm,比值1.9~2.0,计算RNA含量。引物设计参照文献〔8〕:① NF-κB P65:正义链 3'-GGACACATCGGTAACATAGA-5',反义链 3'-CGTCTTTCTTCTGTAACTCC-5'(扩增产物493 bp);②Caspase-3:正义链 3'-GGTGACAGACAGAGTTATGG-5',反义链 3'-CGTTTCTTTTGTCTAGGGTAC-5'(扩增产物280 bp);③β-actin:正义链 3'-ACATCTTTCACACCACGTTTA-5',反义链 3'-GACTCTCCCTTTAGCACGCACT-5'(扩增产物 380 bp,为内参照)。逆转录反应按试剂盒操作。RT-PCR产物用2%琼脂糖凝胶电泳分离检测。
1.7Caspase-3和NF-κB P65片段蛋白表达 常规提取细胞核蛋白,并利用Western印迹检测Caspase-3活性片段和 NF-κB P65蛋白表达。
1.8统计学方法 采用统计软件SPSS15.0软件进行方差分析、t检验。
2结果
2.1各组水迷宫实验逃避潜伏期 与假手术组比较,AD组第1~6天逃避潜伏期明显延长(P<0.05或P<0.01);与AD组比较,小剂量组第4~6天逃避潜伏期明显缩短(P<0.05),中剂量组第2~6天逃避潜伏期明显缩短(P<0.05),大剂量组第2~6天逃避潜伏期明显缩短(P<0.05或P<0.01);与小剂量组比较,大剂量组第2~6天逃避潜伏期明显缩短(P<0.05或P<0.01)。见表1。
2.2各组水迷宫实验2 min内跨越原平台所在位置的次数与假手术组比较,AD组第1~6天跨越原平台次数明显减少(P<0.05或P<0.01);与AD组比较,小剂量组第4~6天跨越原平台次数明显减少(P<0.05),中剂量组第2~6天跨越原平台次数明显增加(P<0.05),大剂量组第2~6天跨越原平台次数明显增加(P<0.05或P<0.01);与小剂量组比较,大剂量组第2~6天跨越原平台次数明显增加(P<0.05或P<0.01)。见表2。

表1 各组水迷宫实验潜伏期(s,x ± s,n=30)
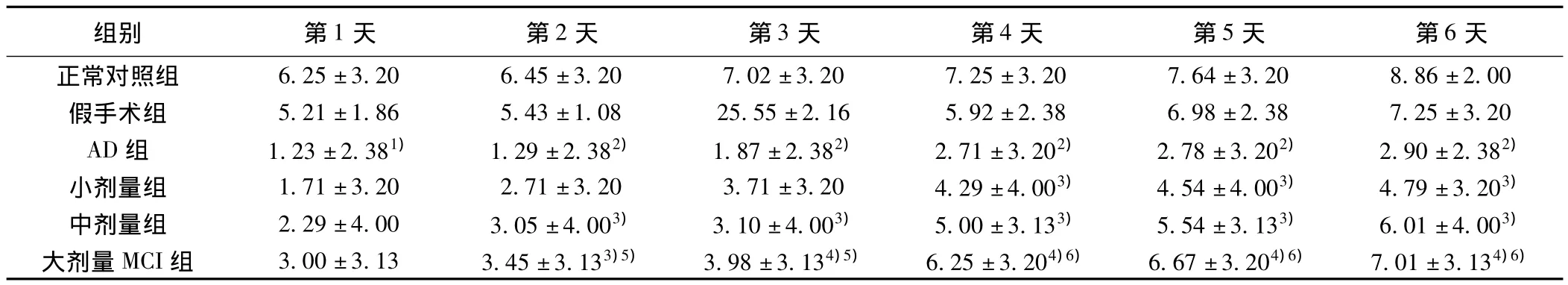
表2 各组水迷宫实验跨越原平台次数(x ±s,n=30,次)
2.3各组Caspase-3和NF-κB P65 mRNA表达的测定 经不同剂量的MCI-186处理后,Caspase-3和NF-κB P65 mRNA表达降低明显,且随着剂量的增加,Caspase-3和NF-κB P65 mRNA表达降低更明显,见图1。
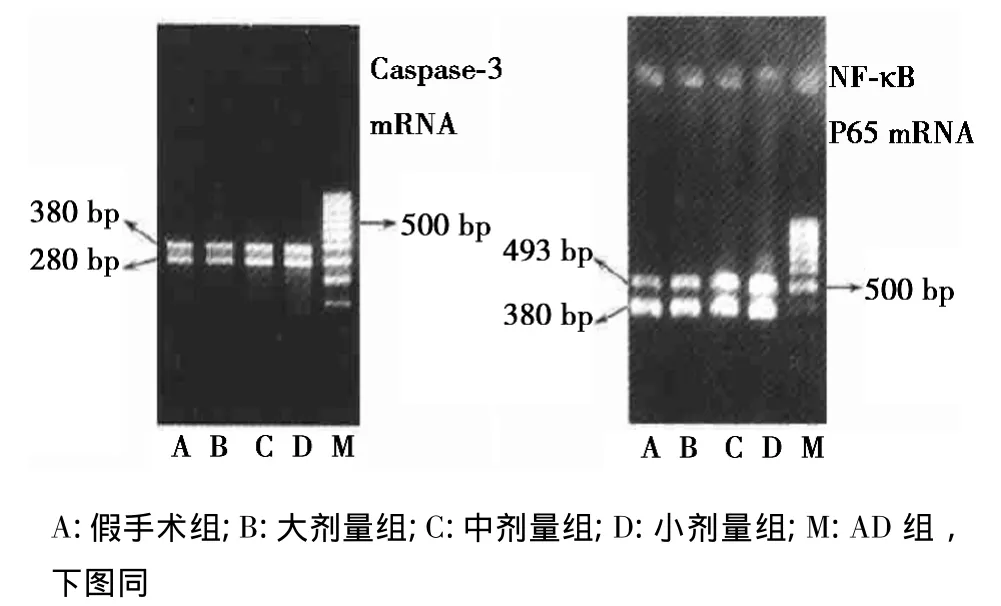
图1 各组Caspase-3和NF-κB P65 mRNA表达
2.4各组Caspase-3和NF-κB P65蛋白表达的测定 经不同剂量的MCI-186处理后,Caspase-3和NF-κB P65蛋白条带逐渐变细,且随着剂量的增加,Caspase-3和NF-κB P65蛋白条带逐渐变细更明显。见图2。

图2 各组Caspase-3和NF-κB P65蛋白表达
3讨论
AD发病机制较复杂,可能受遗传、代谢及环境等众多因素共同影响 。20世纪70年代,有学者提出了“胆碱能”假说〔9〕。随着技术及相关研究的不断深入,后续又有关于Aβ沉积、基因突变、炎性损伤、tau蛋白磷酸化过度、细胞内钙稳态不平衡等学说的涌现〔10〕。近些年来,细胞凋亡、氧化应激和自由基毒性等对于AD发病的作用也日益引起学者的高度关注〔11,12〕。这些病理过程的发生、发展,在AD的致病过程中起着重要作用〔13〕。
Aβ是SP的核心成分,而SP是构成AD特征性病变的主要成分,Aβ的出现往往先于神经原纤维缠结(NFTs)的临床表现及病理改变〔14〕。目前学术界一致同意,由Aβ所引发的神经毒性作用是导致AD发病的最终通路,参与AD的形成及其发展过程〔15〕。AD转基因鼠及AD患者体外实验均证实,Aβ沉积并引发淀粉样斑块后,往往会伴有活性氧(ROS)的出现,多光子成像技术也显示,NF-κB受到活化,最终使得细胞内蛋白质及相关DNA受到损害,此时内源性抗氧化剂发挥神经保护作用已不能对抗ROS引起的神经退变。因此,通过自由基损伤引起Aβ 的神经毒性作用已经成为共识〔16,17〕。
MCI-186是由日本研制并于2001年上市针对自由基能够进行有效清除的一种制剂,MCI-186利用对·OH的高效清除,可减少过氧化脂质的产生,避免脑细胞过氧化所造成的过度损伤〔18〕。动物实验表明,MCI-186通过降低脑水肿的发生率,能够达到恢复神经元缺失、降低或延缓迟发性神经元凋亡的作用目的,进而能够有效阻止缺血性脑血管病的发生及进展。同时,其能够在缺血再灌注的早期明显改善缺血诱导的海马齿状回突触长时程增强,提示MCI-186参与学习过程,并能能改善缺血患者的记忆能力。本文结果提示,MCI-186可提高AD大鼠空间学习记忆功能,其机制可能与提高大鼠脑组织抗氧化酶活性,减少自由基损伤及降压作用有关。
Caspass-3作为Caspase家族成员较为重要蛋白酶的一员,其相关研究是Caspase家族成员中研究最深入的〔19〕。正常的机体状态况下,Caspase是以非活化的酶原状态存在,一旦被激活,便能迅速引发凋亡蛋白酶的级联反应,最终出现细胞不可逆死亡。NF-κB作为具有多向转录及调节功效的蛋白质,能够参与机体炎性反应及免疫应答等重要的生理及病理时期〔22〕。AD患者尸检结果显示神经变性过程中NF-κB活性增加。本研究提示MCI-186通过减轻大鼠DNA氧化损伤,加快DNA修复,改善动物脑血流情况,其机制可能与MCI-186可清除羟基自由基,并减少毒性羰基化合物水平有关。
综上,MCI-186能够提高AD大鼠空间学习记忆功能,降低NF-κBp65及Caspase-3 mRNA及蛋白的表达,促进细胞增殖,并能抑制细胞凋亡,从而达到保护神经细胞的目的,以0.8 μg/μl MCI-186效果更强。
1 Li S,Wei Z,Chen J,et al.Oral administration of a fusion protein between the cholera toxin B subunit and the 42-amino acid isoform of amyloid-β peptide produced in silkworm pupae protects against Alzheimer's disease in mice〔J〕.PLoS One,2014;9(12):e113585.
2 Karki S,Nichols MR.CD47 does not mediate amyloid-β(1-42)protofibril-stimulated microglial cytokine release〔J〕.Biochem Biophys Res Commun,2014;454(1):239-44.
3 Matveev SV,Kwiatkowski S,Sviripa VM,et al.Tritium-labeled(E,E)-2,5-bis(4'-hydroxy-3'-carboxystyryl)benzene as a probe for β-amyloid fibrils〔J〕.Bioorg Med Chem Lett,2014;24(23):5534-6.
4 Lee JS,Lee BI,Park CB.Photo-induced inhibition of Alzheimer's β-amyloid aggregation in vitro by rose bengal〔J〕.Biomaterials,2015;38(40):43-9.
5 Xiao X,Cali I,Yuan J,et al.Synthetic Aβ peptides acquire prion-like properties in the brain〔J〕.Oncotarget,2014;25(2):642-50.
6 Ordóñez-Gutiérrez L,Re F,Bereczki E,et al.Repeated intraperitoneal injection of liposomes containing phosphatidic acid and cardiolipin reduce amyloid-β levels in APP/PS1 transgenic mice〔J〕.Nanomedicine,2015;11(2):421-30.
7 Zhang G,Sun Y,Wang Y,et al.Local administration of lactic acid and a low dose of the free radical scavenger,edaravone,alleviates myocardial reperfusion injury in rats〔J〕.J Cardiovasc Pharmacol,2013;62(4):369-78.
8 Ulrich V,Michal W,Christiane RI.Activation of AP-1 and 'Vuclear Factor-kappa B transcription factors is involved in hydrogen peroxide-induced apoptotic cell death of oligodendroytes〔J〕.J Neurochem,1999;73(6):2501-5.
9 Ponce DP,Salech F,SanMartin CD,et al.Increased susceptibility to oxidative death of lymphocytes from Alzheimer patients correlates with dementia severity〔J〕.Curr Alzheimer Res,2014;11(9):892-8.
10 Scioli MG,Cervelli V,Arcuri G,et al.High insulin-induced down-regulation of Erk-1/IGF-1R/FGFR-1 signaling is required for oxidative stress-mediated apoptosis of adipose-derived stem cells〔J〕.J Cell Physiol,2014;229(12):2077-87.
11 Yang EJ,Kim GS,Jun M,et al.Kaempferol attenuates the glutamate-induced oxidative stress in mouse-derived hippocampal neuronal HT22 cells〔J〕.Food Funct,2014;5(7):1395-402.
12 Darwish HA,Arab HH,Abdelsalam RM.Chrysin alleviates testicular dysfunction in adjuvant arthritic rats via suppression of inflammation and apoptosis:comparison with celecoxib〔J〕.Toxicol Appl Pharmacol,2014;279(2):129-40.
13 Csiszar A,Gautam T,Sosnowska D,et al.Caloric restriction confers persistent anti-oxidative,pro-angiogenic and anti-inflammatory effects and promotes anti-aging miRNA expression profile in cerebromicrovascular endothelial cells of aged rats〔J〕.Am J Physiol Heart Circ Physiol,2014;307(3):H292-306.
14 Lee JM,Shin MS,Ji ES,et al.Treadmill exercise improves motor coordination through ameliorating Purkinje cell loss in amyloid beta23-35-induced Alzheimer's disease rats〔J〕.J Exerc Rehabil,2014;10(5):258-64.
15 Kim JH.Brain-derived neurotrophic factor exerts neuroprotective actions against amyloid β-induced apoptosis in neuroblastoma cells〔J〕.Exp T-her Med,2014;8(6):1891-5.
16 Zheng X,Xie Z,Zhu Z,et al.Methyllycaconitine alleviates amyloid-β peptides-induced cytotoxicity in SH-SY5Y cells〔J〕.PLoS One,2014;9(10):e111536.
17 Wang JH,Li WT,Yu ST,et al.Catalpol regulates function of hypothalamic-pituitary-adrenocortical-axis in an Alzheimer's disease rat model〔J〕.Pharmazie,2014;69(9):688-93.
18 Kaste M,Murayama S,Ford GA,et al.Safety,tolerability and pharmacokinetics of MCI-186 in patients with acute ischemic stroke:new formulation and dosing regimen.MCI-186study group〔J〕.Cerebrovasc Dis,2013;36(3):196-204.
19 Wang J,Al-Lamki RS,Zhu X,et al.TL1-A can engage death receptor-3 and activate NF-kappa B in endothelial cells〔J〕.BMC Nephrol,2014;15(1):178.
20 Wang HQ,Li DL,Lu YJ,et al.Anticancer activity of acanthopanax trifoliatus(L)merr extracts is associated with inhibition of NF-κB activity and decreased Erk1/2 and akt phosphorylation〔J〕.Asian Pac J Cancer Prev,2014;15(21):9341-6.
