胃旁路术对2型糖尿病大鼠胰岛β细胞凋亡的影响
2015-11-20高向楠赵树鹏辽宁医学院附属第一医院普外科辽宁锦州121001
高向楠 柴 芳 赵树鹏 (辽宁医学院附属第一医院普外科,辽宁 锦州 121001)
目前对2型糖尿病(T2DM)的治疗以内科方式为主,如控制饮食、增加运动、口服各种降糖药及注射胰岛素等,但血糖控制不理想远期效果差。胃旁路术(RYGB)手术治疗T2DM,术后短期就可控制血糖、降低体重且远期效果较好〔1〕。研究发现RYGB可以改善T2DM患者胰岛β细胞凋亡程度〔2〕,但其作用机制仍不清楚。本研究观察RYGB术后β-catenin及内质网(ER)相关凋亡蛋白caspase-12的表达,探讨RYGB对糖尿病大鼠胰岛β细胞凋亡的影响及其相关机制。
1 材料与方法
1.1主要试剂与药品 链脲佐菌素(STZ)购买于Sigma生物公司,β-catenin、caspase-12抗体、胰岛细胞凋亡检测试剂盒均购自武汉博士德生物公司。
1.2T2DM动物模型建立和分组 健康雄性SD大鼠60只,10周龄,体重210~243 g(由辽宁医学院实验动物中心提供)。所有大鼠清洁级饲养,室温(22±2)℃,相对湿度40%左右,12 h光照,自由进食水,适应环境3 d后随机分成正常对照组(C组),糖尿病控制大鼠手术组(RYGB)和假手术组(S-RYGB)各20只。糖尿病组大鼠给予高脂饲料(50%脂肪,10%碳水化合物,2%胆固醇和5%正常食物)饲养3 w,于2 w时腹腔注射STZ(25 mg/kg)。20只正常SD大鼠作为健康组给予同等量的盐水注射。2型糖尿病大鼠在注射STZ 3 d后测量空腹血糖≥16.7 mmol/L且稳定1 w为造模成功〔3〕。成模大鼠(RYGB组17只、S-RYGB组15只)和C组同条件下饲养。
1.3RYGB模型制作 手术组大鼠术前12 h禁食,采用10%水合氯醛按0.3 ml/100 g体重经腹腔给药麻醉。RYGB组取腹正中做4 cm长切口,逐层入腹。胃大小弯间进行离断,保留贲门附近约20%胃体并保护迷走神经,距十二指肠悬韧带下方约10 cm处横断空肠,远端上提与残胃吻合,在距吻合口约10 cm处行空肠近端与空肠端侧吻合。C组和S-RYGB组分别作为阴性和阳性对照,与手术组相同操作开腹,行胃切开术在胃前壁做7 mm切口后予以缝合。所有大鼠吻合口均用6-0无损伤线缝合,理顺肠道后用青霉素(40 000 U/kg)和生理盐水冲洗腹腔,并给予适量生理盐水补液后关腹。术后禁食2 d后给予正常饮食,禁食期间给予10%葡萄糖溶液口服。所有大鼠饲养4 w后处死。
1.4血糖、体重检测 测量术前和术后1、2、3、4 w大鼠空腹血糖和体重,测定空腹血糖前需禁食12 h。
1.5TUNEL检测胰岛β细胞凋亡率 处死大鼠后分离胰腺组织,测定胰岛细胞凋亡率,按TUNEL检测试剂盒说明操作。用DAB显色凋亡阳性细胞。每份样品高倍镜下随机选取视野(×400),计数100个细胞核,计算胰岛细胞凋亡率。
1.6免疫组化检测胰腺组织β-catenin、caspase-12蛋白表达胰腺组织用4%多聚甲醛固定,常规脱水、石蜡包埋,石蜡组织4 μm切片后使用二甲苯和梯度乙醇(由高到低)依次脱蜡和水化,切片使用枸橼酸钠溶液进行抗原修复。冷却至室温后滴加封闭液,按SABC检测试剂盒说明操作。阳性结果为胞质/膜出现棕黄色区域。根据染色强度及阳性细胞数进行分级。染色程度:基本不着色为0分;染色淡者为1分;着色适中者为2分;着色深者为3分。阳性细胞百分比:着色细胞数占计数细胞<5%为0分;6% ~25%为1分;26% ~50%为2分;≥51%为3分。将每张切片着色程度和着色细胞百分比得分相加,最后得分0~3分为阴性表达,≥4分为阳性表达。
1.7统计学方法 采用SPSS13.0统计软件进行单因素方差分析,χ2检验。
2结果
2.1存活率 C组死亡5只,存活率75%,3只因为伤口裂开于术后4 d死亡,2只因为肠坏死于术后3~5 d死亡;RYGB组死亡3只,存活率82%,2只因为术后吻合口漏引起腹膜炎,于术后第1~3天死亡,1只因小肠坏死于术后4 d死亡;S-RYGB组死亡2只,存活率87%,均因小肠坏死于术后5 d死亡。
2.2体重变化 术后1 w各组大鼠体重均下降,术后2 w起RYGB组体重降低显著低于相应时间点C组和S-RYGB组(P<0.05)。见表1。
2.3空腹血糖变化 RYGB组术后第1周空腹血糖值已开始下降,术后第4周空腹血糖值为(3.9±0.7)mmol/L,明显低于相应时间点S-RYGB组(P<0.05)。S-RYGB组、C组实验过程中空腹血糖值无明显改变。见表1。
2.4术后TUNEL法测胰岛β细胞凋亡率 RYGB组大鼠胰岛细胞凋亡率术后4 w为(4.01±0.39)%,明显低于同时间SRYGB组〔17.94±0.53)%,P<0.05〕。C组胰岛细胞凋亡率为(3.56±0.36)%。见图1。
2.5术后免疫组化检测凋亡蛋白β-catenin、caspase-12的表达术后4 w β-catenin阳性表达率在RYGB组、S-RYGB组和C组分别为78.5%、30.8%和60.0%;RYGB组与S-RYGB组比较有差异(P=0.021),与C组比较无差异(P=0.427)。术后4 w caspase-12阳性表达率在RYGB组、S-RYGB组和C组的分别为35.7%、84.6%和33.3%;RYGB组与S-RYGB组比较有差异(P=0.018),与C组比较无差异(P=1.000)。见图2、图3。
表1 三组大鼠体重的比较(s)
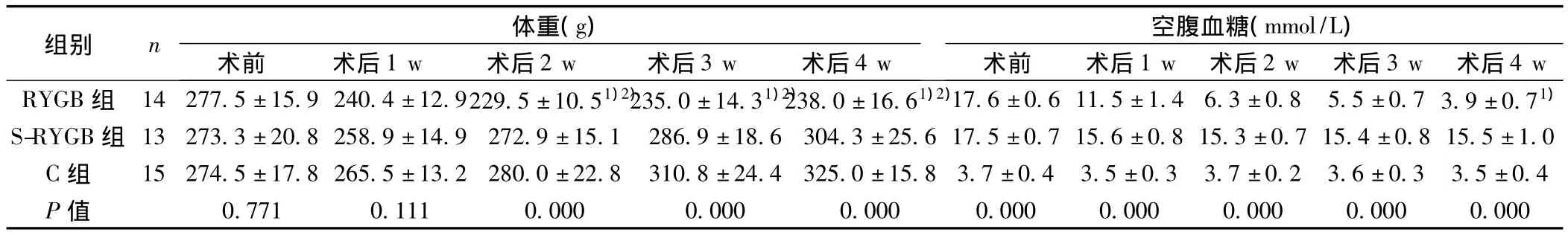
表1 三组大鼠体重的比较(s)
与同时间点S-RYGB组比较:1)P<0.05;与同时间点C组比较:2)P<0.05
组别 n 体重(g)空腹血糖(mmol/L)4 w RYGB组 14 277.5±15.9 240.4±12.9229.5±10.51)2)235.0±14.31)2)238.0±16.61)2)17.6±0.6 11.5±1.4 6.3±0.8 5.5±0.7 3.9±0.71)术前 术后1 w 术后2 w 术后3 w 术后4 w 术前 术后1 w 术后2 w 术后3 w 术后S-RYGB组 13 273.3±20.8 258.9±14.9 272.9±15.1 286.9±18.6 304.3±25.6 17.5±0.7 15.6±0.8 15.3±0.7 15.4±0.8 15.5±1.0 C组 15 274.5±17.8 265.5±13.2 280.0±22.8 310.8±24.4 325.0±15.8 3.7±0.4 3.5±0.3 3.7±0.2 3.6±0.3 3.5±0.4 P值 0.771 0.111 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000
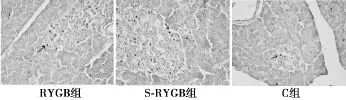
图1 术后胰岛TUNEL染色结果(×400)

图2 胰岛β细胞β-catenin蛋白免疫组化结果(DAB,×400)
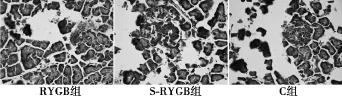
图3 胰岛β细胞caspase-12蛋白免疫组化结果(DAB,×400)
3讨论
在2型糖尿病的发病过程中胰岛β细胞功能受损起着重要的作用〔4〕。造成胰岛β细胞功能受损的众多因素中,细胞凋亡是胰岛β细胞功能减低的主要因素之一。传统治疗只能单纯控制血糖,对减缓胰岛细胞凋亡作用不显著,而RYGB不仅能够迅速降低体重,长期控制血糖,而且能减少胰岛细胞凋亡,但具体的机制尚不清楚〔5〕。
β-catenin是wnt通路里的关键蛋白,其表达上升可引起增殖相关基因(如TCF/LEF)表达上调促进细胞增殖〔6〕。在细胞质中β-catenin与Axin、GSK3和APC等结合成无活性复合体,当wnt通路激活时,复合体解体,β-catenin不能被磷酸化而分解,从而进入细胞核引起核表达促使细胞发生增殖〔7〕。有文献〔8〕指出胰岛内wnt/β-catenin信号通路在调节血糖以及能量平衡起着重要作用。敲除β-catenin基因的胰腺中,β细胞数量锐减,糖耐量立刻损坏引起高糖,而高糖又可以抑制wnt信号的表达,下调核转录因子β-catenin,同时促发caspase活化以增加细胞凋亡〔9〕;且RYGB干预后,糖尿病大鼠胰岛β细胞凋亡率可能恢复到正常胰岛凋亡水平。
caspase-12是ER应激标志性分子,介导非依赖性线粒体的细胞凋亡。活化的caspase-12可以直接通过细胞色素C非依赖途径引起细胞凋亡〔10〕,因此其可以作为检测细胞凋亡的一个很好的蛋白。caspase-12和ER应激有关,而肥胖、高糖及胰岛细胞过度分泌使胰岛β细胞内ER过度负荷,引起细胞凋亡〔11〕。国外相关实验证实通过胃旁路术可以缓解内质网应激,改善胰岛细胞生成环境,减少胰岛细胞凋亡〔12〕。通过实验我们观察到在糖尿病阳性对照组的大鼠维持较高血糖的同时胰岛细胞胞质里存在大量的caspase-12蛋白,且胰岛细胞凋亡增多;相反的情况出现在糖尿病RYGB手术组和C组里。由此我们推测RYGB通过减轻ER应激,调节caspase-12表达来参与胰岛β细胞凋亡,并有效的控制血糖。
本实验血液生化学检查和病理形态结果表明,RYGB能够显著降低糖尿病大鼠的血糖,并能够改善胰岛功能,减少胰岛凋亡,对胰岛起到保护作用。wnt/β-catenin通路和caspase-12在分别参与胰岛细胞凋亡的同时,它们之间也可能存在一些因子进行二者相互的动态调节。wnt/β-catenin和caspase-12的关系及其参与胰岛凋亡的具体机制还需深入研究。
1 Madsbad S,Dirksen C,Holst JJ.Mechanisms of changes in glucose metab-olism and bodyweight after bariatric surgery〔J〕.Lancet Diabet Endocrinol,2014;2(2):152-64.
2 Arterburn DE,Bogart A,Sherwood NE,et al.A multisite study of longterm remission and relapse of type 2 diabetes mellitus following gastric bypass〔J〕.Obes Surg,2013;23(1):93-102.
3 Mansor LS,Gonzalez ER,Cole MA,et al.Cardiac metabolism in a new rat model of type 2 diabetes using high-fat diet with low dose streptozotocin〔J〕.Cardiovasc Diabetol,2013;12(1):1-10.
4 董光龙,徐 晓.胃转流术治疗2型糖尿病的机制〔J〕.中华胃肠外科杂志,2014;17(7):737-40.
5 周广朋,张景岚,张 敏,等.2型糖尿病患者胰岛β细胞功能衰竭与脂联素和抵抗素的临床相关研究〔J〕.中国糖尿病杂志,2014;22(1):51-3.
6 申红梅,刘 超.Wnt信号通路与胰岛β细胞增殖的关系〔J〕.国际内分泌代谢杂志,2010;30(1):44-7.
7 Hoffmeyer K,Raggioli A,Rudloff S,et al.Wnt/β-catenin signaling regulates telomerase in stem cells and cancer cells〔J〕.Science,2012;336(6088):1549-54.
8 Heller C,Kühn MC,Mülders-Opgenoorth B,et al.Exendin-4 upregulates the expression of Wnt-4,a novel regulator of pancreatic β-cell proliferation〔J〕.Am J Physiol Endocrinol Metab,2011;301(5):E864-72.
9 Lin CL,Wang JY,Huang YT,et al.Wnt/β-Catenin signaling modulates survival of high glucose-stressed mesangial cells〔J〕.J Am Soc Nephrol,2006;17(10):2812-20.
10 Mehmeti I,Gurgul-Convey E,Lenzen S,et al.Induction of the intrinsic apoptosis pathway in insulin-secreting cells is dependent on oxidative damage of mitochondria but independent of caspase-12 activation〔J〕.Biochim Biophys Acta,2011;1813(10):1827-35.
11 Biden TJ,Boslem E,Chu KY,et al.Lipotoxic endoplasmic reticulum stress,β cell failure and type 2 diabetes mellitus〔J〕.Trends Endocrinol Metab,2014;25(8):389-98.
12 Martínez-Moreno JM,Garciacaballero M.Influences of the diabetes surgery on pancreatic β-cells mass〔J〕.Nutr Hosp,2013;28(Supl 2):88-94.
