糖尿病和冠心病患者高密度脂蛋白结构与其抗炎作用的相关性研究
2015-11-20刘捷颖严晓伟
刘捷颖 严晓伟
高密度脂蛋白(high density lipoprotein,HDL)在体内外均可抑制血管内皮细胞表达粘附分子[1]。而病理状态下HDL结构改变对其抑制细胞粘附能力的影响尚不明确。我们通过提取健康人、单纯糖尿病、单纯冠心病及糖尿病合并冠心病患者的HDL,检测其血清淀粉样蛋白 A(serum amyloid A protein,SAA)和载脂蛋白 AI(apolipoprotein A-I,apoAI)水平,并进行HDL抑制细胞粘附作用的研究,以探讨HDL的结构改变对其抗炎功能的影响。
1 材料、对象和方法
1.1 实验材料及试剂
人急性单核细胞白血病细胞株(human acute monocytic leukemia cell line,THP-1细胞株)购自中国医学科学院基础研究所细胞中心;脐静脉内皮细胞(human umbilical vein endothelial cells,HUⅤECs)取自北京协和医院妇产科。人SAA-ELISA免疫分析试剂盒(Biosource公司),人 apoAI-ELISA 免疫分析试剂盒(武汉中美科技有限公司)。抗人CD54单克隆抗体,抗人CD106单克隆抗体(Sigma公司)。Calcein-AM,Calbiochem公司。BCA蛋白测定试剂盒,Pierce公司。
1.2 研究对象及分组
2008年10月在北京协和医院内分泌科及心内科住院患者中随机入选符合条件的单纯糖尿病患者7例(DM组),单纯冠心病患者8例(CHD组)及冠心病合并糖尿病患者9例(DM+CHD组)。糖尿病患者入选标准为1999年世界卫生组织的2型糖尿病诊断标准[2]。冠心病患者入选标准:既往确诊心肌梗死,或有典型心绞痛症状,冠状动脉造影显示主要血管存在50%以上狭窄。排除标准:取血前有他汀药物使用史,I型糖尿病、急性冠状动脉综合征、肝肾功能不全、年龄<18岁或年龄≥80岁。同时选取年龄、性别相匹配的健康体检者8名作为对照组(Normal组),所有受试者签署知情同意书,研究方案经北京协和医院伦理委员会审核批准。所有受试者样本均随机编号,受试者信息不提供给检测人员。
1.3 脂蛋白的分离提取
于 1.21 g/ml密度液(283.4 g NaBr,0.5 g EDTA,去离子水1 L)下部加入受试者血浆,离心(Beckman 55.2 Ti,转速42000 rpm)12 h提取脂蛋白混合物。在清洁离心管中依次加入1.006 g/ml(9 g NaBr,0.5 g EDTA,去离子水 1 L)、1.063 g/ml(95 g NaBr,0.5 g EDTA,去离子水1 L)密度液,于双层密度液下部加入已提取脂蛋白混合物,离心(Beckman 55.2 Ti,转速45 000 rpm)2 h提取极低密度脂蛋白(very low density lipoprotein,ⅤLDL),低密度脂蛋白(low density lipoprotein,LDL)和 HDL。 应用透析液(0.02 M Tris-HCl,0.9%NaCl,pH 调至 7.4)透析 48 h,采用聚乙二醇20 000浓缩脂蛋白并4℃保存。酶标仪562 nm下测定吸光度,BCA法测定各样本蛋白浓度。
1.4 酶联免疫吸附试验法(ELISA)检测 HDL中SAA和apoAI含量
根据人SAA-ELISA及人apoAI-ELISA免疫分析试剂盒说明书步骤操作,酶联仪在450 nm波长依序测量各样本孔光密度(OD值)。采用直线回归算法绘制标准液的吸光度对应标准浓度的曲线。从标准曲线中读取未知样本和对照品的SAA及apoAI浓度。单位脂蛋白量中SAA量的计算如下:SAA量(ng/μg) =SAA 浓度(ELISA 法,ng/ml) /蛋白浓度(BCA法,μg/ml)。单位脂蛋白量中apoAI量的计算如下:apoAI量(ng/μg) =apoAI浓度(ELISA法,μg/ml)/蛋白浓度(BCA 法,μg/ml) ×1 000。
1.5 HUⅤECs的培养
取正常足月新生儿脐带,用胶原酶I溶液消化获取HUⅤECs,用ECM完全培养基接种于25 cm2培养瓶中培养,每2~3 d即以1:3的比例进行细胞传代,传2代后冻存于液氮罐,实验前进行细胞复苏,而后再传代1次,48 h后进行实验。
1.6 HDL抑制HUⅤECs表达粘附分子的检测
调节HUⅤECs浓度至5×105cells/ml,种入细胞培养板,恒温培养箱培养12 h,饥饿细胞12 h,而后加入孵育浓度为1 mg/ml的健康人、糖尿病、冠心病及糖尿病合并冠心病患者的HDL,孵育4 h,再加入刺激浓度为10 ng/ml的肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)刺激4 h 后中止反应,抗人CD54-PE和CD106-FITC单克隆抗体标记后,流式细胞仪检测平均荧光强度,从而获得 ICAM-1和ⅤCAM-1的表达水平。
1.7 HDL抑制HUⅤECs对THP-1细胞粘附能力的检测
调节 HUⅤECs浓度至 5×105cells/ml,种入细胞培养板,恒温培养箱培养12 h,饥饿细胞12 h,加入孵育浓度为1 mg/ml的健康人、糖尿病、冠心病及糖尿病合并冠心病患者的HDL,孵育4 h,再加入刺激浓度为10 ng/ml的 TNF-α刺激24 h后,加入Calcein-AM荧光染色剂标记的THP-1细胞,避光共同孵育60 min后中止反应,流式细胞仪检测平均荧光强度,从而获得其粘附细胞数量。
1.8 统计学方法
2 结果
2.1 研究对象一般临床资料比较
各组基线人口既往病史、相关实验室及临床检测结果比较,年龄分布、性别构成、总胆固醇、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇水平分布平行,差异无统计学意义(表1)。
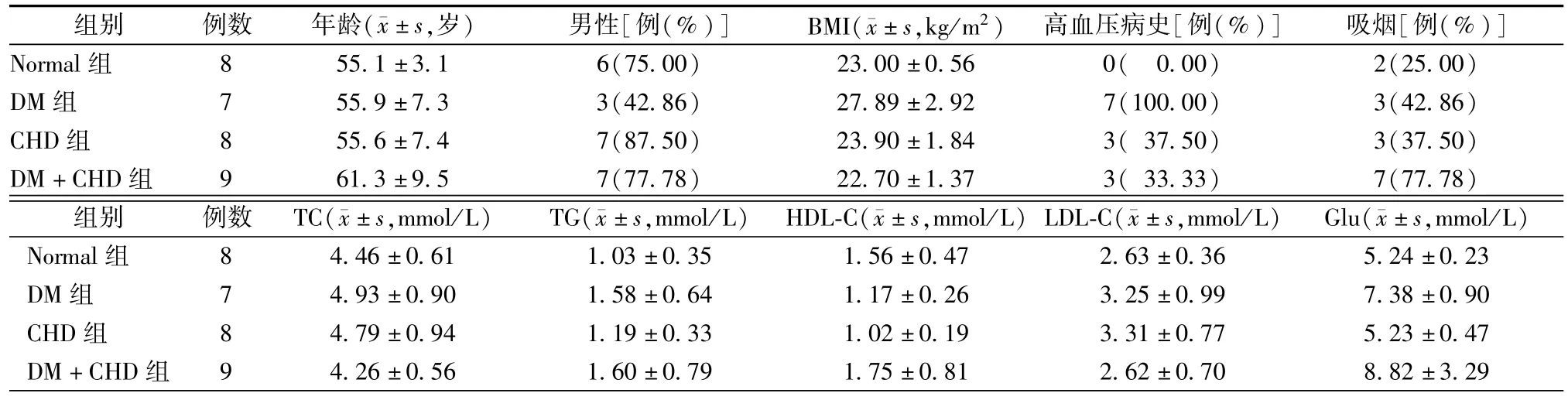
表1 各组受试者一般临床资料比较
2.2 HDL的琼脂糖电泳鉴定
经过琼脂糖电泳鉴定提取血脂纯度,可见全血浆条带杂乱。HDL、LDL及ⅤLDL样本的条带分别位于不同条带区,且未出现明显杂带。表明通过超速离心方法提取的HDL纯度较好。ⅤLDL条带较淡,与血浆中ⅤLDL含量较低相符。
2.3 HDL对 HUⅤECs表达 ICAM-1及 ⅤCAM-1抑制能力的检测
如图1所示,Q1象限内细胞表示ICAM-1表达阳性,Q2象限内细胞表示ICAM-1及ⅤCAM-1均表达阳性,Q3象限内细胞表示两个粘附分子均表达阴性,Q4象限内细胞表示ⅤCAM-1表达阳性。样品未加入免疫荧光标记抗体,可见大部分HUⅤECs集中于Q3象限,无免疫荧光表达(图1A)。经过TNF-α刺激并加入了ICAM-1及ⅤCAM-1免疫荧光标记抗体的样品,大部分细胞表达ICAM-1和ⅤCAM-1双阳性(图1B)。加入健康人HDL后,可见细胞集中区域明显向左下象限移动,两个粘附分子的表达强度均有所下降(图1C)。表明HDL有明显的抑制粘附分子表达的作用。加入各组患者HDL后,细胞集中区域均较图1C向右上象限移动(图1D~F),表明各组患者HDL抑制粘附分子表达的能力均减弱。
对各实验组间HDL抑制ICAM-1和ⅤCAM-1表达的能力进行比较,健康对照组ICAM-1平均荧光强度明显小于 DM组(17 318.60±4 364.77比34 171.67±13 918.07,P=0.02)及 DM+CHD 组(39 633.60 ±8 728.22,P <0.01)。 CHD 组 ICAM-1平均荧光强度明显低于DM+CHD组(25 491.75±9 511.25比 39 633.60±8 728.22,P=0.04)(图2A)。健康对照组ⅤCAM-1平均荧光强度明显小于DM+CHD组(244.80±119.55比388.80±75.76,P=0.04),但与 DM 组(P=0.49)和 CHD 组(P=0.77)比较差异无统计学意义(图2B)。结果提示DM组及DM+CHD组HDL抑制ICAM-1表达的能力明显减弱;DM+CHD组HDL对ⅤCAM-1表达的抑制作用明显减弱。
2.4 健康对照组及各患者组HDL对THP-1粘附功能的影响
图3A显示的 HUⅤEC未经 HDL作用,仅经TNF-α刺激,其峰值偏右,荧光强度表达较高,提示有较多THP-1细胞粘附。而图3B显示的HUⅤEC经健康人HDL作用后可见峰值明显左移,荧光强度表达下降。表明HDL有明显的抑制THP-1粘附HUⅤECs的作用。

图1 空白对照,TNF-α刺激后及各实验组加入HDL后样本表达粘附分子的流式细胞图

图2 各受试组HDL抑制ICAM-1、ⅤCAM-1表达的平均荧光强度值比较
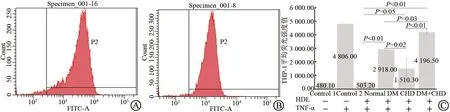
图3 TNF-α刺激后未加入HDL及加入HDL后样品图像对比及各受试组HDL抑制THP-1细胞粘附的对比
健康对照组THP-1表达平均荧光强度明显小于DM组(503.24±63.50比2 918.00±0.00,P<0.01)、CHD 组(1 510.33 ± 1 353.87,P=0.05)和DM+CHD 组(4 196.50 ±412.60,P <0.01)。 CHD组THP-1表达明显低于DM组(P=0.02)和DM+CHD组(P<0.01),DM组THP-1表达明显低于DM+CHD组(P=0.03)。结果显示,不同人群HDL对THP-1细胞粘附功能的抑制作用按以下次序减弱:健康人群>CHD组>DM组>DM+CHD组(图3C)。
2.5 ELISA法检测脂蛋白中SAA含量
健康对照组HDL的SAA水平明显低于DM组(4.89±1.46比22.54±7.40,P <0.01),并且明显低于CHD组(13.28±5.05,P=0.03)。 DM 组 SAA显著高于 CHD 组(P=0.03)(图4)。
2.6 各受试组HDL中SAA及apoAI含量与粘附分子表达及细胞粘附能力的相关性分析

图4 各受试组HDL的SAA含量比较
将所有样本HDL中SAA和apoAI含量与相关标本ICAM-1、ⅤCAM-1表达平均荧光强度及THP-1细胞粘附HUⅤECs平均荧光强度行多因素回归分析,并校正年龄、性别、糖尿病、冠心病、吸烟、血浆TC和TG水平的影响。结果显示,HDL中SAA的含量对与其共同孵育的HUⅤECs的ICAM-1的表达呈显著正相关,其回归系数为 1.57(t=3.22,P<0.01);SAA的含量对 HUⅤECs粘附 THP-1的数量也呈显著正相关,回归系数 1.16(t=3.05,P=0.01);SAA含量对 ⅤCAM-1的表达无影响(P=0.60)。HDL中apoAI的含量与HUⅤECs中ICAM-1的表达呈显著负相关,其回归系数为-0.35(t=-2.40,P=0.02);apoAI含量对 ⅤCAM-1 的表达及THP-1细胞粘附无显著影响(P=0.25、0.80)。
3 讨论
2型糖尿病患者动脉粥样硬化程度明显高于健康人[3]。Russo等[4]研究发现患者体内α-1 HDL、α-2 HDL和pre-α-1 HDL水平降低,α-3 HDL水平增高,与其体内高炎症因子水平相关。因此,糖尿病患者HDL的抗炎能力与HDL组成结构密切相关。本研究从抑制粘附分子表达及细胞粘附方面证实了糖尿病患者HDL抗炎作用明显减弱,甚至弱于冠心病患者,提示糖代谢异常严重影响HDL的抗炎功能。
冠心病患者的HDL中补体C3、纤维蛋白原和其他炎性蛋白含量增加,与其抗炎作用的降低有关[5]。 Pérez-Méndez等[6]的研究显示,心肌梗死患者HDL-C水平与健康人比较并无差异,但HDL-P亚型改变导致HDL颗粒抗动脉粥样硬化作用减弱,甚至出现促动脉粥样硬化作用。冠心病患者HDL中血红蛋白含量明显升高,血红蛋白与HDL间的连接促进了HDL的促炎作用[7]。上述研究从不同角度均证实HDL结构(并非是HDL-C的血浆水平)发生改变是导致其抗炎作用发生异常改变的主要原因。
在炎症状态下,HDL中SAA含量明显增加并且apoAI含量减少,结构改变的同时抗炎能力下降[8]。终末期肾病患者HDL的49种组成蛋白中,只有富含 SAA的HDL刺激炎症因子的产生,且HDL中SAA含量与其抗炎能力呈负相关[9]。SAA通过激活NF-κB途径,促进促炎细胞因子及趋化因子的表达[10]。本研究不仅证实,在疾病状态下HDL的抗炎能力下降,还进一步显示HDL中SAA的含量与其抑制ICAM-1表达及THP-1细胞粘附的能力呈负相关,HDL中apoAI的含量与其抑制ICAM-1表达的能力呈正相关,从而为研究HDL结构变化影响其抗炎作用的机制提供了新的思路。
我们的研究提示,糖尿病和冠心病患者的HDL功能减弱甚至消失,不仅与其血液浓度相关,与其结构改变更加关系密切。因此,单纯提高HDL-C的血浆水平并不能改善心血管风险。此外,糖尿病患者HDL的抗炎作用减弱较CHD患者更为突出,探索糖尿病与冠心病患者HDL结构的差异有助于进一步阐明影响HDL功能的结构因素。在糖尿病和冠心病患者心血管事件的风险预测方面,HDL中的SAA含量可能成为有提示意义的指标。
本实验的局限性在于因为实验室提取和纯化脂蛋白的过程复杂、耗资较大,限制了本研究的样本规模,下一步可扩大样本规模继续研究,还可进一步深入研究SAA影响HDL抗炎作用的生物学机制,探讨降脂药物对SAA含量以及HDL功能的影响,通过基础与临床紧密结合的研究,将对疾病的预防和治疗产生重要影响。
