阿司匹林中乙酰水杨酸含量测定的问题探讨
2015-11-19熊晓丹孙丹吴雪亭伍晓春
熊晓丹+孙丹+吴雪亭+伍晓春
摘要:阿司匹林是生活中常用的一种解热镇痛药,其杂质水杨酸对人体有毒。因此,测定阿司匹林有效成分的含量是药品质量检验的重要内容。现行鲁科版高中教材是选用返滴定法测定其有效成分的含量,在阐述实验原理时,由于忽略了酚钠在盐酸酸化下能形成酚的事实,导致推导的阿司匹林有效成分含量的计算关系式不正确。从定量计算的角度证实在返滴定计量终点时,乙酰水杨酸的存在形式为游离酚而非酚钠,并更正计算关系式。
关键词:阿司匹林;乙酰水杨酸;返滴定法;含量测定
文章编号:1005–6629(2015)10–0091–03 中图分类号:G633.8 文献标识码:B
1 问题的提出
阿司匹林是常用的解热镇痛药之一,由于其杂质水杨酸对人体有毒,因此现行2010年版《药典》将测定其有效成分的含量列为药品质量监控的重要内容。鲁科版《实验化学》[1]教材选用返滴定法测定其有效成分的含量。笔者以复方乙酰水杨酸片(以下简称阿司匹林)为例进行数次实验,并依据教材所给的计算关系式进行计算,但最终算得有效成分的含量远远小于理论值220mg/片。通过对实验过程的反思和实验原理的分析,笔者将问题焦点聚集在教材中有关实验原理的阐述上。教材认为在返滴定过程中,盐酸仅能中和过量的氢氧化钠,而不能酸化溶液中的酚钠盐使之成为酚。因此,本文将从定性分析和定量计算的角度,证实在返滴定终点时酚钠盐已被酸化为酚。
2 实验原理
用盐酸返滴定加有酚酞的阿司匹林待测液时,待测液由红色恰好褪去时即为滴定终点。由酚酞的变色范围可知,此时溶液的pH≈8。查阅资料发现,水杨酸钠中酚羟基的pKa≈12,若加NaOH溶液可将酚羟基转化为酚钠;若继续加盐酸调节溶液的pH<12时,酚钠又恢复为酚羟基。由此,笔者推测阿司匹林待测液在用盐酸返滴定的过程中酚钠被盐酸酸化为酚。在阿司匹林水解、返滴定过程中,所涉及的化学反应有:
(1)乙酰水杨酸的水解
3 实验思路
本文从定性分析和定量计算角度判断返滴定终点时酚钠能否被盐酸酸化为酚。一方面,利用二元酸的pKa1和pKa2数值从理论角度分析水杨酸的存在形式,并用FeCl3溶液对酚进行定性检验的分析方法。另一方面,进行定量分析实验并依据笔者推导的计算关系式,定量计算乙酰水杨酸的含量是否符合药品说明书标示的含量范围。若符合,则说明返滴定终点时酚钠能被盐酸酸化为酚;同时也间接表明教材关于阿司匹林含量的计算关系式表述不正确。
4 实验仪器与试剂
仪器:研钵1个、酸式滴定管1支、碱式滴定管1支、恒温水浴锅1个、分析天平1台、100mL容量瓶1个、移液管(25mL、10mL)各1支、50mL量筒1个、250mL锥形瓶3个、100mL烧杯1个、80mm表面皿1个、玻璃棒1根、胶头滴管1支
药品:邻苯二甲酸氢钾、NaOH溶液、HCl溶液、FeCl3溶液、复方乙酰水杨酸片(西安利君制药有限责任公司生产,国药准字:H61021710)、酚酞试剂、蒸馏水
5 实验过程
5.1 定性分析
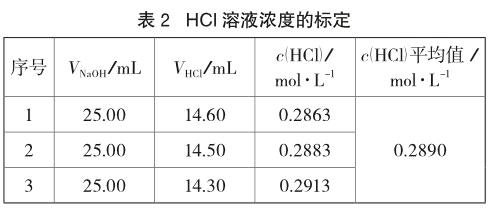
定性分析主要包含理论分析和定性鉴定两部分内容。理论方面,运用二元酸存在形式的分布曲线进行说明。二元弱酸的一级、二级电离平衡常数,常分别用Ka1、Ka2表示。根据二元酸存在形式的分布曲线可知[2],当溶液的pH介于二元酸的pKa1和pKa2之间时,溶液中该二元酸的存在形式主要为其一级电离后的离子。查阅资料发现[3],水杨酸的电离平衡常数分别为Ka1=1.05×10-3,Ka2=4.17×10-13,对应的pKa分别为pKa1=3.00,pKa2=12.38;其次,由酚酞的变色范围可知,在返滴定计量终点时溶液的pH≈8。综上所述,在返滴定达到计量终点时溶液满足pKa1 5.2 定量计算 5.2.1 NaOH溶液浓度的标定 准确称取0.4~0.5g邻苯二甲酸氢钾三份,分别置于250mL锥形瓶中,加25mL蒸馏水,待完全溶解后再加l~2滴酚酞指示剂。用待测NaOH溶液滴定至溶液呈微红色,且半分钟不褪色即为滴定终点,平行测定3次,具体实验数据如表1所示。 5.2.2 HCl溶液浓度的标定 由移液管移取25.00mL NaOH溶液于250mL锥形瓶中,加l~2滴酚酞指示剂。用待测HCl溶液滴定锥形瓶中的NaOH溶液,当溶液的红色恰好褪去时即为滴定终点,平行测定3次。之后,由酸、碱溶液的体积比和NaOH溶液的浓度,计算出HCl标准溶液的浓度,具体实验数据如表2所示。 5.2.3 乙酰水杨酸含量的测定 (1)用分析天平精确称量3片阿司匹林药片的质量,计算出每片阿司匹林药片的质量为0.5132g,用研钵将其研磨成粉末状待用。 (2)称量0.2226g阿司匹林粉末并放入100mL烧杯中,加入50.00mLNaOH标准溶液,盖上表面皿后将其置于80~85℃的恒温水浴中加热15min。 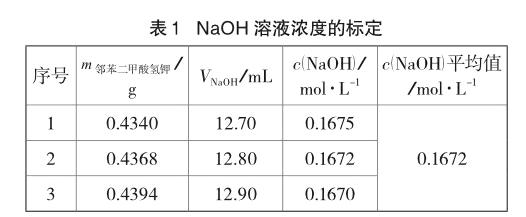
(3)迅速用流水冷却烧杯,将冷却后的溶液定量转移至100mL容量瓶中,稀释至刻度、摇匀,作为阿司匹林待测液。
(4)用移液管准确移取10.00mL阿司匹林待测液于250mL锥形瓶中,加水20mL,滴加2滴酚酞,用HCl标准溶液滴定至溶液的红色恰好消失即为滴定终点,平行测定3次。实验数据如表3所示。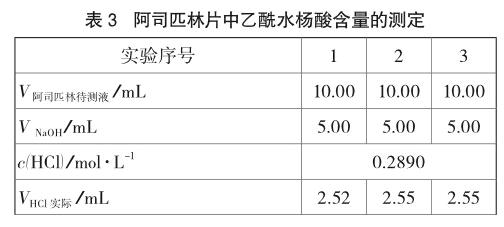

6 实验说明
(1)该实验所用的氢氧化钠和盐酸溶液均为实验室新鲜配置。阿司匹林待测液的水解过程是在80~85℃的恒温水浴中进行,水解时间约15min,水解过程中盛装阿司匹林待测液的烧杯用表面皿盖住封口。
(2)药品说明书标示的乙酰水杨酸含量为220mg/片。2010年的《药典》对乙酰水杨酸含量的实测值规定:片剂中药品含量为标示量的95.0%~105.0%范围内均合理,经折算得到含量的合理范围为209~231mg/片,本文实测值为211.6mg/片,符合药品说明书标示的含量范围。
7 实验结果
本文从定性分析和定量计算角度可以说明,在返滴定时盐酸不仅能中和阿司匹林待测液中过量的氢氧化钠,同时能将酚钠酸化为酚。由此可以断定,使用返滴定法测乙酰水杨酸含量实验的过程中1mol乙酰水杨酸只能消耗2mol NaOH[4]。因此,阿司匹林药片中乙酰水杨酸含量计算的关系式应更正为: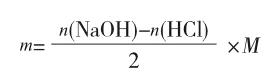
测定阿司匹林中乙酰水杨酸含量的实验,是教师引导学生从定量角度认识有机化合物不同官能团酸性差异的最佳实例,教师应当对该实验有较好的把握,切不可忽视细节。笔者以此为例进行具体分析,希望一线中学教师能在以后该实验的教学中引起重视。
参考文献:
[1]王磊主编.普通高中课程标准实验教科书·实验化学(选修)[M].济南:山东科学技术出版社,2007:81~85.
[2]武汉大学主编.分析化学上册(第五版)[M].北京:高等教育出版社,2007:116~118
[3] http://wenku.baidu.com/link?url=buDUJktnGDtL Asw8qrgonG7QNflt7vaHxFJIcZfUsPeLBfuSXjKQ8MuyNpx04xxC_ps5qSTdXTxlPW6kZgoGU7KGTDvDiTedYvVeFm41XS.
[4]孟哲,张冬亭,王力川.返滴定阿司匹林片剂中乙酰水杨酸含量的实验改进[J].邢台学院学报,2006,21(4):110~111.
