非均相Fenton技术氧化降解废水中N,N-二甲基甲酰胺
2015-11-18朱明乔叶向群
李 微,朱明乔,叶向群,葛 倩
浙江大学化学工程与生物工程学系,浙江 杭州 310027
N,N-二甲基甲酰胺(DMF),具有较好的化学稳定性,对多数有机化合物和无机化合物均有良好的溶解能力,享有“万能溶剂”的美称,被广泛应用于制革、石油化工和医药等行业。但DMF 对环境和人体会造成危害,其可通过呼吸道、消化道和皮肤进入人体内,引起胃肠道紊乱及肝脏肿大等[1-3]。近年来,含DMF 的废水处理受到了广大研究者的关注,关于氧化降解处理含DMF 废水的报道也较多,如Fenton 试剂法[4]、铁炭耦合Fenton 试剂法[5]、铁炭微电解-H2O2法[6]、EGSB-接触氧化法[7]、光催化氧化法[8]和催化湿式氧化(CWAO)法[9]等。但这些方法往往存在处理效果不佳、运行成本高和操作过程复杂等弊端,因此,有必要开发一种经济并高效的处理方法。
Fenton 试剂法是一种高级氧化技术,对一些难降解的有机物具有较好的降解效果,因而受到广泛重视。标准的Fenton 试剂是由Fe2+和H2O2组成,其反应体系是均相的。由于存在反应体系pH 值范围窄,产生的铁泥易造成二次污染的缺点,Fenton 试剂法在工业应用中受到限制。Fenton 试剂非均相化技术,可以克服传统Fenton 试剂适应pH 值范围窄和易产生铁污泥等缺陷,还可对催化剂进行回收利用。目前,常见的非均相Fenton 催化剂主要包括铁粉/铁矿石[10-12]、负载型铁氧化物[13-15]和多金属含铁氧化物[16-18]等。负载型铁氧化物催化剂的常用载体主要有活性炭、三氧化二铝、沸石分子筛、粘土和海泡石等。本工作以价格低廉的活性炭粉末为载体,制备了Fe/C 非均相Fenton 催化剂,并用于废水中DMF 的氧化降解,考察了反应中溶液初始pH 值、H2O2投加量、催化剂投加量和反应温度等因素对DMF 降解效果的影响。
1 实验部分
1.1 催化剂制备
活性炭粉末预处理:取20 g 活性炭粉末(2 400~4 000 μm,即120~200 目),置于500 mL 烧瓶中,加入一定量的去离子水,在80 ℃水浴中搅拌2 h,过滤后再加入去离子水搅拌2 h。最后抽滤,并用热水冲洗后,置于120 ℃烘箱中干燥备用。
Fe/C 催化剂制备:称取5.0 g 预处理过的活性炭粉末,向其中加入200 mL 浓度为0.011 45 mol/L的FeSO4·7H2O 溶液,在30 ℃水浴中搅拌2 h,抽滤,并用一定量的去离子水冲洗,置于120 ℃烘箱中干燥10 h,得到Fe 理论含量为2.5%(质量分数)的Fe/C 催化剂。
1.2 DMF 氧化降解实验
为模拟DMF 废水,配制了1 000 mg/L 的DMF 溶液。取100 mL 该溶液于250 mL 烧瓶中,调节溶液的初始pH 值,置于一定温度的水浴锅中,开启磁力搅拌,达到预定温度后,加入一定质量的Fe/C催化剂及H2O2。反应一定时间后取出,迅速过滤,除去催化剂粉末,取一定量样品进行残余H2O2含量以及Fe 离子含量分析。另外,进行样品化学需氧量(COD)测定前需除去溶液中残余的H2O2,本工作中采用MnO2除H2O2。每个实验重复3 次,实验结果取平均值。
溶液COD 的测定采用烘箱消解-分光光度法(检测波长620 nm);溶液中微量H2O2测定采用钛盐光度法(检测波长400 nm);微量Fe 离子(Fe2+和Fe3+)的测定采用邻菲罗啉比色法(检测波长510 nm)。
2 结果与讨论
2.1 催化剂吸附及催化性能
活性炭载体本身是很好的吸附剂,对水中的有机物一般都具有较好的吸附性。取活性炭载体6.0 g/L,Fe/C 催化剂 6.0 g/L(载体或催化剂在DMF 废水中的浓度),考察了在无H2O2存在条件下,活性炭载体及Fe/C 催化剂吸附作用对COD 去除率的影响,结果如图1所示。从图中可看出,活性炭载体及Fe/C 催化剂对DMF 的吸附率较低,吸附作用只能使溶液COD 的去除率达到20%左右,且Fe/C 催化剂的COD 去除率要比活性炭的略低,这主要是由于催化剂表面吸附了活性组分Fe,故其吸附能力比载体活性炭稍弱。COD去除率在20~120 min 时几乎无变化,这表明吸附过程在20 min 内已基本达到平衡。

图1 无H2O2 存在下活性炭和Fe/C 催化剂吸附作用对COD 去除率的影响Fig.1 Effect of adsorption of C and Fe/C catalyst without H2O2 on COD removal rate
为了证明Fe/C 催化剂对DMF 能起到催化降解作用,还分别考察了H2O2,C 加H2O2、Fe/C 加H2O2对溶液COD 去除率的影响,结果如图2(a)所示。由图可看出,单独的H2O2对DMF 几乎无降解作用,这是由于H2O2的氧化电势比·OH 或·OOH 小很多,且无外部作用条件下,自身能形成·OH或·OOH 的量极少。C 加H2O2组合对DMF 的去除作用与单独采用活性炭差不多,COD 的去除率只有20%左右,这主要归功于活性炭的吸附作用。而Fe/C 加H2O2组合对DMF 的降解效果极为明显,反应20 min,COD 的去除率达到了54.4%。从图2(b)可看出,单独采用H2O2,120 min 内,溶液中的H2O2浓度变化并不大;采用C 加H2O2时,溶液中的H2O2浓度变化较缓慢;而采用Fe/C 加H2O2时,反应20 min,H2O2的浓度从3.0 g/L 降到了0.34 g/L,即在较短的时间内,大量的H2O2与催化剂作用而消耗,产生大量·OH 使DMF 氧化降解。综上可知,该Fe/C 非均相Fenton 催化剂对DMF 能起到较好的氧化降解作用。

图2 不同催化体系下COD 去除率和溶液中H2O2 残留量的变化Fig.2 Changes of COD removal rate and H2O2 residue in solution under different catalytic systems
2.2 非均相Fenton 法氧化降解废水中DMF 的影响因素
非均相Fenton 催化降解DMF 过程有很多影响因素,如初始pH 值、H2O2投加量、催化剂投加量和反应温度等均会影响氧化降解的效果。
2.2.1 初始pH 值对COD 去除率的影响
反应初始pH 值是Fenton 反应体系中的重要影响因素,其控制着催化剂活性、氧化剂活性以及H2O2的稳定性。在其他条件相同的情况下,在溶液初始pH 值分别为2.0,2.5,3.0,4.0,5.0 和6.0时进行Fenton 反应,实验过程中不再调节溶液pH 值,结果如图3所示。
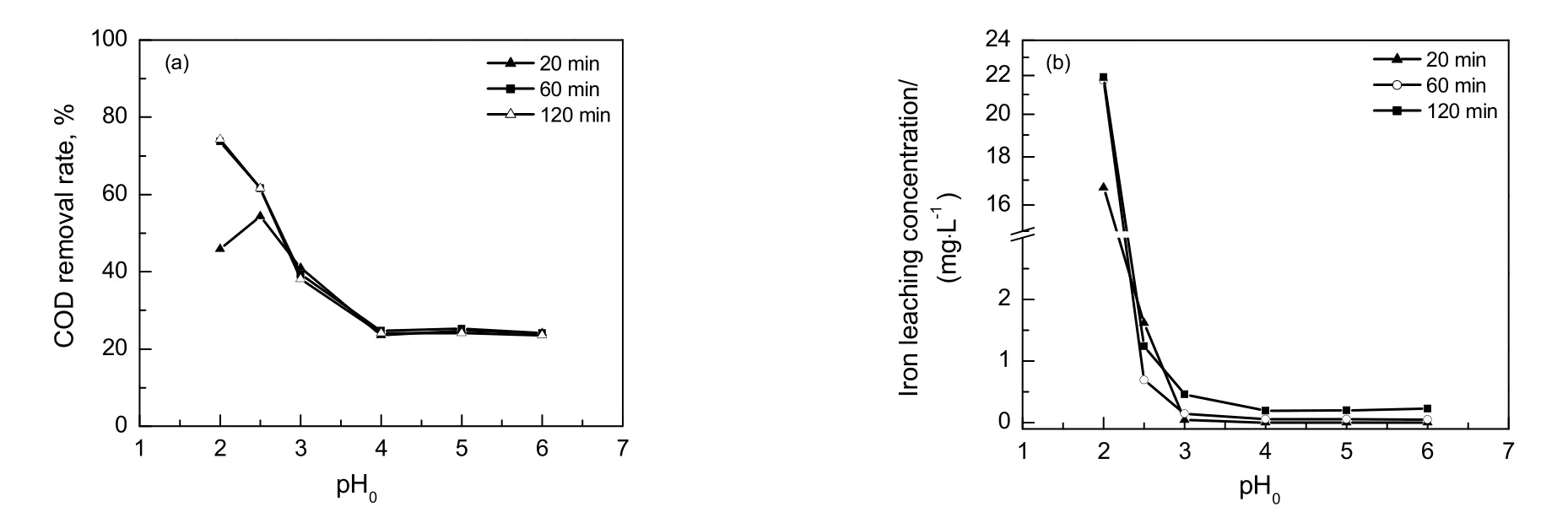
图3 初始pH 值对COD 去除率和溶液中Fe 离子浸出浓度的影响Fig.3 Effect of initial pH value on COD removal rate and iron concentration in solution
由图3(a)可看出,随着初始pH 值的增大,溶液COD 的去除率减小。从反应式(1)和(2)可知,在酸性条件下,催化剂表面的Fe 氧化物形成Fe 离子(Fe2+和Fe3+),Fe 离子和H2O2作用产生·OH。pH 值升高,产生的·OH 减少,COD 去除率降低。反应时间为20 min,pH 值小于2.5 时,COD 的去除率下降,这是因为反应初期,溶液中存在大量的H+,它与H2O2形成H3O2+,而H3O2+比H2O2稳定,故·OH 生成量减少。此外,pH 值过低还会抑制Fe3+还原为Fe2+(反应式(3)),并促进Fe2+与·OH 作用形成Fe3+(反应式(4)),破坏了催化剂Fe3+循环,从而使有机物与·OH 作用机会减少。但随着反应时间的延长,H+会被消耗,pH 值会缓慢升高,抑制作用消除,·OH 生成量快速增加,COD 去除速率加快,故出现反应60 min 后,初始pH 值为2.0 的COD 去除率比初始pH 值为2.5 高的现象。反应时间从60 min 延长到120 min,溶液的COD 去除率基本无变化,这主要是由于反应进行60 min 后,溶液中的H2O2已消耗殆尽。

图3(b)反映了初始pH 值对溶液中Fe 离子浸出浓度的影响。由图中可看出,pH 值越低,溶液中的Fe 离子浓度越大。初始pH 值为2.0 时,溶液中的Fe 离子浓度远远高于pH 值为2.5 时,当pH 值大于4.0 时,溶液中几乎检测不到Fe 离子。初始pH 值高,催化剂表面Fe 离子形成少,也就不容易浸到溶液主体中。综上所述,初始pH 值为2.5 较为适宜,该条件下COD 的去除率较高,且Fe 离子浸出浓度很低。
2.2.2 H2O2投加量对COD 去除率的影响
H2O2是羟基自由基产生的前驱体,所以H2O2的投加量对·OH 的生成量具有很大的影响。理论上,1 g 的DMF 完全被氧化降解需要3.95 g 的H2O2(C3H7NO+17/2 H2O2→3CO2+1/2N2+12H2O)。据此,本工作中DMF 溶液浓度为1 000 mg/L,H2O2投加量从1.5 g/L 到4.5 g/L,结果如图4所示。由图可看出,当H2O2投加量从1.5 g/L 增加到3.0 g/L 时,COD 的去除率显著增加,这主要是因为H2O2量增加导致·OH 的生成量增加,从而使DMF 的降解率提高。但是再增加H2O2投加量到4.5 g/L 时,COD去除率并没有明显提高,这可能是由于过量的H2O2会与·OH 作用(反应式(5)),破坏一部分·OH,产生的过氧羟基自由基·OOH 的氧化能力比·OH 弱很多。此外,过量的H2O2还会造成H2O2的无效分解(反应式(6))。因此,本工作中的H2O2投加量控制在3.0 g/L 为较佳。

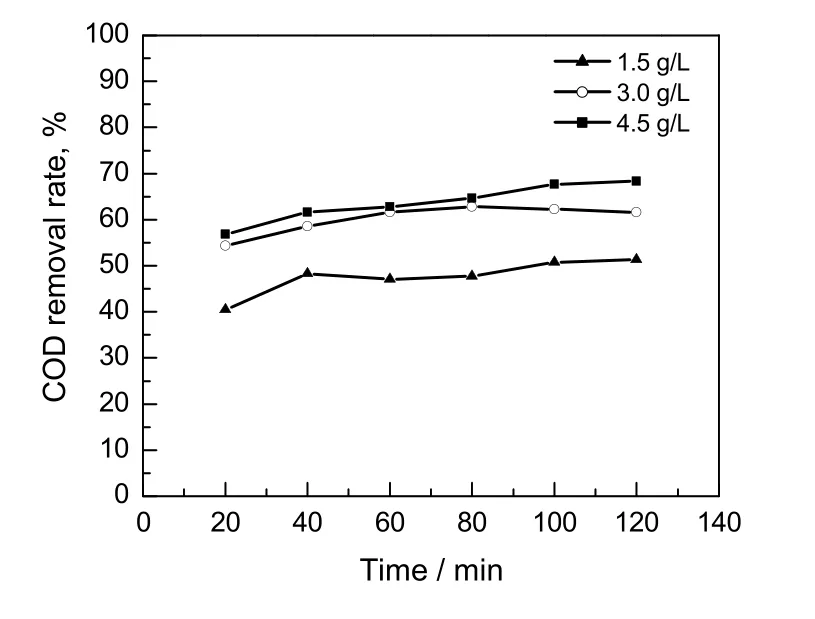
图4 H2O2 投加量对COD 去除率的影响Fig.4 Effect of H2O2 dosage on COD removal rate
2.2.3 催化剂投加量对COD 去除率的影响
催化剂是Fenton 反应过程中的铁源,所以催化剂的投加量会显著影响·OH 的生产量,进而影响DMF 的氧化降解率。实验考察了催化剂投加量分别为3.0,6.0 和9.0 g/L 时,对溶液COD 去除率的影响,结果如图5所示。由图可知,催化剂投加量增多,COD 去除率也增大。这主要是由于催化剂量增加,意味着Fe2+增加,单位时间·OH 产生的速率和数量增加多,反应速率提高,故DMF 的氧化降解率也就较大。但催化剂用量增加的同时,DMF 受吸附去除的作用增强,使COD 去除率有所增加。当催化剂投加量由3.0 g/L 增加到6.0 g/L 时,溶液COD 去除率显著增加,因为充足的Fe2+能使H2O2在较短时间产生大量的·OH。然而再增加催化剂的投加量到9.0 g/L,COD 去除率增加趋势并不明显,这是由于溶液中H2O2的量是一定的,在催化剂量为6.0 g/L 时,反应20 min,H2O2已被消耗大部分,再增加催化剂用量对·OH 的生成促进作用不大,不仅过多的铁会加快H2O2的无效分解,而且部分生成的·OH 来不及与DMF 分子反应,而将过量的Fe2+氧化成Fe3+,消耗了部分·OH(反应式(4))。当催化剂量为3.0 g/L 时,由于铁源较少,H2O2消耗缓慢,所以·OH 生成较慢,COD 去除率呈缓慢上升趋势。综上所述,本工作中催化剂适宜的投加量为6.0 g/L。
2.2.4 反应温度对COD 去除率的影响
反应温度也是Fenton 氧化反应中一个重要影响因素。反应温度对DMF 降解率的影响结果如图6所示。从图6(a)可以看出,反应温度从20 ℃提高到30 ℃时,溶液COD 去除率明显提高,由30 ℃提高到40 ℃,COD 去除率并无提高,反而有略微的降低。从图6(b)可以看出,20 ℃时,溶液中H2O2的减少比较缓慢,这说明了溶液中·OH 生成缓慢,Fenton 反应进行较慢,COD 去除率保持缓慢上升趋势。当反应温度提高到30 ℃以上时,在20 min 内,溶液中的H2O2消耗率达到80%以上,在较短时间内产生了大量·OH,使得COD去除率达到54%以上。之后由于溶液中H2O2含量急剧减少,·OH的生成量极少,对COD 去除率的影响不大。反应温度为40 ℃时,20 min 后,溶液中H2O2的残余量已不到2%,之后溶液中几乎没有·OH 产生,故COD 去除率基本没变化。反应温度高,不仅促进H2O2与Fe2+作用生成·OH,而且会促使H2O2热分解为氧气和水,从而降低H2O2的利用率,所以反应温度应当适宜。本工作中30 ℃为较佳反应温度。
2.3 催化剂稳定性及其回收性
本工作中催化剂在使用后进行回收,每次用去离子水冲洗后,置于120 ℃烘箱中干燥10 h 以上。催化剂进行了4 次回收使用,结果如图7所示。从图7(a)中可看出,随着催化剂使用次数的增加,溶液的COD 去除率有所下降。催化剂使用5 次,反应2 h 时,溶液COD 去除率从初次使用时的61.6%降至48.9%。由于在回收过程中并没有对催化剂做脱附处理,所以在每次使用后,催化剂可能吸附了DMF 或其他小分子有机物,再次使用时,吸附性会变弱,影响COD 去除率。此外,该催化剂表面主要以Fe2+为主,反应过程中Fe2+较快变为Fe3+,而Fe3+转变为Fe2+的速率很慢。Fenton 氧化反应主要受Fe2+控制,而随着催化剂使用次数增多,催化剂表面的Fe3+逐渐增多,相应的Fe2+减少,这将使得·OH的生成量减少,导致COD 去除率降低。图7(b)反映了催化剂使用次数与溶液中Fe 离子浸出浓度的关系,随着使用次数的增加,Fe 离子浸出浓度呈下降趋势。初次使用时Fe 离子浸出浓度较高,使用3 次以后,Fe 离子浸出浓度已经很小,基本再无变化。这可能是由于初次使用的催化剂,其表面有些Fe 与活性炭作用不稳固,容易浸出,回收使用后,催化剂表面结合不稳定的Fe 减少,故Fe 离子浸出浓度减少。

图7 催化剂使用次数对COD 去除率和溶液中Fe 离子浸出浓度的影响Fig.7 Effect of catalyst reuse times on COD removal rate and iron concentration in solution
3 结 论
Fe/C 非均相Fenton 催化剂对DMF 氧化降解的较佳工艺条件为:初始pH 值2.5,H2O2的投加量3.0 g/L,催化剂投加量6.0 g/L,反应温度30 ℃。1 000 mg/L 的DMF 溶液在该条件下,反应60 min,COD 去除率达到了61.6%,且Fe 离子浸出浓度很小,仅有0.7 mg/L。活性炭负载铁催化剂,其制备方法简单,氧化降解DMF 的工艺操作简单易行,在降解DMF 过程中表现出较好的催化性能,且催化剂稳定性尚可,作为一种非均相Fenton 催化剂,有望推广应用于其他难降解有机废水的处理。
[1]王 为, 谢凯娜.DMF 对制革废水处理的影响及处理方法[J].中国皮革, 2005, 34(19):36-37.Wang Wei, Xie Kaina.Impact of DMF on tannery wastewater treatment and the treatment method[J].China Leather, 2005, 34(19):36-37.
[2]宋姗姗, 张林生.N,N-二甲基甲酰胺(DMF)废水处理研究进展[J].江苏环境科技, 2007, 20(3):67-70.Song Shanshan, Zhang Linsheng.Advances in DMF-containing wastewater treatment[J].Jiangsu Environmental Science and Technology,2007, 20(3):67-70.
[3]Long G, Meek M E.N,N-dimethylformamide:hazard characterization and exposure-response analysis[J].Journal of Environmental Science and Health, Part C:Environmental Carcinogenesis and Ecotoxicology Reviews, 2001, 19(1):161-187.
[4]彭芳光.Fenton 试剂法处理DMF 的研究[J].广东化工, 2012, 39(3):121-122.Peng Fangguang.Study on treatment of DMF by Fenton reagent[J].Guangdong Chemical Industry, 2012, 39(3):121-122.
[5]董磐磐, 程爱华, 李 杰, 等.铁炭耦合Fenton 试剂预处理DMF 废水的研究[J].工业用水与废水, 2012, 43(3):8-11.Dong Panpan, Cheng Aihua, Li Jie, et al.Pretreatment of DMF wastewater by iron-carbon micro-electrolysis process combined with Fenton reagent[J].Industrial Water and Wastewater, 2012, 43(3):8-11.
[6]钟先锦, 陆学圣.铁炭微电解-H2O2法降解二甲基甲酰胺废水[J].环境污染与防治, 2012, 34(1):31-32.Zhong Xianjin, Lu Xuesheng.Degradation of dimethylformamide wastewater by iron-carbon microelectrolysis combined with H2O2[J].Environmental Pollution and Control, 2012, 34(1):31-32.
[7]王毅军, 张振家.EGSB-接触氧化工艺处理DMF 废水[J].工业用水与废水, 2007, 38(1):94-95.Wang Yijun, Zhang Zhenjia.Treating DMF wastewater using EGSB-biological contact oxidation process[J].Industrial Water and Wastewater, 2007, 38(1):94-95.
[8]刘志国.DMF 废水资源化无害化处理研究[D].南京:南京工业大学, 2005.
[9]Grosjean N, Descorme C, Besson M.Catalytic wet air oxidation ofN,N-dimethylformamide aqueous solutions:deactivation of TiO2and ZrO2-supported noble metal catalysts[J].Applied Catalysis B:Environmental, 2010, 97(1/2):276-283.
[10]He J, Tao X, Ma M H, et al.Heterogeneous photo-Fenton degradation of an azo dye in aqueous H2O2/iron oxide dispersions at neutral pH[J].Chemistry Letters, 2002, 31(1):86-87.
[11]Pinto I S X, Pacheco P H V V, Coelho J V, et al.Nanostructuredδ-FeOOH:an efficient Fenton-like catalyst for the oxidation of organics in water[J].Applied Catalysis B:Environmental, 2012, 119/120:175-182.
[12]Weng C H, Lin Y T, Chang C K, et al.Decolourization of direct blue 15 by Fenton/ultrasonic process using a zero-valent iron aggregate catalyst[J].Ultrasonics Sonochemistry, 2013, 20(3):970-977.
[13]Duartea F, Maldonado-Hódarb F J, Madeira L M.New insight about orange II elimination by characterization of spent activated carbon/Fe Fenton-like catalysts[J].Applied Catalysis B:Environmental, 2013, 129:264-272.
[14]Parida K M, Pradhan A C.Fe/meso-Al2O3:An efficient photo-Fenton catalyst for the adsorptive degradation of phenol[J].Industrial &Engineering Chemistry Research, 2010, 49(18):8310-8318.
[15]Yaman Y C, Gündüz G, Dükkancı M.Degradation of CI reactive red 141 by heterogeneous Fenton-like process over iron-containing ZSM-5 zeolites[J].Coloration Technology, 2012, 129(1):69-75.
[16]Liu L, Zhang G, Wang L, et al.Highly active S-modified ZnFe2O4heterogeneous catalyst and its photo-Fenton behavior under UV- visible irradiation[J].Industrial &Engineering Chemistry Research, 2011, 50(12):7219-7227.
[17]Rossi A F, Amaral-Silva N, Martins R C, et al.Heterogeneous Fenton using ceria based catalysts:effects of the calcinations temperature in the process efficiency[J].Applied Catalysis B:Environmental, 2012, 111/112:254-263.
[18]Karthikeyan S, Boopathy R, Gupta V K, et al.Preparation, characterizations and its application of heterogeneous Fenton catalyst for the treatment of synthetic phenol solution[J].Journal of Molecular Liquids, 2013, 177:402-408.
