基因检测指导Ⅱ、ⅢA期非小细胞肺癌术后辅助化疗的临床研究
2015-11-18翟春波胡德宏李伟
翟春波,胡德宏,李伟
基因检测指导Ⅱ、ⅢA期非小细胞肺癌术后辅助化疗的临床研究
翟春波,胡德宏△,李伟
目的探讨以基因检测为指导的非小细胞肺癌(NSCLC)术后个体化治疗的效果。方法将接受全胸腔镜肺癌根治术的Ⅱ、ⅢA期NSCLC患者56例随机分为个体化治疗组26例和非个体化治疗组30例,取个体化治疗组患者新鲜肿瘤组织进行基因检测,检测靶标包括切除修复交叉互补复合体1(ERCC1)、核苷酸还原酶亚单位1(RRM1)、β微管蛋白Ⅲ、胸苷酸合成酶(TS)、表皮生长因子受体(EGFR)、乳腺癌敏感蛋白1(BRCA1)等。个体化治疗组根据检测结果制定化疗方案,非个体化治疗组采用“吉西他滨+顺铂”方案,比较2组1年、2年无疾病生存率(DFS)、疾病无进展生存期(PFS)和总生存期(OS)。结果个体化治疗组2年DFS(57.69%)、PFS(月:22.1±5.0)和OS(月:24.1±3.2)均高于非个体化治疗组(分别是30.00%、18.9±6.2、21.9±4.3,均P<0.05);2组1年DFS(88.46%vs 83.33%)差异无统计学意义。结论基于基因检测的个体化治疗可以提高NSCLC术后的2年DFS、PFS和OS,提高化疗的有效率。
癌,非小细胞肺;化学疗法,辅助;无病生存;Kaplan-Meiers评估;基因检测;个体化治疗
目前肺癌的发病率和死亡率已居所有癌症的首位,其中85%以上是非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。手术结合化疗等综合治疗早中期NSCLC的术后5年生存率不尽人意,Ⅰ期5年生存率约为70%,Ⅱ期约为50%,Ⅲ期约为15%~30%[2]。肿瘤对化疗药物耐药是影响化疗效果的主要因素之一。近年来,有研究显示耐药与肿瘤某些基因的突变及表达有关,如切除修复交叉互补复合体1(excision repair cross complementing 1,ERCC1)基因过度表达导致铂类耐药[3];核苷酸还原酶亚单位1(ribonucleotide reductase subunit M1,RRM1)过度表达导致吉西他滨耐药[4]。然而,这些研究或者局限于某一种化疗药物的耐药性研究,或者只是对晚期NSCLC进行基因检测指导下的个体化治疗[5-6],对以手术后的NSCLC患者进行基因检测为指导的个体化治疗的研究较少。本研究对接受肺癌根治术的NSCLC患者进行基因检测,根据检测结果拟定个体化治疗方案,旨在探讨以基因检测为指导的NSCLC术后个体化治疗的效果。
1 资料与方法
1.1 一般资料选择2012年6月—9月于我院胸外科接受全腔镜肺癌根治术,根据第八版病理分期标准[7]为Ⅱ期、ⅢA期,且功能状态(performance status,PS)评分≤1分的NSCLC患者56例,其中男30例,女26例,年龄45~68岁,平均(56.5±4.3)岁。采用完全随机法将其分为个体化治疗组26例和非个体化治疗组30例。2组性别、年龄、组织类型及病理分期差异均无统计学意义,见表1。本研究经院伦理委员会审核批准,并向患者及家属详细说明治疗方案的费用、风险、利弊,患者及家属均签署知情同意书。
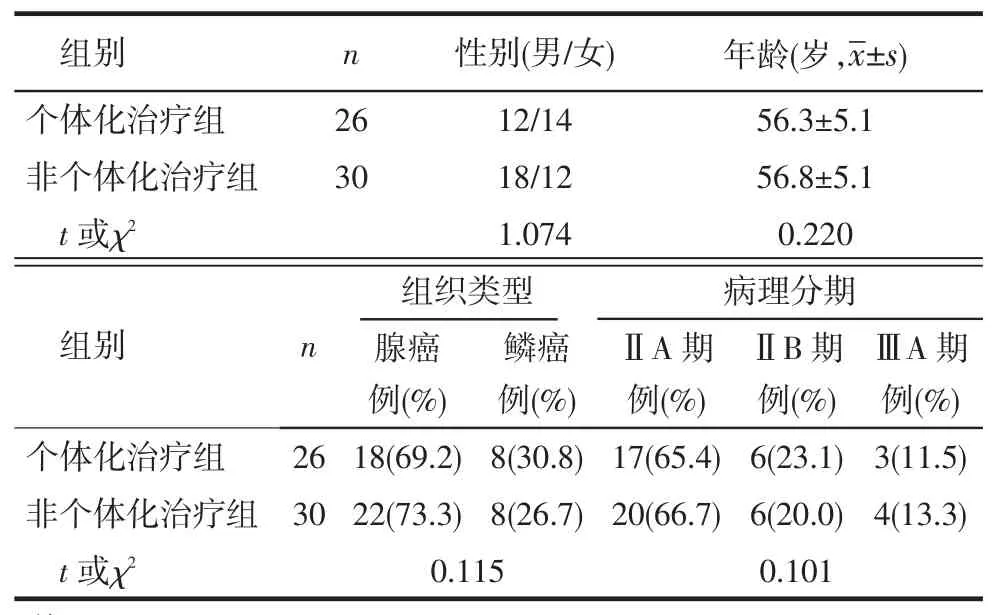
Tab.1 Comparison of clinical data between two groups表1 2组临床资料比较
1.2 治疗方案
1.2.1 非个体化治疗组对NSCLC的化疗以美国国立综合癌症网络(NCCN)推荐的铂类联合第3代化疗药的两药化疗方案为主[1],一线均用吉西他滨+顺铂方案化疗,二线应用多西他赛+顺铂方案化疗,共4个周期。
1.2.2 个体化治疗组取个体化治疗组患者的新鲜肿瘤组织,于术后3 d内交由广州益善生物技术有限公司进行基因检测,检测靶标包括ERCC1、RRM1、乳腺癌敏感蛋白1(BRCA1)、β微管蛋白Ⅲ(β-tubulinⅢ)、胸苷酸合成酶(TS)、表皮生长因子受体(EGFR),检测采用液相芯片检测技术,详细过程见参考文献[8]。以mRNA表达<25%为低表达,25%~50%为中表达,>50%为高表达。根据据基因突变及表达情况,制定个体化的治疗方案。RRM1低表达,ERCC1或BRCA1低表达选用吉西他滨+顺铂方案;β-tubulinⅢ基因低表达,ERCC1或BRCA1低表达选用多西他赛+顺铂方案;TS和RRM1低表达,ERCC1和BRCA1高表达选用多西他赛+吉西他滨方案;TS低表达,ERCC1或BRCA1低表达选用多西他赛+顺铂方案。以表达量最低的基因对应的方案为一线治疗方案;以表达量次低的基因对应的方案为二线治疗方案,如果所有的靶标均为中、高表达则不进行术后化疗;如EGFR有突变,则在一线治疗方案无效的情况下选用吉非替尼。
1.2.3 治疗安排(1)患者术后辅助化疗均从术后3~4周开始,PS评分≤1分才能接受化疗,1分<PS评分≤2分才能接受靶向治疗。(2)每化疗2个周期进行全面检查以评估疗效,出现以下任一情况视为肿瘤进展:胸部CT提示纵隔淋巴结较术后明显增大;辅助检查发现肺、脑、骨、肝、肾、肾上腺等的转移。(3)一线治疗方案化疗2个周期后复查,如无进展则继续一线方案化疗至4个周期,如肿瘤进展则改为二线方案或靶向治疗。二线方案化疗2个周期后复查,如无肿瘤进展则继续二线方案,如肿瘤进展则改为三线方案。(4)化疗期间如出现轻-中度的骨髓抑制可应用粒细胞集落刺激因子和重组人白介素-11治疗,如出现严重的骨髓抑制需终止化疗或改为靶向治疗。(5)化疗后如肿瘤无进展,则每3个月复查1次,发现肿瘤进展时先继续原方案,如无效则转为二线方案。(6)治疗过程中未发现肿瘤进展视为有效。
1.3 测量指标(1)1年和2年无疾病生存率(disease free survival,DFS)。(2)疾病无进展生存期(progression-free surviv⁃al,PFS)和总生存期(overall survival,OS)。PFS为从随机化当天到首次证实为疾病复发或任何原因所致死亡(以先发者为准)的时间;OS为随机化当天至出现任何原因所致死亡的时间。
1.4 随访化疗期间每月随访1次,化疗4个周期结束后每3个月随访1次,随访方式包括门诊复查、电话随访及书信随访,随访内容包括患者有无咳嗽、咯血、疼痛、声嘶等症状,并行胸部强化CT、腹部彩超等检查,如怀疑有骨转移、脑转移时加做颅脑MRI、全身骨扫描等检查,根据这些检查结果来判定是否存在复发或转移。
1.5 统计学方法数据采用SPSS 17.0软件进行数据分析,计数资料组间比较采用χ2检验;计量资料组间比较采用t检验;PFS和OS用Kaplan-Meier法绘制生存曲线,P<0.05为差异有统计学意义。
2 结果
2.1 个体化治疗组基因检测结果ERCC1基因低、中、高表达分别有10、11、5例;BRCA1基因低、中、高表达分别有9、11、6例;ERCC1和BRCA1均高表达者有3例;RRM1基因低、中、高表达分别有9、5、12例;β-tubulinⅢ基因低、中、高表达分别有11、5、 10例;EGFR突变5例,无靶标均为中、高表达者。
2.2 随访情况随访时间为2012年7月—2014年10月,个体化治疗组、非个体化治疗组分别随访(23.2±3.9)和(21.2±3.3)个月。个体化治疗组1例患者于第2年失访;非个体化治疗组1例于第1年失访,1例于第2年失访,失访者均按死亡处理。
2.3 疗效分析个体化治疗组2年DFS、PFS和OS均高于非个体化治疗组(均P<0.05);2组1年DFS差异无统计学意义,见表2、图1~2。
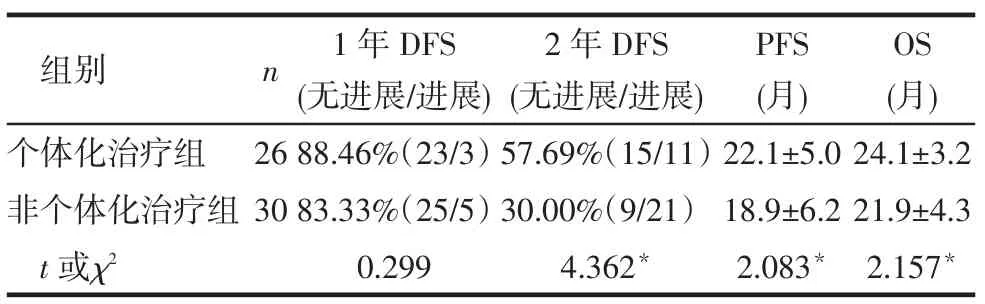
Tab.2 Comparison of efficiency of chemotherapy between two groups表2 2组治疗效果比较
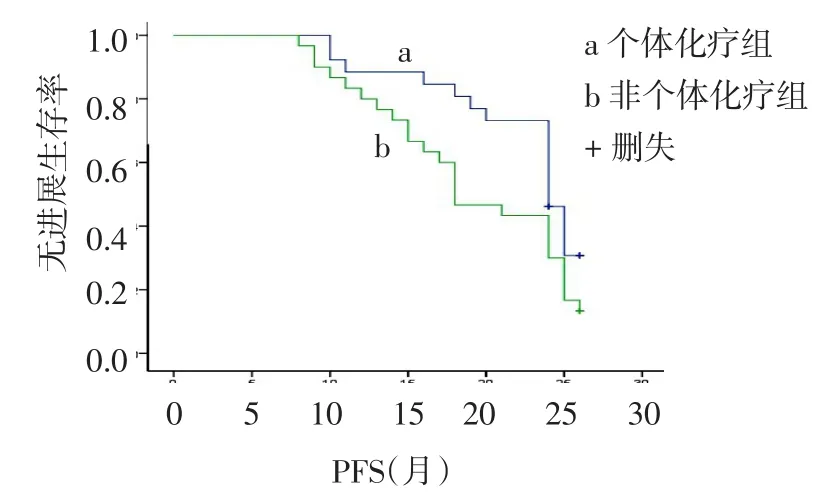
Fig.1 Comparison of survival curves of PFS between two groups图1 2组PFS生存曲线
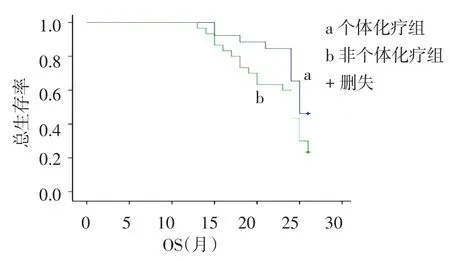
Fig.2 Comparison of survival curves of OS between two groups图2 2组OS生存曲线
3 讨论
临床实践证实,仅1/3左右的患者能从化疗中获益,且由于肿瘤异质性的存在,不同患者对化疗的敏感性也不同。近年来研究表明,肿瘤对化疗药物的耐药与肿瘤基因的突变及过度表达有关,ERCC1和BRCA1基因过度表达可导致铂类耐药,RRM1基因过度表达可导致吉西他滨耐药[3-5,9],β-tubulinⅢ基因高表达可导致紫杉醇类药物耐药[10],而TS高表达可导致培美曲塞耐药[11]。因此,目前国际推荐肺癌标准化治疗时,最好依据耐药基因及药敏结果来选择化疗方案[12]。
本研究显示,个体化治疗组2年DFS、PFS和OS均明显优于非个体化治疗组,这与以往研究结果一致[5,13],提示根据基因检测结果来选择敏感的化疗药物,能避免化疗的盲目性,从而提高患者的2年DFS、PFS和OS,该结果初步显示依据肿瘤基因突变及表达情况来选择个体化治疗方案,能提高化疗的有效率及延长患者的生存期。
另外,本研究显示,个体化治疗组和非个体化治疗组1年DFS差异无统计学意义,这可能与疾病进展的判定手段有关。目前判定肿瘤是否进展主要通过CT、MRI、彩超、PET-CT等,但这些检查手段均不能发现微小的复发或转移病灶[13],导致一些已经有微转移但未被发现的患者划归到无进展者中造成假阴性。
本研究初步显示了根据基因检测结果制定NSCLC术后个体化治疗方案在2年DFS、PFS及OS等方面的优势,即基于基因检测的个体化治疗可能会提高术后辅助化疗的短期疗效,但是对于3年、5年DFS等远期疗效是否有优势还需进一步研究。另外,在随访的过程中也发现,2组中的ⅢA期患者多数在术后第1年即出现复发或转移,提示肿瘤病理分期对肿瘤的复发或转移仍然具有重要意义,因此有待根据病理类型、病理分期等进一步分层研究。
[1]Ettinger DS,Akerley W,Borghaei H,et al.Non-small cell lung can⁃cer,version2.2013[J].J Natl Compr Canc Netw,2013,11(6):645-653.
[2]Yan CH,Ma YJ,Li XY,et al.Reseach progress of post-operative ad⁃juvant chemotherapy in non-samll cell lung cancer[J].China Medi⁃cal Herald,2013,10(36):47-50.[颜才华,马一杰,李晓阳,等.非小细胞肺癌术后个体化辅助治疗研究进展[J].中国医药导报,2013,10(36):47-50].
[3]Jiang J,Liang X,Zhou X,et al.ERCC1 expression as a prognostic and predictive factor in patients with non-small cell lung cancer:a meta-analysis[J].Mol Biol Rep,2012,39(6):6933-6942.doi:10.1007/ s11033-012-1520-4.
[4]Mlak R,Krawczyk P,RamlauR,et al.Predictive value of ERCC1 and RRM1 gene single-nucleotide polymorphisms for first-line plati⁃num-and gemcitabine-based chemotherapy in non-small cell lung cancer patients[J].Oncol Rep,2013,30(5):2385-2398.doi:10.3892/ or.2013.2696.
[5]Ren SX,Li AW,Zhou SW,et al.Individualized chemotherapy in ad⁃vanced NSCLC patients based on mRNA levels of BRCA1andRRM1[J].Chin J Cancer Res,2012,24(3):226-231.doi:10.1007/s11670-012-0226-4.
[6]Song Y,Yang W.Medical treatment of advanced non-small cell lung cancer:progress in 2014[J].Med J Chin PLA,2015,40(1):10-15.[宋勇,杨雯.2014年晚期非小细胞肺癌内科治疗进展[J].解放军医学杂志,2015,40(1):10-15].
[7]Rami-Porta R,Bolejock V,Giroux DJ,et al.The IASLC lung can⁃cer staging project:the new database to inform the eighth edition of the TNM classification oflung cancer[J].J Thorac Oncol,2014,9(11):1618-1624.doi:10.1097/JTO.0000000000000334.
[8]Hu YZ,Wang W,Shang LQ,et al.Suspension biochip versus immuno⁃histochemistry for ERCC1 and RRM1 detection in non-small cell lung cancer[J].Chin J Clin Onco,2013,40(6):349-353.[胡艳正,王伟,尚立群,等.液相芯片与免疫组织化学方法检测非小细胞肺癌ERCC1和RRM1表达的比较研究[J].中国肿瘤临床,2013,40(6):349-353].doi:10.3969/j.issn.1000-8179.2013.06.012.
[9]Hubner RA,Riley RD,Billingham LJ,et al.Excision repair crosscomplementation group 1(ERCC1)status and lung cancer outcomes:a meta-analysis of published studies and recommendations[J].PLoS One,2011,7(10):e25164.doi:10.1371/journal.pone.0025164.
[10]Zhang HL,Ruan L,Zheng LM,et al.Association between class III βtubulin expression and response to paclitaxel/vinorelbine-based chemotherapy for non-small cell lung cancer:a meta-analysis[J]. Lung Cancer,2012,77(1):9-15.doi:10.1016/j.lungcan.2012.01.005.
[11]Liu Y,Yin TJ,Zhou R,et al.Expression of thymidylate synthase predicts clinical outcomes of pemetrexed-containing chemotherapy for nonsmall-cell lung cancer:a systemic review and meta-analysis[J].Cancer Chemother Pharmacol,2013,72(5):1125-1132.doi:10.1007/s00280-013-2299-2.
[12]Vilmar AC,Sorensen JB.Customising chemotherapy in advanced non-small cell lung cancer:daily practice and perspectives[J].Eur⁃Respir Rev,2011,20(119):45-52.doi:10.1183/09059180.00007310.
[13]Yang QJ,Zhang Q,Hu M,et al.Individualized treatment of postopera⁃tive patients with lung adenocarcinoma guided by genetic testing re⁃sults[J].ActaUniversitatisMedicinalisAnhui,2013,48(9):1130-1132.[杨清杰,张强,胡蒙,等.以基因检测结果为指导的肺腺癌术后个体化治疗效果分析[J].安徽医科大学学报,2013,48(9):1130-1132].
(2014-12-01收稿2015-04-30修回)
(本文编辑陈丽洁)
Clinical study of postoperative individualized chemotherapy based on genetic testing results for non-small cell lung cancer
ZHAI Chunbo,HU Dehong△,LI Wei
Department of Toracic Surgery,Weifang People's Hospital,Weifang 261041,China△
ObjectiveTo explore the efficiency of postoperative individualized chemotherapy based on genetic testing results for non-small cell lung cancer(NSCLC).MethodsFifty-six NSCLC patients at stageⅡorⅢA who accepted videoassisted thoracic operation were divided into two groups:the individualized chemotherapy group(n=26)and non individual⁃ized chemotherapy group(n=30).The fresh lung tumor tissue of individualized chemotherapy group was tested target gene,in⁃cluding excision repair cross complementing 1(ERCC1),ribonucleotide reductase subunit M1(RRM1),β-tubulinⅢ,thymi⁃dylate synthase(TS),epidermal growth factor receptor(EGFR)and breast cancer gene 1(BRCA1).The theraputic plan was based on genetic testing results in individualized chemotherapy group,and the non individualized chemotherapy group re⁃ceiving gemcitabine plus cisplatin.The 1-year disease free survival(DFS),2-year disease free survival(DFS),the progres⁃sion-free survival(PFS)and the overall survival(OS)were compared between two groups.ResultsThe 2-year DFS(57.69%),PFS(22.1±5.0 months)and OS(24.1±3.2 months)were significantly higher in the individualized chemotherapy group than those of non individualized chemotherapy group(respectively 30.00%,18.9±6.2 months,21.9±4.3 months,P<0.05).There was no significant difference in 1-year DFS between two groups(88.46%vs 83.33%,P<0.05).Conclusion The individualized chemotherapy based on genetic testing results can enhance the 2-year DFS,PFS,OS and the efficiency of postoperative adjuvant chemotherapy for NSCLC.
carcinoma,non-small-cell lung;chemotherapy,adjuvant;disease-free survival;Kaplan-Meiers estimate;genetic testing;individualized chemotherapy
R73-36+1
A
10.11958/j.issn.0253-9896.2015.09.020
潍坊市卫生局科研项目计划资助[(2014)第015号]
潍坊市人民医院胸外科(邮编261041)
翟春波(1980),男,主治医师,硕士,主要从事肺癌、食管癌的微创治疗及综合治疗研究
△通讯作者E-mail:dehong898@163.com
