调节性T细胞和CD8+T细胞在恶性黑色素瘤中的表达及其与预后的关系
2015-11-18苏月颖安秀梅赵华魏枫张新伟
苏月颖,安秀梅,赵华,魏枫,张新伟
调节性T细胞和CD8+T细胞在恶性黑色素瘤中的表达及其与预后的关系
苏月颖,安秀梅,赵华,魏枫,张新伟△
目的探讨调节性T细胞(Tregs)和CD8+T细胞在黏膜恶性黑色素瘤和肢端恶性黑色素瘤局部免疫微环境中表达情况的差异,及其与患者预后的关系。方法采用免疫组织化学染色法对58例恶性黑色素瘤组织进行染色,检测Foxp3+Tregs和CD8+T细胞的浸润情况,分析两者与临床病理指标及预后的相关性。结果Foxp3与CD8+T细胞阳性表达无相关关系。黏膜恶性黑色素瘤组织中Foxp3+Tregs数量明显高于肢端恶性黑色素瘤(t=2.648,P= 0.011);肿瘤直径≥3 cm、有淋巴结转移、有远处转移的恶黑患者Foxp3highTregs相对较高(P<0.05)。存在溃疡的恶性黑色素瘤患者中,CD8high组所占比例明显高于无溃疡者(33.3%vs 5.9%,P<0.05)。Foxp3high组的中位无进展生存期(PFS)是12个月,明显低于Foxp3low组(31个月);CD8high组的中位PFS是25个月,明显高于CD8low组(中位PFS 12个月);亚组分析显示Foxp3highCD8low组患者中位PFS是7个月,明显低于Foxp3highCD8high组(25个月)、Foxp3lowCD8low组(18个月)以及Foxp3lowCD8high组(59个月)。不同肿瘤位置、Foxp3+Treg数量、CD8+T细胞数量、有无远处转移的恶性黑色素瘤患者中位PFS不同。结论Tregs的数量与恶性黑色素瘤的进展密切相关,黏膜恶性黑色素瘤预后欠佳可能与Tregs浸润有关。
黑色素瘤;T淋巴细胞;CD8阳性T淋巴细胞;肿瘤逃逸;预后
调节性T细胞(regulatory T cells,Tregs)是一种具有免疫抑制功能的T细胞亚群,能够促进肿瘤发生和转移,是多种肿瘤预后不良的独立预测因素之一。Foxp3为叉头样转录因子家族成员之一,特异性表达于Tregs,并且与Tregs的发育和免疫抑制功能的发挥密切相关[1]。文献报道,浸润性CD8+T细胞数量与肿瘤患者的预后呈正相关[2-3]。本研究采用Foxp3作为Tregs标记,使用免疫组化法检测恶性黑色素瘤中Tregs和CD8+T细胞的浸润情况,并分析两者与临床病理因素和预后的关系。
1 资料与方法
1.1 一般资料选取我院病理科2003年1月—2014年6月恶性黑色素瘤组织病理学蜡块58例,均经术后病理确诊为恶性黑色素瘤。女35例,男23例,年龄23~89岁,中位年龄61岁,<60岁者24例,≥60者34例;黏膜恶性黑色素瘤21例,皮肤恶性黑色素瘤37例;有淋巴结转移者24例,无淋巴结转移者34例;有远处转移者18例,无远处转移者40例;28例皮肤恶性黑色素瘤中ClarkⅡ级10例,ClarkⅢ级7例,ClarkⅣ级7例,ClarkⅤ级4例,另9例皮肤恶性黑色素瘤及21例黏膜恶性黑色素瘤未进行Clark分级。
1.2 主要试剂鼠抗人Foxp3单克隆抗体(PCH101)购自美国eBioscience公司,CD8单克隆抗体购自英国abcam公司。En-Vision两步法免疫组织化学检测试剂盒购自福州迈新生物技术有限公司。DAB显色剂购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 免疫组化检测Foxp3与CD8的表达情况标本经10%福尔马林固定,常规石蜡包埋,4 μm厚连续切片,En Vi⁃sion法免疫组织化学染色。石蜡切片常规脱蜡水化,Foxp3和CD8采用柠檬酸盐缓冲液热抗原修复,组织切片浸于3% H2O2中室温避光孵育20 min,阻断内源性过氧化物酶活性。分别滴加Foxp3(1∶100)及CD8(1∶100)一抗50 μL,湿盒4℃孵育过夜。滴加二抗增强剂,湿盒室温孵育20 min,滴加通用型二抗,湿盒室温孵育30 min。DAB显色,苏木精复染返蓝,常规乙醇梯度脱水、二甲苯透明、中性树胶封片,光学显微镜下观察。鼠免疫球蛋白(Ig)G作阴性对照。
1.3.2 结果判定Foxp3以细胞核中出现棕黄色或棕褐色着色为阳性表达,CD8为细胞膜出现棕黄色或棕褐色着色为阳性表达。参照文献[4-5]的计数方法,每例标本在显微镜下随机读取10个400倍视野,每个视野计数100个淋巴细胞中阳性细胞数,分别取平均值为该切片Tregs数量及CD8+T细胞数量。每张切片Tregs数量>5个为阳性切片,≤5个为阴性切片;每张切片CD8+T细胞数量>10个为阳性切片,≤10个为阴性切片。
1.4 统计学方法数据采用SPSS 21.0统计软件进行统计分析,计量资料用表示,采用t检验,计数资料用例(%)表示,采用χ2检验,相关分析采用Spearman秩相关检验。无进展生存时间计算采用Kaplan-Meier法和Log-rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 Foxp3和CD8在恶性黑色素瘤中的表达情况Foxp3表达于Tregs的细胞核。恶性黑色素瘤组织中,81.0%(47/58)Foxp3蛋白表达阳性,Foxp3阳性细胞为(9.44±5.04)%。58例中Foxp3阳性细胞若>9%为高表达组(Foxp3high),≤9%为低表达组(Foxp3low)。CD8主要表达于淋巴细胞的细胞膜,呈棕黄色,本组恶性黑色素瘤组织中,93.1%(54/58)CD8膜分子表达阳性,CD8阳性细胞占(27.24± 13.19)%。58例中CD8阳性细胞>27%为高表达组(CD8high),≤27%为低表达组(CD8low),见图1。Foxp3与CD8+T细胞阳性表达无显著相关关系(rs=0.185,P=0.139)。
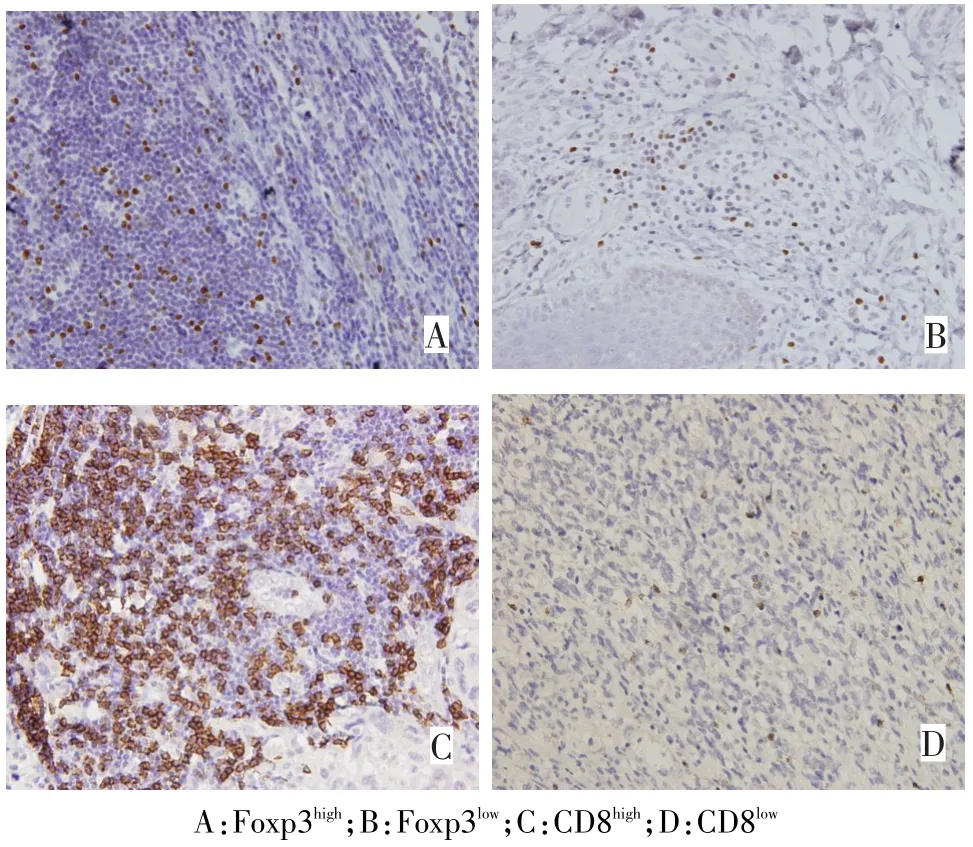
Fig.1 Immunohistochemical staining of expressions of FoxP3 and CD8图1 免疫组织化学检测Foxp3、CD8表达(SP,×400)
2.2 肿瘤微环境Tregs数量与临床病理因素的关系黏膜恶性黑色素瘤组织中Foxp3+Tregs占淋巴细胞的(11.81±5.45)%,明显高于肢端恶性黑色素瘤的(8.47±3.90)%,差异有统计学意义(t=2.648,P<0.05)。不同肿瘤发生位置、大小,以及是否有淋巴结转移和远处转移Tregs表达阳性率差异均有统计学意义(P<0.05),见表1。
2.3 肿瘤微环境CD8+T细胞数量与临床病理因素的关系黏膜恶性黑色素瘤组织中CD8+T细胞占淋巴细胞的(25.33±12.42)%,与肢端恶性黑色素瘤组织中CD8+T细胞(28.32±13.65)%比较差异无统计学意义(t=1.076,P=0.274)。存在溃疡的恶性黑色素瘤CD8+T细胞多,见表1。
2.4 Tregs、CD8+T细胞与无进展生存期(PFS)的关系本组58例患者的中位PFS为15个月,1年、2年无进展生存率分别为55.6%、39.6%。黏膜恶性黑色素瘤中位PFS为11个月,明显低于皮肤恶性黑色素瘤患者(中位PFS 25个月,χ2=5.854,P= 0.016),1年无进展生存率分别为44.0%、66.7%,见图2。Foxp3high患者和Foxp3low患者的中位PFS之间差异有统计学意义(12个月vs 31个月,χ2=5.843,P=0.046),见图3。Foxp3在黏膜恶性黑色素瘤中较在皮肤恶性黑色素瘤中高表达(P=0.035)。CD8high组患者中位PFS是25个月,明显高于CD8low组的12个月,差异有统计学意义(χ2=4.922,P= 0.024),见图4。无远处转移的恶性黑色素瘤患者PFS为18个月,高于有远处转移者的6个月(χ2= 10.481,P=0.001),见图5。

Tab.1 The correlation between Foxp3 and CD8 and clinicopathological characteristics in mucosa malignant melanoma表1 恶性黑色素瘤Foxp3、CD8与临床病理因素的关系例(%)
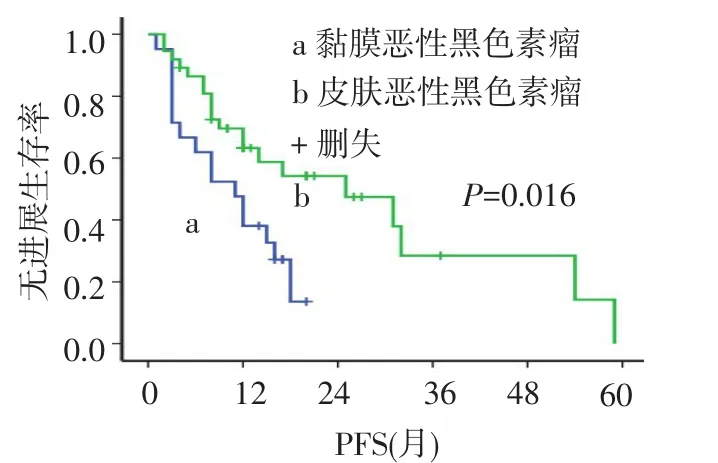
Fig.2 The PFS curves of cutaneous malignant melanoma and mucosa malignant melanoma图2 黏膜恶黑与皮肤恶黑的PFS曲线
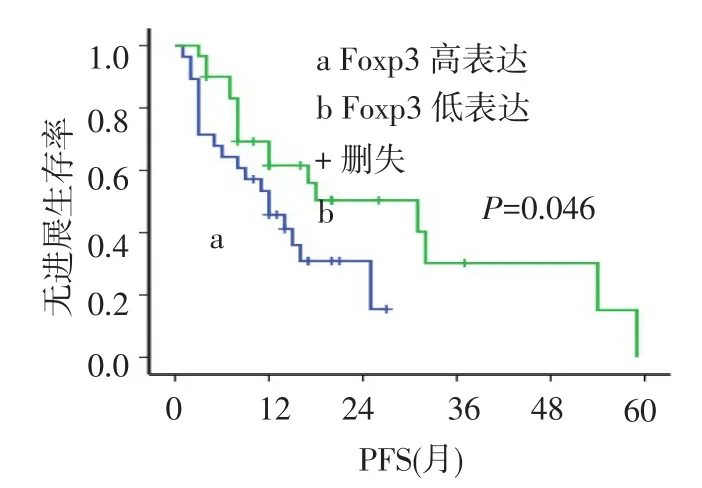
Fig.3 The PFS curves of Foxp3highand Foxp3low图3 Foxp3high与Foxp3low的PFS曲线
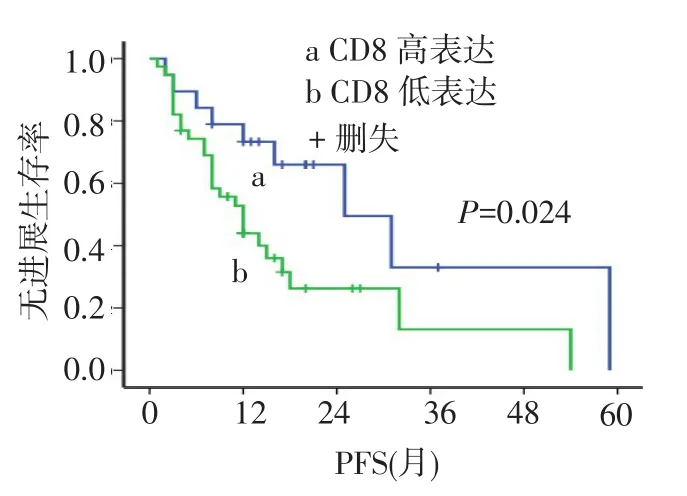
Fig.4 The PFS curves of CD8highand CD8low图4 CD8high与CD8low的PFS曲线
根据Foxp3和CD8的表达水平,进一步将患者分为4个亚组:Foxp3highCD8high(13例)、Foxp3highCD8low(15例)、Foxp3lowCD8high(6例)、Foxp3lowCD8low(24例),结果显示Foxp3highCD8low组患者中位PFS是7个月,明显低于Foxp3highCD8high组(25个月)、Foxp3lowCD8low组(18个月)及Foxp3lowCD8high组(59个月),差异有统计学意义(χ2=14.144,P=0.003),见图6。
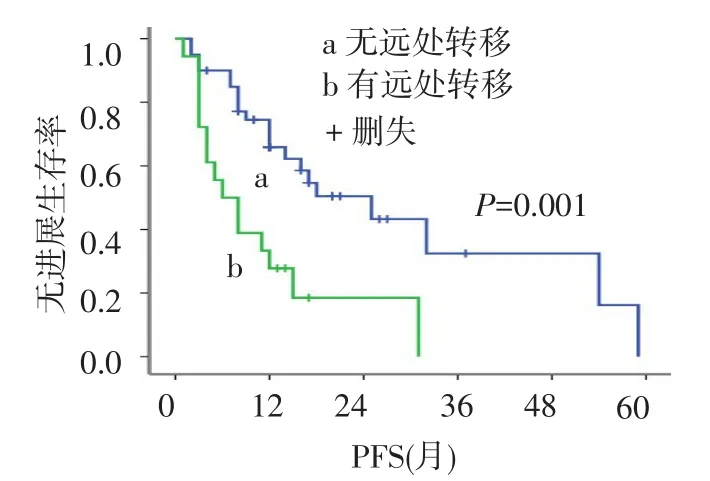
Fig.5 The PFS curves of patients with distant metastases图5 有无远处转移患者的PFS曲线
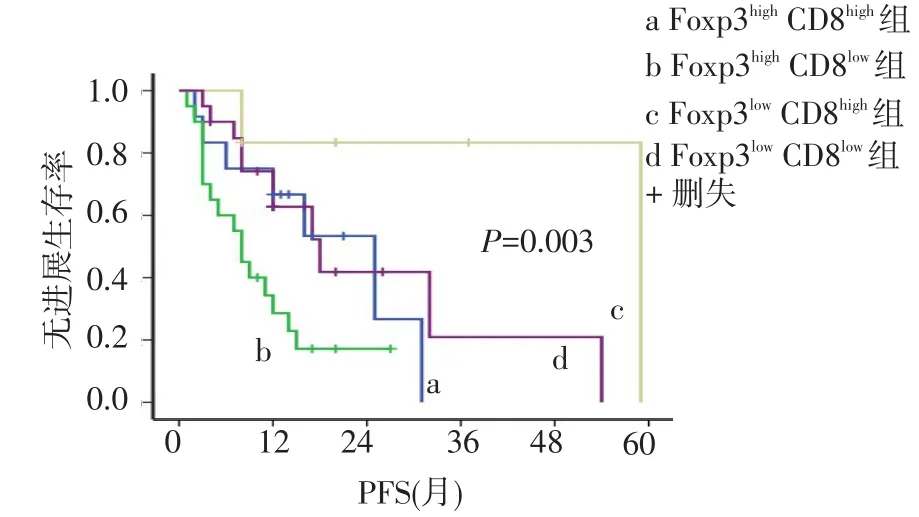
Fig.6 The PFS curves of Foxp3high,CD8high,Foxp3high,CD8low,Foxp3low,CD8high,Foxp3lowand CD8lowsubgroups图6 Foxp3highCD8high、Foxp3highCD8low、Foxp3lowCD8high、Foxp3lowCD8low亚组的PFS曲线
3 讨论
肿瘤在机体内的发生发展是免疫系统与肿瘤细胞相互作用的一个动态过程。免疫系统在这个过程中既可以清除一些肿瘤细胞,也可以促进肿瘤的生长,即所谓的“免疫编辑”。免疫编辑包括免疫清除、免疫平衡及免疫逃逸[6]。其中免疫逃逸是指肿瘤细胞通过多种机制逃避机体免疫系统识别和攻击,从而得以在体内生存和增殖的现象,是肿瘤发生的分子生物学基础[6]。
Tregs是一类非常重要的免疫调节细胞,最初由Sakaguchi等[7]于1995年首次报道,CD4+CD25+Treg细胞可以降低机体对于自身抗原以及异体抗原的免疫反应,在避免自身免疫反应方面具有重要作用。Tregs在肿瘤的免疫抑制的形成和维持过程中同样起着十分重要的作用。在结直肠癌、卵巢癌、肝癌、黑色素瘤、胰腺癌、淋巴瘤等多种肿瘤中Tregs浸润数量增多[8]。Tregs在免疫逃逸过程中发挥着重要的作用,主要是通过细胞接触依赖的抑制途径、分泌转化生长因子(TGF)-β和白细胞介素(IL)-10等抑制性细胞因子的机制实现的[9-10]。许多报道证实,在恶性黑色素瘤中Tregs细胞浸润数量与患者的预后呈负相关[11]。但是由于黏膜恶性黑色素瘤的发病率低,目前对此研究较少。
本研究采用免疫组化方法检测了21例黏膜恶性黑色素瘤和37例皮肤恶性黑色素瘤癌组织中Foxp3+Tregs的数量,黏膜恶性黑色素瘤较皮肤恶性黑色素瘤有更多的Tregs浸润。此外,Foxp3高表达组的PFS明显低于Foxp3低表达组,说明Tregs的浸润数量是影响患者预后的不良因素,与国外报道一致[11-12]。本研究提示黏膜恶性黑色素瘤较皮肤恶性黑色素瘤的PFS更短,而在黏膜恶性黑色素瘤中Tregs的数量更多,考虑Tregs局部浸润可能为黏膜恶性黑色素瘤预后差的一个重要因素。
效应性CD8+T细胞广泛浸润于结肠癌、卵巢癌、宫颈癌及恶性黑色素瘤等多种肿瘤中,直接杀伤肿瘤细胞,在恶性黑色素瘤的治疗中已显示出其有效性[13]。本研究结果显示,黏膜恶性黑色素瘤组织中CD8+T细胞数量与肢端恶性黑色素瘤组织中CD8+T细胞数量差异无统计学意义。但是,存在溃疡的恶性黑色素瘤CD8+T细胞多。本研究发现在恶性黑色素瘤中CD8+T细胞浸润数量较多者具有更长的PFS,这与文献报道的效应性CD8+T细胞与多种肿瘤的预后呈正相关的结论一致[14-15]。亚组分析显示,在CD8+T细胞浸润数量较少者的恶性黑色素瘤组织中,Foxp3low的患者中位PFS较Foxp3high明显延长。进一步分析发现,Foxp3lowCD8high亚组预后最佳,明显优于其他三组,但是由于该组病例数少,尽管差异有统计学意义,但是笔者认为该结果仍需要进一步增加病例数证实。有报道显示,Tregs可以通过抑制CD8+T细胞来促进肿瘤的发生发展,CD8+T细胞与Tregs之间呈负相关,并且CD8+T细胞/ Tregs比值与肿瘤预后较好有关[16]。但是本研究并未发现此关系,与Chaudhary等[16-17]的研究结果不一致,可能与标本的选取有关。笔者推测针对Tregs的免疫治疗在黏膜恶性黑色素瘤中具有更重要的意义,但尚需进一步实验验证。
[1]Tan B,Anaka M,Deb S,et al.FOXP3 over-expression inhibits mel⁃anoma tumorigenesis via effects on proliferation and apoptosis[J]. Oncotarget,2014,5(1):264-276.
[2]Fridman WH,Remark R,Goc J,et al.The immune microenviron⁃ment:a major player in human cancers[J].Int Arch Allergy Immu⁃nol,2014,164(1):13-26.doi:10.1159/000362332.
[3]Tjin EP,Krebbers G,Meijlink KJ,et al.Immune-escape markers in relation to clinical outcome of advanced melanoma patients follow⁃ing immunotherapy[J].Cancer Immunol Res,2014,2(6):538-546. doi:10.1158/2326-6066.
[4]Li H,Zhao H,Yu J,et al.Increased prevalence of regulatory T cells in the lung cancer microenvironment:a role of thymic stromallym⁃phopoietin[J].Cancer Immunol Immunother,2011,60(11):1587-1596.doi:10.1007/s00262-011-1059-6.
[5]Smith PA,Kohli LM,Wood KL,et al.Cytometric analysis of BAL T cells labeled with a standardized antibody cocktail correlates with immunohistochemical staining[J].Cytometry B Clin Cytom,2006,70(3):170-178.
[6]Mittal D,Gubin MM,Schreiber RD,et al.New insights into can⁃cer immunoediting and its three component phases--elimination,equilibrium and escape[J].Curr Opin Immunol,2014,27:16-25. doi:10.1016/j.coi.
[7]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-toler⁃ance maintained by activated T cells expressing IL-2 receptor al⁃pha-chains(CD25).Breakdown of a single mechanism of self-toler⁃ance causes various autoimmune diseases[J].J Immunol,1995,155(3):1151-1164.
[8]Mahalingam J,Lin CY,Chiang JM,et al.CD4+T Cells expressing la⁃tency-associated peptide and Foxp3 are an activated subgroup of regulatory T Cells enriched in patients with colorectal cancer[J]. PLoS One,2014,9(9):e108554.doi:10.1371/journal.pone.0108554.
[9]Hossain DM,Panda AK,Manna A,et a1.FoxP3 acts as a cotrans⁃cription factor with STAT3 in tumor-induced regulatory T cells[J]. Immunity,2013,39(6):1057-1069.doi:10.1016/j.immuni.
[10]He YQ,Bo Q,Yong W,et al.FoxP3 genetic variants and risk of non-small cell lung cancer in the Chinese Han population[J].Gene,2013,531:422-425.doi:10.1016/j.gene.2013.08.066.
[11]Ryan M,Crow J,Kahmke R,et al.FoxP3 and indoleamine 2,3-diox⁃ygenase immunoreactivity in sentinel nodes from melanoma patients[J].Am J Otolaryngol,2014,35(6):689-694.doi:10.1016/j.amjo⁃to.2014.08.009.
[12]Gerber AL,Münst A,Schlapbach C,et al.High expression of FOXP3 in primary melanoma is associated with tumour progression[J].Br J Dermatol,2014,170(1):103-109.doi:10.1111/bjd.12641.
[13]Restifo NP,Dudley ME,Rosenberg SA.Adoptive immunotherapy for cancer:harnessing the T cell response[J].Nat Rev Immunol,2012,12:269-281.doi:10.1038/nri3191.
[14]Hermans C,Anz D,Engel J,et al.Analysis of FoxP3+T-regulatory cells and CD8+T-cells in ovarian carcinoma:location and tumor in⁃filtration patterns are key prognostic markers[J].PLoS One,2014,9(11):e111757.doi:10.1371/journal.pone.0111757.
[15]Rathore AS,Kumar S,Konwar R,et al.CD3+,CD4+&;CD8+tu⁃mour infiltrating lymphocytes(TILs)are predictors of favourable sur⁃vival outcome in infiltrating ductal carcinoma of breast[J].Indian J Med Res,2014,140(3):361-369.
[16]Chaudhary B,Abd Al Samid M,al-Ramadi BK,et al.Phenotypic al⁃terations,clinical impact and therapeutic potential of regulatory T cells in cancer[J].Expert Opin Biol Ther,2014,14(7):931-945.doi:10.1517/14712598.2014.900539.
[17]Spranger S,Spaapen RM,Zha Y,et al.Up-regulation of PD-L1,IDO,and T(regs)in the melanoma tumor microenvironment is driv⁃en by CD8(+)T cells[J].Sci Transl Med,2013,5(200):200ra116. doi:10.1126/scitranslmed.3006504.
(2014-12-05收稿2015-03-22修回)
(本文编辑魏杰)
The expression of Tregs and CD8+T cells in malignant melanoma and its relationship with prognosis
SU Yueying,AN Xiumei,ZHAO Hua,WEI Feng,ZHANG Xinwei△
Department of Immunology,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Key Laboratory of Cancer Immunology and Biotherapy,Tianjin 300060,China△
ObjectiveTo investigate the different distribution of regulatory T cells(Tregs)and CD8+T cells in the local immune microenvironment of mucosal malignant melanoma and cutaneous malignant melanoma,and analyze the relationship between the two indicators and the prognosis of patients.MethodsImmunohistochemistry staining was used to assess the ex⁃pression of Foxp3+Tregs and CD8+T cells in tumor microenvironment of 58 patients with malignant melanoma.The correlation between two factors,clinicopathological characteristics,and prognosis were analyzed.ResultsThere is no correlation be⁃tween the expression of Foxp3 and CD8.The number of Foxp3+Tregs was significantly higher in mucosa malignant melanoma than that in cutaneous malignant melanoma(t=2.648,P=0.011).The proportion of Foxp3highTregs was significantly higher in pa⁃tients with tumor diameter≥3 cm,lymph node metastasis and distant metastasis than that in patients with tumor diameter<3 cm,no lymph node metastasis and no distant metastasis(P<0.05).In addition,in patients with ulceration that proportion was significantly higher in CD8highgroup than that in patients without ulceration(33.3%vs 5.9%,P<0.05).The median progres⁃sion-free surial(PFS)was 12 months in Foxp3highgroup,which was significantly longer than that of Foxp3lowgroup(31 months,P<0.05).The median PFS was significantly higher in CD8highgroup(25 months)than that of CD8lowgroup(12 months,P<0.05).Subgroup analysis showed that the median PFS was 7 months in Foxp3highCD8lowgroup,which was significantly lower than that of Foxp3highCD8highgroup(25 months)and Foxp3lowCD8lowgroup(18 months,P=0.003).Univariate analysis showed that median PFS was different in patients with different tumor location,different number of Foxp3+Treg,different number of CD8+T cells,and distant metastases.ConclusionThe number of Tregs is closely associated with metastasis in patients with malig⁃nant melanoma.Compared with cutaneous malignant melanoma,our results indicate that the poor prognosis of mucosal malig⁃nant melanoma may be associated with the infiltration of more Tregs.
melanoma;T-lymphocytes;CD8-positive T-lymphocytes;tumor escape;prognosis
R739.5
A
10.11958/j.issn.0253-9896.2015.09.019
973子课题基于纳米技术的肺癌早期检测研究资助项目(2012CB9333004);国家自然科学基金资助项目(81171983);天津市科委应用基础面上项目资助项目(12JCYBJC16100)
天津医科大学肿瘤医院免疫室、国家肿瘤临床医学研究中心、天津市肿瘤免疫与生物治疗重点实验室(邮编300060)
苏月颖(1988),女,硕士在读,主要从事恶性黑色素瘤免疫微环境的研究
△通讯作者E-mail:zhangxinwei@tjmuch.com
