不同磷水平下铜绿微囊藻对砷酸盐的吸收和净化
2015-11-18王振红罗专溪车霏霏严雅萌颜昌宙
王振红,罗专溪,车霏霏,严雅萌,颜昌宙*
(1.中国科学院城市环境研究所城市环境与健康重点实验室,福建 厦门 361021;2.闽南师范大学化学与环境学院,福建 漳州 363000)
不同磷水平下铜绿微囊藻对砷酸盐的吸收和净化
王振红1,2,罗专溪1,车霏霏1,严雅萌1,颜昌宙1*
(1.中国科学院城市环境研究所城市环境与健康重点实验室,福建 厦门 361021;2.闽南师范大学化学与环境学院,福建 漳州 363000)
通过室内培养实验,研究了富磷(+P)和缺磷(-P)环境下,铜绿微囊藻对砷酸盐(As(Ⅴ))的累积和净化动力学特征,探讨了净化过程中培养介质砷形态的变化.结果表明:缺磷环境下虽然可显著提升铜绿微囊藻对砷酸盐的吸收,但该环境下的高砷藻体又具较高的砷释放风险.+P和-P环境下,藻体中分别有41.5%和46.3%的胞内砷可在快速清除阶段(2h)被迅速排出.+P环境下经10μmol/L As(Ⅴ)暴露后的含砷藻体,经13d净化培养后,+P培养介质中藻体以砷酸盐释放为主,-P培养介质中则存在砷的还原和甲基化现象,这表明不同磷水平下藻体对砷的净化机理可能存在明显差异.
铜绿微囊藻;砷酸盐(As(Ⅴ));吸收动力学;净化;磷
砷作为一种有毒、非必需的类金属元素,被列为优先控制污染物[1].在天然淡水中,砷的浓度范围大致在0.5~5000µg/L;相关污染源附近,砷含量甚至高达20mg/L[2].砷在淡水环境中主要以砷酸盐(As(V))形态存在[3-4].磷是湖泊富营养化主要原因之一,由于其与砷具有相似的生物化学性质,而在砷对植物体的毒性方面起着重要作用[5-6].浮游藻类对As(V)的吸收可通过磷酸盐转运蛋白进入细胞,进而阻碍藻体的磷酸化反应[7].一般认为,在缺磷环境下,As(V)通过干扰生物体的代谢过程而致毒[8].研究表明,外部磷浓度的增高可减少细胞对As(V)的吸收,从而降低砷的细胞毒性[9-11].Hellweger等[12]提出在磷为限制因子时,藻类对As(V)的吸收与磷的吸收率有关.目前,关于不同磷水平下真核浮游藻类对As(V)的生物累积动力学和效应的研究已有相关报道[9].然而,较少涉及原核藻类对As(V)的累积,尤其是含砷藻体砷净化动力学的研究.铜绿微囊藻作为世界范围内普遍存在的蓝藻水华优势藻种之一,其原核细胞的结构使它对不良环境能产生较强适应性,易引发有害藻类水华[13-14].同时其对As(V)具有较高耐受性和较强的生物富集能力[15].因此,本文以铜绿微囊藻为研究对象,探讨不同磷水平下其对As(V)的吸收与净化特征,为深入理解富营养化水体中砷的生物地球化学及其环境风险提供科学依据.
1 材料与方法
1.1 铜绿微囊藻的来源和培养
铜绿微囊藻(M. aeruginosa)FACHB-905 购自中国科学院水生生物研究所国家淡水藻种库.藻种置于培养箱中,培养条件如下:温度为25℃,光暗比为 16h:8h、光照强度为115µmol/(m2·s),每天震摇 3 次.不同磷水平的藻种培养分别采用富磷(+P, P浓度为5.3mg/L)和未添加磷(−P, P浓度<0.01mg/L)的BG11培养基进行,并于4℃保存备用(所用试剂均为分析纯).所有工作在超净工作台进行.
1.2 铜绿微囊藻对As(V)的吸收
取对数生长期的铜绿微囊藻细胞(藻密度为1×106cells/mL)在不同磷(±P)水平下,分别暴露于10µmol/L As(V)溶液中24h,于暴露后的第1,3,5,8,12,24h(均不含离心时间)进行取样,观察铜绿微囊藻对As(V)的吸收.6000r/min离心收集藻体,并经灭菌超纯水清洗后于冰磷酸盐缓冲液(1mmol/L K2HPO4、5mmol/LMES(2-吗啉乙磺酸)及0.5mmol/L Ca(NO3)2)中浸泡10min,以彻底清除体外残留的砷,收集的藻体经真空冷冻干燥后以测定胞内砷的累积.
1.3 含砷铜绿微囊藻对砷的净化
取±P条件下,经10µmol/L As(V)暴露24h的铜绿微囊藻,进行含砷藻体砷的净化实验. 6000r/min离心收集藻体,经超纯水和冰磷酸盐缓冲液分别清洗后,使其再悬浮于相应磷水平不含砷的培养介质中.净化过程中培养介质除无As(V)添加外,与吸收实验相同.为确定单向、不同周转相间的释放速率[16],藻体砷的净化被设定为短期(0~2h)和长期(2~24h)2个阶段进行分析.在每个取样时间点,取10或20mL溶液测定其总砷含量及藻体胞内残留砷的百分比.
为进一步观察含砷藻体净化过程中砷的形态变化,取经10µmol/L As(V)在+P环境下暴露24h后的藻体,经超纯水和冰磷酸盐缓冲液分别清洗后,将其分别再悬浮于+P和−P的不含砷介质中(培养液体积为200mL,藻细胞密度约为4× 106cells/mL),持续培养13d,分别在第1,3,5,7,9,11,13d进行取样,观察介质中砷形态的变化.上述各实验分别设3个平行处理.
1.4 测定方法
1.4.1 总砷的测定 铜绿微囊藻胞内总砷含量需测定样品参照Yin等[17]中的方法进行准备和分析.用CEM微波消解炉(CEM Microwave Technology Ltd)进行消解,用ICP-MS(Agilent 7500a)在氦气模式下通过排除可能的40Ar35Cl干扰后进行砷的测定.质量控制,选取1.0,10.0 μg/L的砷标样,每10个样品进行一次回测,使回收率在可接受范围内(90%~110%)进行样品的分析测试.通过能代表浮游植物组织的标准物质紫菜(GBW08521,国家标准物质研究中心)中总砷含量的测定作为消煮过程和测定分析的质量控制. 1.4.2 砷形态的测定 含砷藻液经0.45μm一次性醋酸纤维素注射器式过滤器过滤,上清液避光于-20℃冰箱保存,并尽快完成测定.砷形态参照Zhu等[18-19]的分析方法,采用高效液相色谱—等离子体质谱联用仪(HPLC-ICP-MS)(Agilent LC1100系列和Agilent 7500a)进行测定.分离柱选用Hamilton公司的PRP(苯乙烯-二乙烯基苯共聚物)-X100(250mm×4.1mm)型阴离子交换柱,并配有相同填料的保护柱(11.2mm,12~20μm).各形态砷(亚砷酸盐As(III)、As(V)、二甲基砷酸(DMA)和一甲基砷酸(MMA))用含10mmol/L磷酸氢二铵[(NH4)2HPO4]和10mmol/L硝酸铵(NH4NO3),且pH用优级纯硝酸和氨水调节至6.2的流动相进行分离.流动相以1.0mL/min洗脱运行.
实验中As (V)、As(III)、MMA和DMA的标准储备液分别用Na3AsO4·12H2O (Fluka)、NaAsO2(Alfa Aesar)、NaCH4AsO3(Fluka)和NaC2H6AsO2(Sigma)配制.
1.5 生物累积和净化动力学模型
根据一级动力学方程,选用非线性单室模型来描述藻体对砷的同步吸收和释放:

式中:k1(L/(g·h))和k-1(h-1)分别为藻体砷生物累积过程中的吸收和释放速率常数;Asin(μg/g干重)为藻体胞内砷浓度;Asout(μg/L)为介质中砷浓度,假设为恒量;t (h)指As(V)的暴露时间,该方程在k-1> 0且起始点位t=0的限定下进行求解.用GraphPad Prism 6.0软件对模型进行分析处理.基于动力学数据,砷的生物富集系数(BCF, L/g)可通过公式BCF = k1/k-1计算[20].模型参数的误差可根据:((stdx)/x) = (Σ((stda)/a)2)1/2计算,其中x是由参数a和它的标准偏差(stda)计算出的参数值,stdx是x的标准偏差.
铜绿微囊藻砷的净化速率常数和生物半衰期使用简单一相和二相模型进行评价.把砷的单一释出相划分为短期“快速”释放和长期“慢速”释放两个阶段[20-21].为简化砷的两相生物动力学处理过程,假定所有交换遵循一级动力学过程且各相独立运作.快速和慢速释放阶段砷的释放速率常数分别用ke和ke′表示.胞内砷残留量和总砷用公式(2)模拟:

式中:C0和Ct分别指初始和时间t时刻时胞内砷的浓度;ke为释放速率常数;t为净化时间.铜绿微囊藻砷的生物半衰期(t1/2)用公式(3)计算:

2 结果与讨论
2.1 铜绿微囊藻对As(Ⅴ)的累积动力学
不同磷水平下(±P)铜绿微囊藻对As(Ⅴ)的累积随时间的增加而升高(图1).-P环境下铜绿微囊藻对As(Ⅴ)的累积显著高于+P环境.用胞内砷含量Asin作为时间的函数所预测的藻体对As(Ⅴ)累积动力学参数如表1所示.由R²可以看出,胞内砷的累积可用吸收和释放模型进行较好的解释.由模型所得到的±P环境下藻体对As(Ⅴ)的释放速率常数(k-1)显著低于吸收速率常数(k1),且+P环境下藻体砷的释放速率常数(k-1)是-P环境下的11.4倍,而吸收速率仅为-P环境下的71%.由此导致-P环境下铜绿微囊藻的BCF高出+P环境约15倍,说明-P能够显著提高铜绿微囊藻对As(Ⅴ)的累积,究其原因是磷与砷的竞争使得+P抑制了藻体As(Ⅴ)的吸收[9].
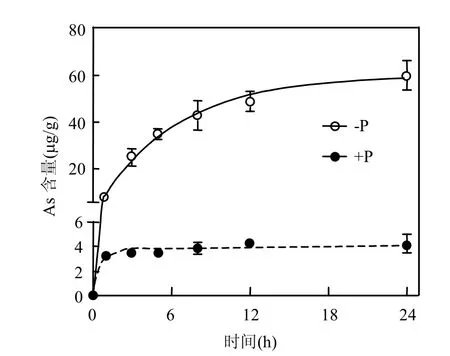
图1 在富磷和缺磷环境下藻体胞内砷含量随时间变化及线性拟合Fig.1 Changes in intracellular arsenic concentration under ±P conditions and their linear fitting
铜绿微囊藻在±P环境下较为接近的k1与差异明显的k-1同莱茵衣藻(Chlamydomonas reinhardtii)在相同条件下经10μmol/L As(Ⅴ)长期暴露(6d)的实验结果相一致(其在+P和-P环境下的k1分别为0.40,0.34L/(g·h),k-1分别为0.10,0.02h-1),而与斜生栅藻(Scenedesmus obliquus)却表现出明显的不同(其在+P和-P环境下的k1分别为0.05,0.48L/(g·h),k-1分别为-0.01,0.05h-1)[9],说明浮游藻类对As(Ⅴ)的生物累积随物种的不同而有明显差异.由k1和k-1所得出的BCF可以看出,+P环境下铜绿微囊藻对As(Ⅴ)的累积与莱茵衣藻基本相同(分别为3.82,4.00L/g),但在-P环境下却显著高于莱茵衣藻和斜生栅藻(三者BCF分别为60.02,17.00,9.60L/g).铜绿微囊藻在-P环境下对As(Ⅴ)的高富集能力可能与其对缺磷环境的较高耐受性有关[12].

表1 ±P环境下铜绿微囊藻对As(Ⅴ)的累积动力学参数Table 1 Accumulation kinetics parameters of As(Ⅴ) in M. aeruginosa under ±P conditions
2.2 含砷铜绿微囊藻中砷的净化
+P和-P环境下预暴露于10μmol/L As(Ⅴ)24h后的含砷铜绿微囊藻,其体内砷的含量分别为:(4.29±1.08),(60.37±11.39)μg/g.如图2所示,净化期间藻体胞内砷含量显著降低.快速释放阶段(2h),+P 和-P环境下藻体分别净化释放出41.5%和46.3%的胞内砷.经24h的长期净化后,在+P 和-P环境下藻体慢速清除阶段中的砷含量分别为初始值的31.0%和22.2%.用公式2获得的模型曲线(图2)显示其可以很好地解释铜绿微囊藻砷的净化过程.

图2 ±P环境下含砷藻体短期和长期净化过程中胞内砷变化Fig.2 Fraction of arsenic retained in M. aeruginosaunder ±P conditions for short- and long-term depuration
如表2所示,由于初始胞内砷含量有明显差异,该藻对砷的净化速率常数在-P环境下均比+P环境时高.-P环境下ke约为+P环境的2.65倍.但对24h的慢速清除阶段而言,+P和-P环境下ke′分别为(0.18±0.13),(0.22±0.09)h-1,二者较为接近,表明磷对藻体砷的快速清除(短期)影响较大,而对藻体砷的慢速清除(长期)影响较小.同时,初始砷含量高的藻体,其对砷的快速清除也相对更快.与±P环境下经10μmolAs(Ⅴ)暴露6d后的斜生栅藻和莱茵衣藻的8h净化过程相比[9],铜绿微囊藻24h慢速清除阶段砷的净化速率常数均比莱茵衣藻(其在+P和-P环境下的ke′分别为0.10,0.12h-1)和斜生栅藻(其在+P和-P环境下的ke′分别为0.07,0.11h-1)要高.但±P环境对铜绿微囊藻慢速清除阶段砷的净化速率常数的影响均较小,显示出不同磷环境对浮游藻类砷长期净化影响较小的相同特征.由砷在藻体内的生物半衰期(t1/2)可以看出,在+P环境下藻体内的砷较-P环境而言相对更难清除,这与不同磷水平对斜生栅藻和莱茵衣藻中砷的生物半衰期影响一致,一方面可能是由于胞内砷含量的差异性所致,另一方面说明水体中的磷能够阻碍藻体内低浓度砷的清除.因而,-P环境下砷含量高的藻体具有较高的砷释放风险.
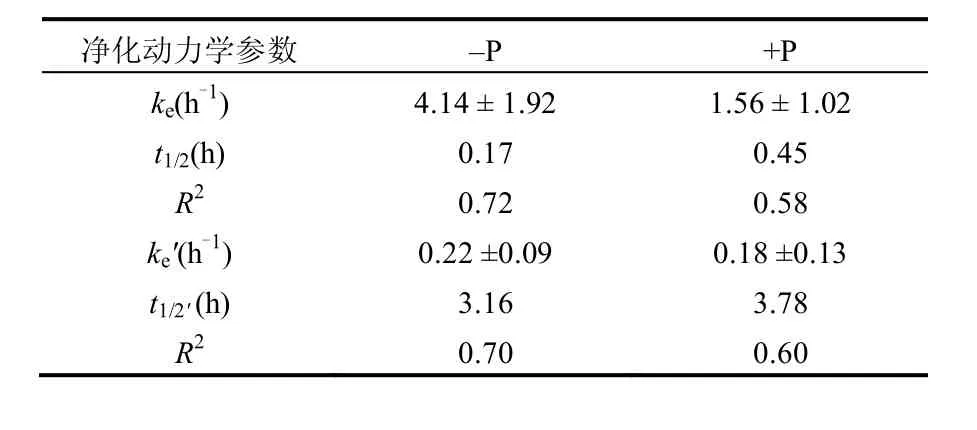
表2 含砷铜绿微囊藻在±P环境下砷的净化速率常数Table 2 Efflux rate constants for short- and long-term arsenic depuration in M. aeruginosa under ±P conditions
2.3 净化过程培养介质中的砷形态变化
+P环境下经10μmol/L As(Ⅴ)预暴露24h后的含砷藻体,于±P环境下长期(13d)净化培养过程中,在+P培养介质中观察到仅有As(Ⅴ)释出,其浓度为1.12~2.03μg/L;而在-P培养介质中除As(Ⅴ)外,还有As(Ⅲ)和DMA的释出(图3).由图3可见,含砷量相同的藻体(总砷含量为7.5~10.6μg/g干重)在+P介质中比在-P介质中释放较多的砷,说明+P环境利于藻体对砷、磷的识别,从而使得藻体在优先吸收利用磷的同时可将体内砷释出胞外.这与前人的一些研究结果(某些硅藻如海链藻、角毛藻和中肋骨条藻等似乎能识别磷酸盐和As(V))类似[22].此外,Elias等[23]也曾指出,环境中较高的磷/砷比可提高藻体对As(V)和磷酸盐的识别.环境中高浓度的磷能通过磷酸盐运输系统或竞争性结合As(V)还原酶的活性点位而抑制甚至完全阻止细胞对As(V)的吸收和还原[24].由此可见, +P环境可促进As(V)的释放.

图3 13d净化期内含砷藻体向±P介质中释放的各形态砷含量Fig.3 Concentrations of different arsenic species in±P media during 13days depuration period
在净化的第1d和第3d,-P介质中可分别检测到As(Ⅲ)和DMA的存在.在13d的净化期内培养介质中As(Ⅲ)含量增加未超出总砷量的14%;而DMA的含量相对稳定,为总砷含量的(49±5)%.此前已有研究发现,铜绿微囊藻具有将无机砷甲基化并迅速排除体外的能力[9,25],由此推测培养介质中的As(Ⅲ)和DMA可能均由藻体产生并释出.但其具体转化机制还需要进一步结合藻体内砷的形态转化进行深入探讨.
不同磷环境对含砷铜绿微囊藻的砷释放的影响与Guo等[25]的研究结果(水环境中磷的含量较砷更能显著影响介质中砷的形态)相一致.总之,-P能提升藻体砷的甲基化能力,而+P在上调藻体磷运输系统过量摄取磷的同时可促进体内砷的排出.因而,含砷水体中磷水平的差异显著影响着铜绿微囊藻对砷的吸收与净化.含砷水体铜绿微囊藻水华暴发及其相关处置所可能导致的生态环境风险应受到更多地关注.
3 结论
3.1 -P环境下,铜绿微囊藻对As(Ⅴ)较高的吸收速率结合较低的释出速率,使其生物累积显著高于+P环境,但-P诱导的高砷藻体,在相同磷环境下砷的释放风险也高.
3.2 不同磷环境下含砷藻体中的砷可在快速清除阶段以近似的比例被迅速排出,但在慢速清除阶段其对藻体砷的净化率常数影响较小.
3.3 含砷量相同的铜绿微囊藻,在不同磷水平下净化时,其机制不同.+P环境下藻体以胞内As(Ⅴ)释出为主;-P则促进了藻体砷的形态转化,As(Ⅴ)和DMA成为释出砷的主要形态.
[1]许效天,霍 林,左叶颖,等.铝改性粉煤灰漂珠吸附水溶液中砷的性能研究 [J]. 中国环境科学, 2011,31(8):1300-1305.
[2]Smedley P L, Kinniburgh D G. A review of the source, behaviour and distribution of arsenic in natural waters [J]. Appl. Geochem.,2002,17(5):517-568.
[3]张 楠,韦朝阳,杨林生.淡水湖泊生态系统中砷的赋存与转化行为研究进展 [J]. 生态学报, 2013,33(2):337-347.
[4]Rahman M A,Hassler C. Is arsenic biotransformation a detoxification mechanism for microorganisms? [J]. Aquat. Toxicol., 2014,146:212-219.
[5]卢 聪,李青青,罗启仕,等.场地土壤中有效态砷的稳定化处理及机理研究 [J]. 中国环境科学, 2013,33(2):298-304.
[6]Karadjova I B, Slaveykova VI, Tsalev D L. The biouptake and toxicity of arsenic species on the green microalga Chlorella salina in seawater [J]. Aquat. Toxicol., 2008,87:264-271.
[7]Hellweger F., Lall U. Modeling the effect of algal dynamics on arsenic speciation in lake Biwa [J]. Environ. Sci. Technol., 2004,38(24):6716-6723.
[8]Wurl O, Zimmer L, Cutter G A. Arsenic and phosphorus biogeochemistry in the ocean: Arsenic species as proxies for P-limitation [J]. Limnol. Oceanogr., 2013,58(2):729-740.
[9]Wang N X, Li Y, Deng X H, et al. Toxicity and bioaccumulation kinetics of arsenate in two freshwater green algae under different phosphate regimes [J].Water Res., 2013,47(7):2497-2506.
[10]Pigna M, Cozzolino V, Caporale A G, et al. Effects of phosphorus fertilization on arsenic uptake by wheat grown in polluted soils[J]. J. Soil Sci. Plant Nut., 2010,10(4):428-442.
[11]Wang L H, Duan G L. Effect of external and internal phosphate status on arsenic toxicity and accumulation in rice seedlings [J]. J. Environ. Sci.-China, 2009,21(3):346-351.
[12]Hellweger F, Farley K J, Lall U, et al. Greedy algae reduce arsenate [J]. Limnol. Oceanogr., 2003,48(6):2275-2288.
[13]Silva E I L.Emergence of a Microcystis bloom in an urban water body, Kandy lake, Sri Lanka [J]. Curr. Sci. India, 2003,85(6):723-725.
[14]龚 艳,吴幸强,肖邦定,等.铜绿微囊藻在不同供磷水平下对砷胁迫的响应 [J]. 水生生物学报, 2009,33(5):890-895.
[15]Wang Z H, Luo Z X, Yan C Z. Accumulation, transformation, and release of inorganic arsenic by the freshwater cyanobacterium Microcystis aeruginosa [J].Environ. Sci. Pollut. Res. Int., 2013,20(10):7286-7295.
[16]王文雄.微量金属生态毒理学和生物地球化学 [M]. 北京:科学出版社, 2011:147-155.
[17]Yin X X, Wang L H, Bai R,et al. Accumulation and transformation of arsenic in the blue-green algaSynechocysis sp. PCC6803 [J]. Water Air Soil Poll., 2011,223(3):1183-1190.
[18]Zhu YG, Sun GX, Lei M, et al. High percentage inorganic arsenic content of mining impacted and nonimpacted Chinese rice [J]. Environ. Sci. Technol., 2008,42(13):5008-5013.
[19]Zhang X, Uroic MK, Xie WY, et al. Phytochelatins play a key role in arsenic accumulation and tolerance in the aquatic macrophyte Wolffia globosa [J]. Environ. Pollut., 2012,165:18-24.
[20]Bradac P, Navarro E, Odzak N, et al. Kinetics of cadmium accumulation in periphyton under freshwater conditions [J]. Environ. Toxicol. Chem., 2009,28(10):2108-2116.
[21]Khan F R, Misra S K, Garcia-Alonso J, et al. Bioaccumulation dynamics and modeling in an estuarine invertebrate following aqueous exposure to nanosized and dissolved silver [J]. Environ. Sci. Technol., 2012,46(14):7621-7628.
[22]Morris RJ, Mccartney MJ, Howard AG, et al. The ability of a field population of diatoms to discriminate between phosphate and arsenate [J]. Mar. Chem., 1984,14(3):259-265.
[23]Elias M, Wellner A, Goldin-Azulay K, et al. The molecular basis of phosphate discrimination in arsenate-rich environments [J]. Nature, 2012,491(7422):134-137.
[24]Slaughter DC, Macur RE, Inskeep WP. Inhibition of microbial arsenate reduction by phosphate [J]. Microbiol. Res., 2012,167(3):151-156.
[25]Guo P, Gong Y, Wang C, et al. Arsenic speciation and effect of arsenate inhibition in a Microcystis aeruginosa culture medium under different phosphate regimes [J]. Environ. Toxicol. Chem.,2011,30(8):1754-1759.
Uptake and depuration kinetics of arsenatein Microcystis aeruginosaunder different phosphate regimes.
WANG Zhen-hong1,2, LUO Zhuan-xi1, CHE Fei-fei1, YAN Ya-meng1, YAN Chang-zhou1*(1.Key Laboratory of Urban Environment and Health, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China;2.College of Chemistry and Environment, Minnan Normal University, Zhangzhou 363000, China).
China Environmental Science, 2015,35(2):533~538
The uptake and depuration kinetics of arsenate inMicrocystis aeruginosa (M. aeruginosa) were investigatedunder phosphate-enriched (+P) and depleted (-P) culture conditions. Similarly, M. aeruginosa, pre-exposed to 10µmol/L arsenate for 24 hours under +P conditions, were used to examine arsenic efflux and species changes in culture media during 13 days depurations under +P and-P conditions. Results showed that P-depletion was found to significantly improve the accumulation of arsenate in Microcystis aeruginosa, in which the algae with high accumulated amounts of arsenic had high risks due to arsenic rapid efflux. Additionally, ca. 41.5% and 46.3%intracellular arseniccould be rapidly excreted in rapidclearance phase (2h) under +P and -P conditions, respectively. During the depuration period, arsenate efflux was the crucial process from algae cells in +P media, but arsenate reduction and methylation were observed in -Pmedia. This indicates significant differences inM. aeruginosa depuration mechanism under different phosphorus conditions.
Microcystis aeruginosa;arsenate (As(Ⅴ));uptake kinetics;depuration;phosphorus
X703.1
A
1000-6923(2015)02-0533-06
王振红(1979-),女,河北平山县人,副教授,博士,主要从事水环境微污染控制研究.发表论文20余篇.
2014-05-20
国家自然科学基金资助项目(21277136,41401552);福建省教育厅A类科技项目(JA12214)
* 责任作者, 研究员, czyan@iue.ac.cn.
