氟康唑滴眼凝胶的制备与质量控制
2015-11-18满玉清魏传梅刘明华左小信胡丽敏
满玉清,魏传梅,刘明华,左小信,胡丽敏
(1.滨州医学院附属医院,山东 滨州 256603;2.滨州市人民医院,山东 滨州 256603)
氟康唑滴眼凝胶的制备与质量控制
满玉清1,魏传梅1,刘明华1,左小信2,胡丽敏1
(1.滨州医学院附属医院,山东滨州256603;2.滨州市人民医院,山东滨州256603)
目的制备氟康唑滴眼凝胶并建立质量控制方法。方法采用正交设计对基质处方进行优化;用高效液相色谱法测定氟康唑的含量,并进行制剂刺激性及稳定性考察。结果氟康唑眼凝胶最佳基质处方为(质量体积比):卡波姆-940 0.3%,硼砂0.4%,甘油2%;氟康唑进样量在1.0~8.0 μg的范围内线性关系良好(r= 0.999 8),加样回收率为99.43%(RSD=0.75%);制剂无刺激性,稳定性好。结论氟康唑滴眼凝胶处方合理,质量可控。
正交试验;氟康唑;卡波姆;硼砂;滴眼凝胶;质量控制
真菌性角膜溃疡是由真菌感染引起的一种顽固的致盲率很高的角膜炎[1]。治疗必须选择对真菌敏感的药物,由于真菌常侵入角膜组织内,需要药物与溃疡面保持持续的接触,使药物在角膜内达到足够浓度[2],抗真菌滴眼液滴眼后易被泪液稀释,并很快从泪道排出,约70%的药液从眼部溢出,若眨眼,损失可达90%[3]。眼膏剂虽能使药物与角膜的接触时间延长,但用药剂量难以控制。疗效高、副作用少,作用时间长的药物是治疗角膜病药物的发展方向[4]。为提高局部的药物浓度,延长药物的作用时间,增加临床疗效,本文以氟康唑为主药制成滴眼凝胶,采用高效液相色谱法测定氟康唑的含量,对其刺激性及稳定性进行考察,报道如下。
1 仪器和试药
1.1仪器与材料pH5-3C酸度计(萧山市分析仪器厂);NDJ-79旋转式黏度计(上海平轩科学仪器厂);FA1004N精密电子天平(上海精密科学仪器有限公司);UV-100型紫外分光光度计(日本岛津);LC-20AT高效液相色谱仪,Prominence SPD-20A/UV-VIS检测器;实验动物:新西兰兔(山东绿叶制药有限公司),动物合格证号:SCXK(鲁)20090011。
1.2试药氟康唑对照品(中国食品药品检定研究院,批号:100314-201204);氟康唑(杭州民生药业集团有限公司,批号:20121126);卡波姆-940(南京威尔化工有限公司,批号:20130102);硼砂(湖南尔康制药有限公司,批号:20121009);甘油(湖南尔康制药有限公司,批号:20121009);羟苯乙酯(广州台山新宁制药厂,批号:20130306);红霉素眼膏(山东鲁抗辰欣药业有限公司,批号:20120402)。
2 方法与结果
2.1基质处方优化
2.1.1处方氟康唑0.5g,羟苯乙酯0.03 g,卡波姆、硼砂、甘油适量,注射用水加至100 mL。
2.1.2正交设计根据文献资料和预实验,选取卡波姆-940(A)、硼砂(B)、甘油(C)为考察因素,每个因素取3个水平,按L9(34)正交表进行设计。以对凝胶剂基质影响较大的黏度、可滴性、pH值为考察指标。试验设计见表1。

表1 正交试验因素水平
2.1.3样品的制备按表1所列的不同因素水平处方量,取卡波姆撒于适量注射用水中,静置过夜,充分膨胀[5];将氟康唑,羟苯乙酯溶于适量注射用水中,加热溶解,冷至40℃左右,经3号垂熔玻璃漏斗过滤到溶胀好的卡波姆-940中,搅匀;经3号垂熔玻璃漏斗加入10%硼砂溶液、甘油,搅匀;加注射用水至100 mL,充分搅匀,高压蒸汽灭菌,无菌分装。
2.1.4评价指标及评分标准以滴眼凝胶的pH值,黏度,可滴性为评价指标,综合评分满分为100分。其中pH 40分,黏度40分,可滴性20分。pH考察:按《中国药典》2010年版(二部)[6]pH值测定项下方法,取样品5 g,加纯化水25 mL稀释后测定,pH值6.0~7.0为40分,每增加或减少0.2减5分。黏度考察:测定温度25℃,采用 NDJ-79型旋转黏度计测量各处方样品的平均黏度(n=5),平均黏度30~35 Pa·s为40分,每增加或减少5 Pa·s 减5分。可滴性考察:测定温度25℃,用自制带塞孔(内径1.5mm)的50 mL塑料瓶装入样品进行可滴性试验,观察滴出的难易程度,样品由3位有10年以上工作经验的制剂人员评分,取平均值,不加压力自行流出为0分;不加压力很易滴下为10分;稍加压力才能滴下为20分;加大力度后才能滴下为10分;加大力度后也难以滴下为0分。
2.1.5结果与分析对凝胶的pH、黏度、可滴性分别评分并计算综合评分(单项评分之和)数据采用SPSS 17.0进行方差分析,结果见表2、3。
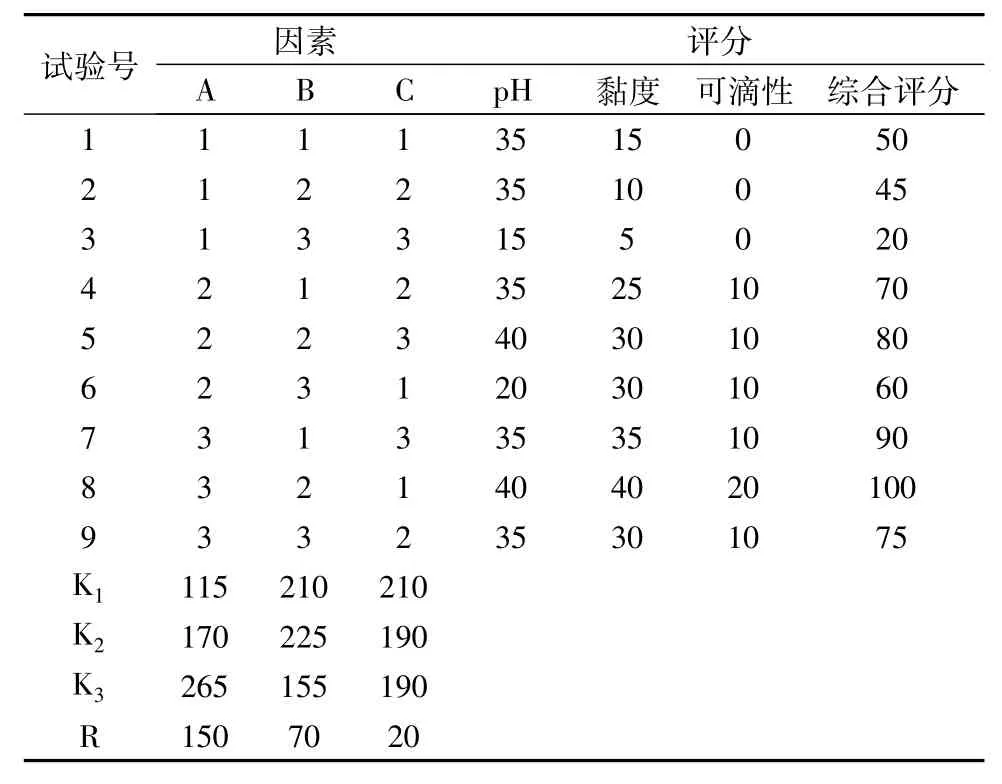
表2 正交试验及结果
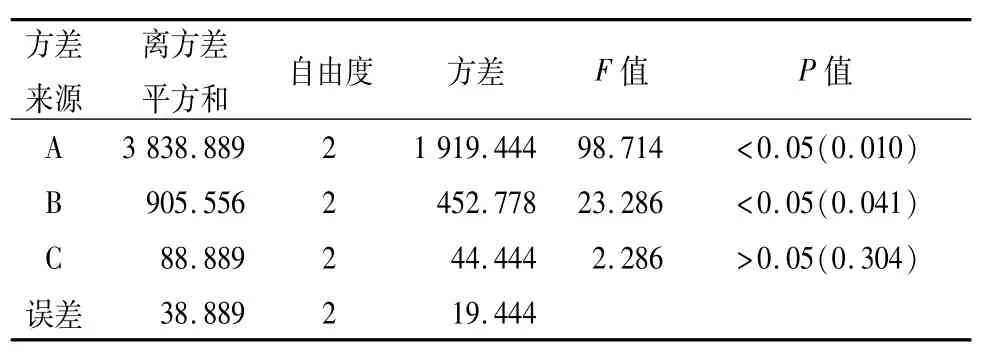
表3 方差分析表
由表2可知,最佳基质处方为A3B2C1,卡波姆-940 0.3g,硼砂0.4g,甘油2 g。最优处方为处方8。由表3结果可知,因素A对基质处方影响最显著,因素 B次之,因素 C再次之。
2.2含量测定
2.2.1色谱条件色谱柱:Hypersil BDS-C18(4.6mm×200 mm,5 μm);流动相:磷酸盐缓冲液(pH 7.0)-甲醇(55∶45);流速:1.0 mL·min-1;进样量20 μL;检测波长:261 nm。
2.2.2供试品溶液的制备取本品4 g,精密称定,加入15%氯化钠溶液20 mL,边滴加边搅拌,使基质沉淀,滤过,用15 mL氯化钠溶液分3次洗涤,沉淀,滤过,合并滤液,加流动相稀释至100 mL,经 0.45 μm微孔滤膜滤过作为供试品溶液。
2.2.3阴性对照溶液的制备按处方比例和工艺制成不含氟康唑的阴性对照样品,按供试品溶液的制备方法制备阴性对照溶液。
2.2.4系统适用性试验分别取对照品溶液(0.2mg·mL-1)、供试品溶液、阴性对照溶液各20 μL注入液相色谱仪,记录色谱图。在此色谱条件下氟康唑峰与其它峰分离度良好,阴性对照溶液在氟康唑峰的位置处无干扰,结果见图1。
2.2.5线性关系考察精密称取氟康唑对照品适量,加流动相制成1 mg·mL-1的溶液。精密量取0.5、1.0、2.0、3.0、4.0 mL分别置10 mL量瓶中,用流动相稀释至刻度,摇匀。按“2.2.1”项下色谱条件进样,以峰面积Y对进样量X绘制标准曲线,得回归方程为:Y=39 659X-5.253 0(r=0.999 8),表明氟康唑进样量在1.0~8.0 μg的范围内线性关系良好。

图1 高效液相色谱图
2.2.6精密度试验取同一供试品溶液,连续进样5次,对氟康唑峰面积进行考察,RSD=0.58%,表明精密度良好。
2.2.7重复性试验取同一批号样品5份,分别制备供试品溶液,依法测定,对氟康唑峰面积进行考察,RSD为1.09%,表明该方法重复性良好。
2.2.8稳定性试验取同一供试品溶液,分别在0、1、2、4、8、12 h分别进样,依法测定,对氟康唑峰面积进行考察,结果RSD=1.25%。表明供试品溶液在12 h内稳定。
2.2.9加样回收率试验取已知含量的样品(氟康唑约为处方量的50%)精密加入氟康唑对照品,制成含氟康唑处方比例80%、100%、120%的样品,按照“2.2.3”项制得样品供试液,进样测定峰面积,将测得峰面积代入回归方程按外标法计算样品中氟康唑的含量,测得氟康唑的回收率,结果见表4。

表4 回收率试验结果
2.2.10样品测定 按上述方法测定3批样品(20130303、20130304、20130305),氟康唑的含量分别为标示量的99.58%、100.06%、99.62%。
3 刺激性实验
取健康雌性新西兰兔24只,体重约2.0 kg,分为实验组与对照组。实验组眼内涂氟康唑眼凝胶,对照组眼内滴加无菌生理盐水,两组均为1次用药0.2g,每天3次,均连用7 d。每次用药后15、30、45、60、120 min分别记录角膜、结膜等部位变化情况。7天后应用荧光素钠检查角膜、结膜损害情况。结果实验组与对照组均未出现结膜红肿、角膜充血、分泌物等刺激反应,用药7 d未发现角膜、结膜损害情况,表明该滴眼凝胶无刺激性。
4 稳定性试验
4.1离心试验取本品10 g,置于离心管中,3 000 rpm离心30 min,结果无分层现象。
4.2耐热耐寒试验取本品3批适量,装于密闭聚乙烯眼药瓶中,置于55℃恒温箱中48 h,结果无分层变色现象;-15℃冰箱中放置24 h,恢复至室温,结果无分层变色现象。
5 讨论
5.1凝胶基质中的卡波姆是影响制剂黏度的主要因素,样品黏度随卡波姆用量的增大而增大;硼砂与卡波姆质量比是调节pH的主要因素,质量比在一定范围内与黏度成正比,但质量比大于4时黏度明显变小[7]。
5.2卡波姆为酸性物质,其1%水分散体的pH值为3.11,此时的pH值和黏度均低,当用碱中和时,随pH值的增高,黏度逐渐上升,配制制剂时先将氟康唑水溶液与卡波姆的水分散体混匀后,再缓慢的加入碱性中和剂,这样可使氟康唑更易均匀分布,且制剂成品气泡少,性状好。
5.3凝胶碱性中和剂常用氢氧化钠或三乙醇胺等强碱溶液[8],氟康唑滴眼凝胶选用硼砂做碱性中和剂,既能中和卡波姆的酸性,又发挥了其调节滴眼剂渗透压和抗菌消炎的治疗作用,还降低了刺激性。优化基质处方将制剂的粘稠度、pH、可滴性作为制剂的评定标准,能更好的反应制剂的质量与适用性。
5.4含量测定时供试品溶液的制备如果直接稀释,黏度较大,不易过滤,因此用15%NaCl使基质沉淀,过滤后得供试品溶液。
5.5皮肤和黏膜部位给药要求制剂与黏膜有良好亲和性、涂展性和黏着性[3],氟康唑滴眼凝胶能够增加氟康唑与角膜的接触时间,减少局部药物的流失,提高病变部位的氟康唑浓度,适用性及治疗效果更好。
[1]成新莲,王玉,刘秀莲,等.氟康唑眼凝胶治疗真菌性角膜溃疡的应用研究[J].滨州医学院学报,2007,30(5):393-394.
[2]李风鸣.眼科全书[M].北京:人民卫生出版社,1999:1397.
[3]崔福德.药剂学[M].第5版.北京:人民卫生出版社,2004:87.
[4]陈家祺,刘祖国.加强对角膜病的基础与临床研究[J].中华眼科杂志,2000,36(1):10-12.
[5]薄明香,成文娜,汪风芹,等.复方黄芩苷凝胶的制备及质量控制研究[J].药学研究,2014,3(2):98-99.
[6]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010.
[7]曹维,童春晖,胡一桥.利巴韦林眼凝胶的研制及质量控制[J].中国新药杂志,2006,15(10):793-796.
[8]张立波.阿昔洛韦眼用凝胶制剂的研究[D].沈阳:沈阳药科大学,2006.
Preparation and quality control of Fluconazole Ophthalmic Gel
MAN Yu-qing1,WEI Chuan-mei1,LIU Ming-hua1,ZUO Xiao-xin2,HU Li-min1
(1.The Affiliated Hospital of Binzhou Medical College,Binzhou 256603,China;
2.Binzhou People′s Hospital,Binzhou 256603,China)
Objective To prepare Fluconazole Ophthalmic Gel and establish its quality control standards.Methods the matrix formulation was optimized by orthogonal design;HPLC was used to determine the content of fluconazole,and investigate the stimulating and stability of the preparation.Results The best prescription of Fluconazole Ophthalmic Gel for quality(mass to volume ratio)were:carbomer-940 0.3%,borax 0.4%and glycerol 2%.The linear range of fluconazole was 1.0~8.0 μg(r=0.999 8),and the average recovery was 99.43%(RSD=0.75%);The prescription was stable and nonirritating.Conclusion The prescription of Fluconazole Ophthalmic Gel was reasonable,and the quality was controllable.
Orthogonal test;Fluconazole;Carbomer;Borax;Ophthalmic gel;Quality control
R927.1
A
2095-5375(2015)12-0719-004
满玉清,男,主管药师,研究方向:医院制剂与药品检验,E-mail:myq388@126.com
胡丽敏,女,研究方向:医院制剂,Tel:0543-3256752,E-mail:byfywy@163.com
