V2O5·nH2O纳米带的简单合成及其电容性能研究
2015-11-17曾同异张立宁邹慧君陈联梅
曾同异,张立宁,康 玲,邹慧君,陈联梅
(化学合成与污染控制重点实验室,西华师范大学化学化工学院,四川 南充 637009)
超级电容器是一种介于电池和电容器之间的新型储能元件. 它兼有传统电容器的高功率密度和二次电池的高能量密度,因此在混合动力汽车、电子设备、记忆装置等领域有着广泛的应用前景,是国内外研究的热点[1-3].目前,工业化最成功的电极材料是活性炭. 活性炭是通过电解质离子在材料表面的物理吸附/脱附产生的双电层电容来储存电荷,其比电容值与材料表面积相关. 碳材料的优点是功率密度高,缺点是质量比电容较低,在水系电解液中的比电容值一般低于100 F·g-1[4-7]. 为了提高超级电容器的比电容,必须发展利用赝电容储能的电极材料,如过渡金属氧化物和导电聚合物. 赝电容通过在电极的表面或近表面发生快速可逆的化学吸附/脱附或氧化还原反应储存电荷. 赝电容不仅发生在材料表面,而且可以深入到材料内部,因此在相同面积的情况下赝电容的比电容是双电层电容的10 -100 倍[1,2].目前最理想的 赝电容电极材料是无定形RuO2·nH2O[8-10],但钌资源稀少,价格高昂,难以普及利用,因此人们在积极研究其它价格低廉的替代材料,如锰氧化物[11-14],钴氧化物[15,16],镍氧化物[17,18],钒氧化物[19-23]等.
五氧化二钒具有开放式的层状结构,非常有利于离子的吸附/脱附;钒存在多种价态,它们之间有良好的反应活性,因此五氧化二钒非常适合作为储能元件的电极材料. 目前,关于V2O5用于锂离子电池正极材料方面的研究报道很多,而用于水系超级电容器方面的报道较少. Lee 等[19]首次研究了无定形V2O5·nH2O在KCl 溶液中的电容性能,当电压窗口为(-0.2 -0.8)V 时初始比电容为350 F·g-1,但比电容下降很快,100 次循环后下降了45%. Reddy 等[20]制备了多孔的晶型V2O5粉末,在2 mol·L-1KCl 溶液中电位窗口(-0.2 -0.7)V 时初始比电容为214 F·g-1,100 次循环后比电容下降较快. Chen 等[21]通过熔融淬冷法制得V2O5干凝胶,在中性电解液NaNO3溶液中电位窗口(-0.3 -0.7)V,初始比电容为216 F·g-1,600次后下降了20%. Saravanakumar 等[22]通过H2O2法合成了V2O5多孔纳米网,在K2SO4电解液中电压窗口(-0.2 -0.8)V 时初始比电容为304 F·g-1,600 循环下降了24%. Qu 等[23]通过模板法合成了含有一定量模板剂杂质和V4+的V2O5,在中性电解液中比容量衰减很快,可能是由于模板剂导致离子和电子在材料中难以扩散的原因所致. 可见,文献所报道的V2O5材料的电化学循环性能不好,有待进一步改善和提高.
本文以V2O5晶体粉末为原料,不加入任何添加剂或模板剂,采用直接水合的简单方法合成了不含杂质的V2O5·nH2O 纳米带. 这种带状结构不仅可以增大材料比表面积,提高材料的电子电导率,而且可以缩短电解质离子在材料中的扩散途径,从而改善V2O5·nH2O 的循环性能. 实验结果表明,V2O5·nH2O 纳米带在1mol·L-1KNO3电解液中的电容性能最好,且能在大电流密度下充放电,因此直接水合制备的纯V2O5·nH2O 纳米带适合做超级电容器的电极材料.
1 实验部分
1.1 样品的制备
将1.0 g V2O5加入45mL 蒸馏水中,在100℃油浴中磁力搅拌下回流加热,持续反应8h. 反应结束后,冷却至室温,过滤得到黄色沉淀. 先用蒸馏水清洗沉淀4 次,再用丙酮清洗2 次. 将所得产物在60℃下真空干燥24h,研磨后得到样品(V2O5·nH2O).
1.2 样品的表征
采用X 射线衍射仪(日本,D/max – rA 型)对产物进行晶体结构和物相分析(CuKα 射线,管压:40 kV,管流:100 mA,扫描范围:10° -70°,λ=0.15418 nm). 采用红外光谱仪(美国,Nicolet 6700,Thermo scientific 型)对样品进行FTIR 测试. 采用扫描电子显微镜(日本,JSM–6510LV 型)对产物的形貌进行分析.
1.3 电化学性能测试
1.3.1 电极制备
将活性物质V2O5·nH2O、导电剂乙炔黑、粘结剂PVDF 按质量比70∶25∶5 的比例混合,加入适量的N-甲基-2 -吡咯烷酮(NMP)调成糊状,混合均匀后在75℃下真空干燥24h,研磨得到黑色粉末. 取适量粉末压在不锈钢网集流体上,真空干燥除去剩余的NMP,制备得到V2O5·nH2O 电极.
1.3.2 电化学性能测试
V2O5·nH2O 电极为工作电极,饱和甘汞电极为参比电极,铂电极为对电极,组成三电极体系. 采用1mol·L-1KNO3作为电解液,在电化学工作站(上海辰华,CHI660E)上进行循环伏安测试.
V2O5·nH2O 电极作为工作电极,组装成模拟超级电容器,采用1mol·L-1KNO3、NaNO3和LiNO3作为电解液,在新威电池程控测试仪上进行恒流充放电测试.

图1 原料(a)和样品(b)的X 射线衍射(XRD)图Fig.1 XRD patterns of V2O5 raw material (a) and the sample(b)
2 结果与讨论
2.1 XRD 表征
图1(a)和(b)分别为原料V2O5和样品的X 射线衍射(XRD)图. 从图中可以看出,样品粉末的各个衍射峰的峰位与原料V2O5的峰位(JCPDS No. 41 -1426)一致[22],表明所制备的样品仍然是晶型的V2O5粉末. 但是,样品的(001)衍射峰更强烈,表明样品在制备过程中,沿着(001)晶面生长,因此样品具有层状结构.V2O5晶体中层与层之间是通过范德华力或氢键相连接,在水合过程中,水分子进入了晶体层中,导致层间距增大. 层间距越大,越有利于离子的进入和脱出,从而提高样品的电容性能.
2.2 IR 分析
图2 为原料V2O5和样品的红外光谱(IR)图. 从图中可以看出,样品的红外吸收峰与原料V2O5基本一致,其中1020 cm-1吸收峰对应V =O 双键的伸缩振动吸收峰,823,590,480 cm-1吸收峰对应不同强度V-O-V键的对称和反对称伸缩振动吸收峰[22]. 从图2 还可知,样品在1637 cm-1有弱的吸收峰,表明样品中含有一定量的水分. 少量水分的存在,能提高材料的电子电导率以及离子的扩散率,有利于材料展现出好的电容性能. 原料V2O5晶体不含水分,不具有电容性能;而样品含有一定量的水分,才能展现出电容性能;但是,当水分含量较多时会导致V2O5的溶解,降低材料的循环性能[21]. 这与文献报道的RuO2·nH2O 和MnO2·nH2O 比不含水分的样品具有更好电容性能是相类似的[8,12].
2.3 SEM 分析
图3 为样品V2O5·nH2O 的扫描电镜(SEM)图. 由图可知,样品是由相互缠绕的纳米带构成.文献报道V2O5·nH2O 纳米带的合成方法主要为模板法和水热法[23-25]. 本文在不加入任何添加剂或模板剂情况下,采用直接水合的简单方法合成了不含杂质的V2O5·nH2O 纳米带. 这种带状结构不仅有利于提高材料的电子电导率,还可以增大材料的比表面积,缩短电解质离子进入材料的路径,从而改善材料的电容性能.

图2 原料和样品的红外吸收光谱(IR)图Fig.2 IR spectra of V2O5 raw material and the sample

图3 V2O5·nH2O 样品的扫描电镜(SEM)图Fig.3 SEM image of V2O5·nH2O sample
2.4 电化学性能测试
2.4.1 循环伏安测试
实验测试表明,在KNO3电解液中V2O5·nH2O电极开始的比容量较低,但随着充放电次数增加,比容量逐渐增加,大约经过600 次循环后比电容趋于稳定,因此V2O5·nH2O 电极需要较长时间的活化. 图4 给出了V2O5·nH2O 电极在活化前和活化后1mol·L-1KNO3电解液中的循环伏安(CV)曲线. 由图可见,在活化前的CV 曲线包围面积较小,而活化后的CV曲线中所包围面积增大很多,表明样品在活化后电容性能得到很大程度的提高.
图5 为活化后V2O5·nH2O 电极在KNO3电解液中在不同电压窗口下的CV 曲线. 由图可见,当充电电压超过0.8V,电极就几乎没有电容性能,因此在后面的恒流充放电测试中,V2O5·nH2O 电极的工作电压窗口就设定为(-0.4 -0.8)V.
图6 为活化后V2O5·nH2O 电极在(-0.4 -0.8)V 的电压窗口下不同扫描速率的CV 曲线. 随着扫描速率从5mV·s-1增加到40mV·s-1,V2O5·nH2O 电极的CV 曲线都展现出近似对称的矩形,表明V2O5·nH2O 电极的功率性较好.

图4 V2O5·nH2O 电极在KNO3 电解液中活化前与活化后的CV 曲线Fig.4 The CV curves of the unactivated and activated V2O5·nH2O electrodes in KNO3 solution

图5 活化后V2O5·nH2O 电极在KNO3 电解液中不同电压窗口下的CV 曲线Fig.5 The CV curves of the activated V2O5·nH2O electrode at various potential ranges in KNO3 solution

图6 活化后V2O5·nH2O 电极在KNO3 电解液中不同扫描速率下的CV 曲线Fig.6 The CV curves of the activated V2O5·nH2O electrode at various scan rates in KNO3 solution.
2.4.2 恒流充放电测试
图7 和图8 分别为V2O5·nH2O 电极在1mol·L-1KNO3、NaNO3和LiNO3电解液中的充放电曲线和循环性能. 由图7(a)可见,在KNO3电解液中随着循环次数的增加,V2O5·nH2O 电极的比电容逐渐增大. 第600 次循环时,充放电曲线基本呈三角型对称,充放电效率为99% -100%. 根据公式(1),计算出第600 次循环的放电比电容为148.1F·g-1. 从图8 可以看出,V2O5·nH2O 电极在KNO3电解液中充放电超过600次循环后,电极的比电容才趋于稳定. 再充放电循环1400 次后,放电比电容仍为142.6F·g-1,比电容保持率为96.3%.

其中i 为放电电流(A);td是放电时间(s);ΔV 是放电时间Δt 时的电压降(V);m总是电容器中两个电极的活性物质质量的总和(g);Ce为单电极的比电容(F·g-1).

图7 V2O5·nH2O 电极不同电解液中的充放电曲线Fig.7 The charge/discharge curves of the V2O5·nH2O electrode in various solutions
由图7(b)和图8 可见,在NaNO3电解液中,随着循环次数的增加,比电容也是逐渐增大,但接近1500次循环比电容才趋于稳定,活化过程太长;并且比电容也比较低,最大值只有116.5F·g-1. 从图7(c)和图8 可知,在LiNO3电解液中,随着循环次数增加,比电容逐渐降低,第1000 次循环时几乎没有电容性能.
比较上面的结果,V2O5·nH2O 电极在1mol·L-1KNO3中的电容性能最好. 推测其原因,水合离子半径K+<Na+<Li+,离子半径最小的K+可以进入V2O5·nH2O 层间,因此在KNO3电解液中,材料的电容性能不仅发生在表面,还可以进入层间,展现出较大的电容性能. 水合Na+半径稍大,难以进入层间,电容性能基本只能发生在表面,比电容较小;水合Li+的半径最大,不能进入层间,所以电容性能最差. 因此,对V2O5·nH2O 纳米带而言,KNO3溶液是最适合的电解液.
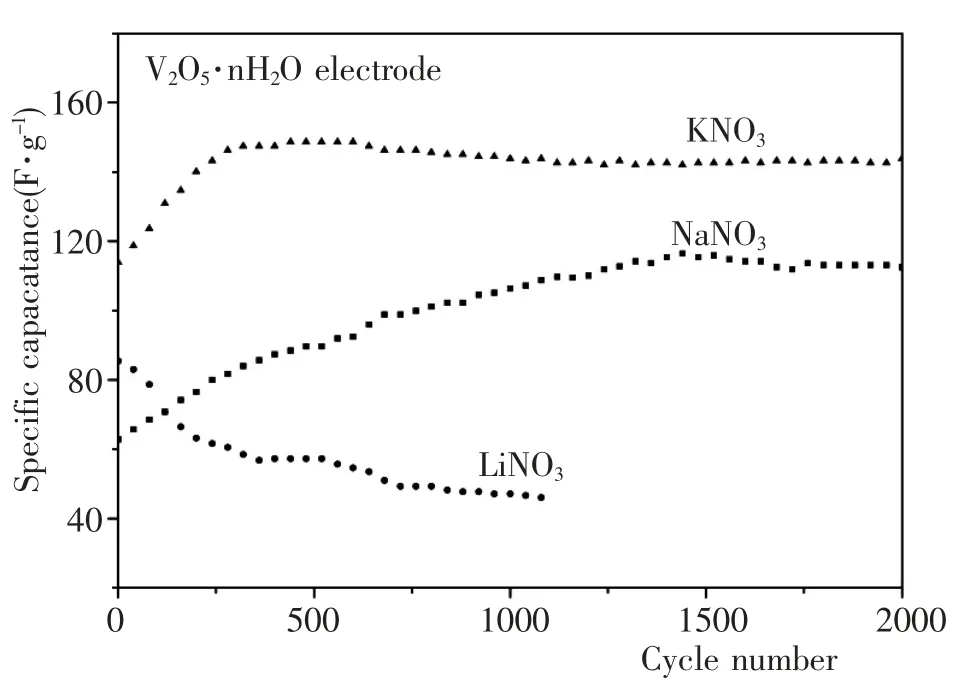
图8 V2O5·nH2O 电极在不同电解液中的循环性能Fig.8 The cycling performance of the V2O5·nH2O electrode in various solutions
作为超级电容器的电极材料,还要求功率性好,能在大电流密度下充放电. 图9 和图10 为活化后的V2O5·nH2O 电极在KNO3电解液中不同电流密度下的充放电曲线和循环性能. 由图9 可见,在不同的电流密度下,V2O5·nH2O 电极的充放电曲线均呈对称的三角形,充放电效率均为99% -100%. 随着电流密度的增大,比电容有所减小,但循环性能都比较好. 当电流密度从200mA·g-1增大到800mA·g-1时,其比电容从148.1F·g-1降低到115.6F·g-1;但循环性能较好,1 000 次循环后比电容仍为113.2F·g-1,电容保持率为97.9%,说明V2O5·nH2O 材料在大电流密度下充放电性能较好,适合做超级电容器的电极材料.

图9 活化后的V2O5·nH2O 电极在不同电流密度下的充放电曲线Fig.9 The charge/discharge curves of the V2O5·nH2O electrode at different current densities

图10 活化后的V2O5·nH2O 电极在不同电流密度下的循环性能Fig.10 The cycling performance of the V2O5·nH2O electrode at different current densities
3 结 论
本文通过简单的直接水合法合成了V2O5·nH2O 纳米带. XRD 测试结果表明样品为晶型的V2O5,但层间距因水分子的插入而稍稍增大. IR 测试表明样品含有少量水份. SEM 测试结果显示样品是由相互缠绕的纳米带构成. 电化学测试结果表明V2O5·nH2O 纳米带在KNO3电解液中电容性能最好,在LiNO3电解液中最差. 当电流密度为200mA·g-1、电压窗口为(-0.4 -0.8)V 时,V2O5·nH2O 电极在KNO3 电解液中展现出最大的比电容148.1F·g-1;再循环1 400 次后的比电容为142.6F·g-1,比电容保持率为96.3%.当电流密度增大到800mA·g-1时,其比电容为115.6F·g-1;1000 次循环后比电容保持率为97.9%,表明V2O5·nH2O 材料在大电流密度下充放电性能较好. 综上所述,直接水合制备的V2O5·nH2O 纳米带适合做超级电容器的电极材料.
[1] CONWAY B. E. Electrochemical Supercapacitors[M]. New York:Kluwer Academic/Plenum Publishers,1999.
[2] 袁国辉. 电化学超级电容器[M]. 北京:化学工业出版社,2006.
[3] BURKE A. Ultracapacitors:Why,How,and Where is the Technology[J]. Journal of Power Sources,2000,91:37 -50.
[4] FRACKOWIAK E,BEGUIN F. Carbon Materials for the Electrochemical Storage of Energy in Capacitors[J]. Carbon,2001,39:937 -950.
[5] SUBRAMANIAN V,LUO C,STEPHAN A M,et al. Supercapacitors from Activated Carbon Derived from Banana Fibers[J].J. Phys. Chem. C,2007,111:7527 -7531.
[6] XIE Y B,QIAO W M,ZHANG W Y,et al. Effect of the Surface Chemistry of Activated Carbon on its Electrochemical Properties in Electric Double Layer Capacitors[J]. New Carbon Materials,2010,25(4):248 -254.
[7] FRACKOWIAK E,ABBAS Q,FRANCOIS B. Carbon/ Carbon Supercapacitors[J]. Journal of Energy Chemistry,2013,22:226 -240.
[8] ZHENG J P,CYGAN P J,JOW T R. Hydrous Ruthenium Oxide as an Electrode Material for Electrochemical Capacitors[J].J. Electrochem. Soc.,1995,142:2699 -2703.
[9] CHEN I L,WEI Y C,CHEN T Y,et al. Oxidative Precipitation of Ruthenium Oxide for Supercapacitors:Enhanced Capacitive Performances by Adding Cetyltrimethylammonium Bromide[J]. Journal of Power Sources,2014,268:430 -438.
[10] LI X,WU Y J,ZHENG F,et al. Preparation and Characterization of RuO2/Polypyrrole Electrodes for Supercapacitors[J].Solid State Communications 2014,197:57 -60.
[11] HEE Y L,GOODENOUGH J B. Supercapacitor Behavior with KCl Electrolyte[J]. Journal of Solid State Chemistry,1999,144:220 -223.
[12] JEONG Y U,MANTHIRAM A. Nanocrystalline Manganese Oxides for Electrochemical Capacitors with Neutral Electrolytes[J],J. Electrochem. Soc.,2002,149:A1419 -A1422.
[13] BOISSET A,ATHOUEL L,JACQUEMIN J,et al. Comparative Performances of Birnessite and Cryptomelane MnO2 as Electrode Material in Neutral Aqueous Lithium Salt for Supercapacitor Application[J]. Phys. Chem. C,2013,117:7408 -7422.
[14] ZHANG X Y,HAN LI Q,WANG C Y,et al. Double-shelled MnO2Hollow Spheres for Supercapacitors[J]. Materials Letters,2014,136:78 -80.
[15] 王兴磊,何宽新,张校刚. 层状Co3O4的制备及其电化学电容行为[J]. 无机化学学报,2006,22 (6):1019 -1022.
[16] RAKHI R B,CHEN W,HEDHILI M N,et al. Enhanced Rate Performance of Mesoporous Co3O4Nanosheet Supercapacitor Electrodes by Hydrous RuO2Nanoparticle Decoration[J]. Appl. Mater. Interfaces,2014,6:4196 -4206.
[17] LIU K C,ANDERSON M A. Porous Nickel Oxide/Nickel Films for Electrochemical Capacitors[J]. J Electrochem. Soc.,1996,143 (1):124 -129.
[18] YANG Y,LI L,RUAN G,et al. Hydrothermally Formed Three-Dimensional Nanoporous Ni(OH)2Thin-Film Supercapacitors[J]. Nano,2014,8(9):9622 -9628.
[19] LEE Y H,GOODENOUGH J B. Ideal Supercapacitor Behavior of Amorphous V2O5·nH2O in Potassium Chloride (KCl)Aqueous Solution[J]. J Solid State Chemmistry,1999,148:81 -84.
[20] REDDY R N,REDDY R G. Porous Structured Vanadium Oxide Electrode Material for Electrochemical Capacitors[J]. Journal of Power Sources,2006,156:700 -704.
[21] CHEN L M,LAI Q Y,ZENG H M,et al. Effects of Various Factors on Capacitive Properties of VOx·nH2O Powders in Aqueous Electrolyte[J],J Appl Electrochem,2011,41:299 -305.
[22] SARAVANAKUMAR B,PURUSHOTHAMAN K K,MURALIDHARAN G. Interconnected V2O5Nanoporous Network for High-Performance Supercapacitors[J]. Appl. Mater. Interfaces,2012,4:4484 -4490.
[23] Qu Q T,Liu L L,Wu Y P,et al. Electrochemical Behavior of V2O5·0.6H2O Nanoribbons in Neutral Aqueous Electrolyte Solution[J]. Electrochimica Acta,2013,96:8 -12.
[24] Li G,Pang S,Jiang L,et al. Environmentally Friendly Chemical Route to Vanadium Oxide Single-Crystalline Nanobelts as a Cathode Material for Lithium-Ion Batteries. J. Phys. Chem. B,2006,110:9383 -9386.
[25] Liu J,Wang X,Peng Q,et al. Vanadium Pentoxide Nanobelts:Highly Selective and Stable Ethanol Sensor Materials,Adv.Mater.,2005,17:764 -767.
