二氧化硅溶胶体系的电导行为
2015-11-13
二氧化硅溶胶体系的电导行为
黎珊1,2,戴红旗1,姜兴茂2,陈龙龙2
(1南京林业大学江苏省制浆造纸科学与技术重点实验室,江苏南京210037;2常州大学石油化工学院,江苏常州213164)
摘要:二氧化硅溶胶的导电性与其储存稳定性及纳米材料的制备和应用密切相关。本文通过Stöber法制备了分散性较好的非晶型二氧化硅纳米微球,用激光粒度分析仪、高分辨透射电子显微镜和X射线衍射仪对微粒进行了表征。通过电导率的变化监测了不同条件下的溶胶-凝胶动力学过程,并详细地研究了影响二氧化硅溶胶体系电导行为的各个因素。实验结果表明,氨水用量对溶胶-凝胶过程的平衡时间有很大影响,氨水用量少,体系平衡时间短,反之亦然。二氧化硅的浓度、粒径、分散介质的温度、pH值和电解质浓度对溶胶体系的电导率都有显著的影响,并得出了二氧化硅的浓度和体系温度与电导率之间呈线性关系,同时发现,硅溶胶体系的电导率与胶体粒子总的比表面积成正比,与颗粒表面的ζ电位也密切相关。
关键词:二氧化硅;胶体;粒度分布;电导率;比表面积;ζ电位
第一作者:黎珊(1979—),女,博士研究生,讲师。联系人:戴红旗,教授,博士生导师,主要从事精细化学品的开发及造纸湿部化学的研究。E-mail hgdhq@njfu.edu.cn;姜兴茂,教授。E-mail jxm@cczu.edu.cn。
Study on the electric conductivity of silica sol system
LI Shan1,2,DAI Hongqi1,JIANG Xingmao2,CHEN Longlong2
(1Jiangsu Province Key Lab of Pulp and Paper Science and Technology,Nanjing Forestry University,Nanjing 210037,Jiangsu,China;2School of Petrochemical Engineering,Changzhou University,Changzhou 213164,Jiangsu,China)
Abstract:Electric conductivity of silica sol is closely related to its storage stability and preparation and application of nanomaterials.Mono-dispersed non-crystalline silica nanospheres were fabricated by Stöber process and the resulted microparticles were characterized by laser particle size analyzer,high-resolution transmission electron microscope and X-ray diffractometer.The sol-gel dynamic processes at various conditions were monitored by conductivity variation,and factors affecting the electric conductivity of silica sol system were discussed.The experimental results indicate that the dose of aqueous ammonia has a large impact on the equilibration time of sol-gel process and it decreases with the decrement of the dose of aqueous ammonia,vice versa.The electric conductivity of silica sol system is apparently influenced by the concentration and diameter of SiO2microparticles,system temperature,pH value and the electrolyte concentration of dispersion medium.It is concluded that the electric conductivity shows a good linear relationship with SiO2concentration and system temperature.Meanwhile,it is found that the electric conductivity is proportional with the total surface area of the microparticles of silica sol system,and is closely related to the zeta potential of SiO2particle surface.
Key words:silica;colloid;particle size distribution;electric conductivity;specific surface area;zeta potential
二氧化硅溶胶(silica sol或colloidal silica)是非晶型二氧化硅的聚集微粒在水中均匀分散形成的胶体溶液,也称硅溶胶或硅酸溶胶。硅溶胶具有粒径小、比表面积大、黏度较低、黏结力强、生物相容性好等特点,广泛应用于科研及各工业领域,如涂料、造纸、纺织、精密铸造、耐火材料、溶胶-凝胶科学、生物医药和膜科学等领域中[1-3]。硅溶胶在应用中的性质与其表面电荷特性密切相关,如表面电荷密度和ζ电位[4-5]。二氧化硅粒子分散在水溶液中,其颗粒表面的硅醇基团(Si—OH)能发生去质子化反应[6]。当溶液pH值在2~12范围内时,Si—OH具有一定的活性,能发生电离,形成Si—O−。因此在较宽的pH值范围内,二氧化硅颗粒表面一般带负电。二氧化硅粒子的表面电荷密度与溶液pH值、离子强度和颗粒粒径密切相关[4,7-8]。
ζ电位是用于研究氧化物和黏土矿物等带电颗粒传递性质的一个关键参数,有关ζ电位与表面电导率的关系也有相关报道[6,9-10]。表面电导率是分散体系主体电导率的表面等效,也等于分散体系的总电导率与无双电层时体系的电导率之差[11],反映了分散体系中带电粒子的导电能力。导电性是二氧化硅胶体的重要性质之一,与胶体的稳定性及纳米材料的制备和应用直接相关。通过电导率的测定可以比较简单、方便、直观地了解二氧化硅的制备过程。通过分散体系电导率的测定再结合其他方法的使用,可以测出Stöber法过程中正硅酸乙酯(TEOS)水解和硅酸缩聚的反应速率常数[12],监控Stöber法过程中SiO2的形成过程,从而判断反应终点[13]。到目前为止,对于二氧化硅胶体溶胶-凝胶过程中溶胶体系的电导行为较少有人进行系统的研究。本文采用Stöber法制备二氧化硅胶体,通过电导率的变化研究了溶胶-凝胶动力学过程并确定了反应平衡时间,从影响二氧化硅胶体导电性方面出发,得出了二氧化硅溶胶的导电性与胶体粒径、温度、浓度、酸碱度等因素之间的关系。
1 实验
根据经典Stöber法[14]制备非晶型二氧化硅纳米微球,其具体过程为:首先配制A溶液(含无水乙醇和质量分数25%的氨水)和B溶液[含正硅酸乙酯(TEOS)和无水乙醇],试剂均为分析纯。搅拌下将B溶液倒入A溶液,室温下反应一定时间,即得二氧化硅溶胶,通过电导率的测定来判断反应终点。反应体系中各物质的用量见表1。为了提高胶体的稳定性以及消除体系中无水乙醇和氨水的影响,所制得的胶体通过旋转蒸发仪在55℃进行多次蒸馏,最后得到含二氧化硅纳米颗粒和水的溶胶。所用其他试剂均为分析纯,水为去离子水(电阻率18.2MΩ·cm)。
采用英国马尔文ZEN3600纳米激光粒度分析仪(DLS)来测定二氧化硅纳米微球的粒径分布,日本电子株式会社JEM-2100高分辨透射电子显微镜(TEM)来观察其形貌,日本理学D/Max 2500 PC 的X射线衍射仪(XRD)来分析其结构。溶胶体系的电导率变化通过梅特勒-托利多S30K电导率仪来考察,无特别说明,电导率的测定在25℃下进行。
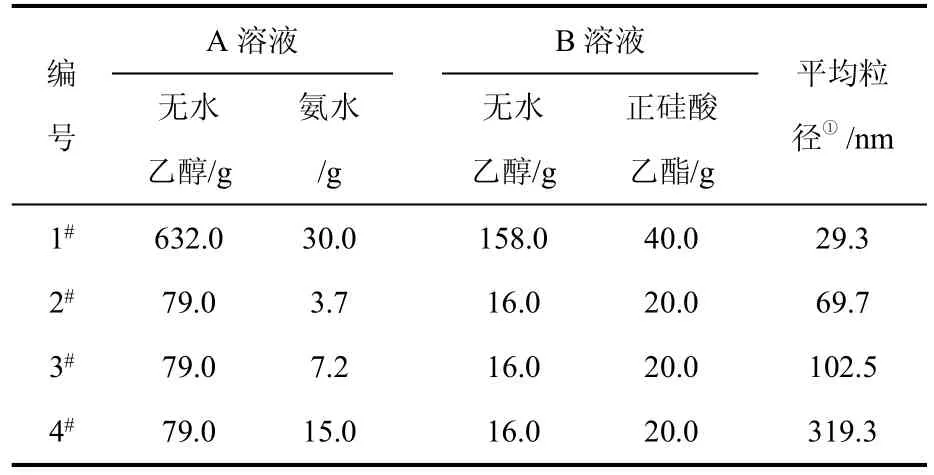
表1各反应体系中物质的用量及平均粒径
2 结果与讨论
2.1非晶型二氧化硅的表征
首先对所制备的SiO2微粒的粒径、形貌及结构进行表征。由表1可以看出,从实验2#到4#,SiO2微粒的粒径随氨水用量的增加而增大,当氨水用量从3.7mL、7.2mL增加到15.0mL时,微粒的平均粒径从69.7nm、102.5nm增加到319.5nm,这与其他研究者[14-15]的结论一致。而1#微粒的粒径最小,这与1#配方中TEOS的质量分数(4.65%)最低有关,因为最终SiO2微粒的粒径与硅源(即TEOS)浓度有关[15],即微粒的最终粒径正比于TEOS浓度的1/3(d∝TEOS(mol)1/3)。图1为4#SiO2微粒的特性图。从图1(a)可以看出,实验中制备的SiO2微粒粒径分布较窄,分散性较好。图1(b)所示XRD图中,在24°左右出现的馒头峰表明所制得的SiO2胶体微粒是非晶型的。由图1(c)可知,利用Stöber法制得的SiO2颗粒球形度很好,颗粒大小较均匀。

图1 4 #SiO2 微粒的粒径分布图、XRD图和TEM图
2.2溶胶-凝胶过程中电导率的变化
实验中采用的S30K电导率仪可以每隔1s自动记录体系的电导率,实时监测溶胶-凝胶过程中体系电导率的变化。图2中4条曲线的反应原料组成参见表1。由图2可知,1#反应体系的电导率达到稳定状态所需的时间最短,约为265min;2#、3#、4#达到稳定的时间依次增加,分别为274min、400min 和493min。其中,1#、2#、3#反应体系的电导率随反应时间的增加先增大后减小,最后达到稳定,与王金忠等[13]的实验结果相近,其中3#的上升段非常短,58s即达最高点;4#的电导率随着反应时间的增加持续减小。这种现象与体系中氨水的加入量有关。当氨水的加入量较少时(1#、2#分别为0.87%、0.78%),体系对氧化硅的溶解度低,成核速率快,成核数量多,胶体粒径小,高的比表面积有利于溶液中可溶性氧化硅快速扩散到氧化硅核表面并进一步生长,因此平衡时间短。当氨水加入量较高时(3#、4#分别为1.47%、2.88%),体系中氧化硅的溶解度高,成核数量少,晶核生长形成较大的球形颗粒,比表面积较小,因此整个反应体系达到平衡的时间较长。

图2 溶胶-凝胶过程中电导率随时间的变化
反应初期各曲线的电导率从1#~4#依次增加,这与反应初期体系中的氨水含量和TEOS的水解速率有关。1#、2#中氨水含量较低,TEOS的水解速率低,TEOS在水解成硅酸的过程中,电导率逐渐增加,当电导率达到最高点时,TEOS完全水解成硅酸,之后随着缩合反应的进行,电导率逐渐降低直至稳定。而3#、4#中氨水含量较高,体系的电导率随之增高,同时TEOS迅速水解,体系的电导率瞬间达到最大,随着反应的进行,水解产生的硅酸逐渐缩合成二氧化硅晶核,电导率逐渐降低并趋向稳定。
2.3二氧化硅的浓度及粒径对溶胶体系电导率的影响
实验中比较了二氧化硅的浓度及粒径对溶胶体系电导率的影响,见图3。由图3可知,不同粒径下二氧化硅的质量分数与电导率均呈良好的线性关系,1#~3#三条线的相关系数R2分别为0.9998、0.9980、0.9881。这是因为二氧化硅浓度的增加导致其微粒的总比表面积增加,从而使得二氧化硅微球表面所带的总电荷也随之增加。另外,图中3条曲线与Y轴的交点分别为1.7048、8.8762、13.6810,实验中所用去离子水的电导率为2.5μS/cm,这3个数值在合理的范围内,说明经过处理后得到的二氧化硅水溶胶几乎不含其他离子性杂质。比较不同粒径的硅溶胶可发现,在相同质量分数下,溶胶体系的电导率随二氧化硅平均粒径的减小而增大。溶胶粒径越小,二氧化硅微粒的比表面积越大,微粒表面所带电荷越多,因此电导率也随之增大。这说明二氧化硅溶胶的电导率与微粒的比表面积有密切关系。

图3 二氧化硅的浓度及粒径与溶胶体系电导率的关系
2.4温度对二氧化硅溶胶体系电导率的影响
一般而言,溶液的电导率与温度紧密相关。由图4可知,温度在15~40℃范围内,相同浓度的二氧化硅其电导率随温度的升高而增加,并且温度与电导率呈较好的线性关系(相关系数R2>0.99),符合一般规律。相同浓度下,2#[d=69.7nm,见图4(a)]的斜率要比3#[d=102.5nm,见图4(b)]大,如果考虑在一定的实验误差范围内,2#氧化硅浓度W=8%时的斜率约等于W=4%时斜率的2倍(8.375≈2× 3.9516=7.9032),3#样品W=8%时的斜率更接近于W=4%时斜率的2倍(6.955≈2×3.4246=6.8492)。可能的原因是由于温度升高载流子的运动速率增大,所以电导率随温度的升高而增大。浓度高时载流子的数目多,所以温度变化时其电导率的变化也大。

图4 温度与二氧化硅溶胶体系电导率的关系
2.5硅溶胶的加入量对不同pH值水溶液电导率的影响
胶体的稳定性与胶体粒径、表面电荷、含量以及分散介质的pH值和离子强度等因素有关。采用Stöber法制得的硅溶胶呈弱碱性,其中2#硅溶胶的pH值约为8.31,3#pH值约为8.91,这是处理后溶液中残留了少量的氨造成的。实验中将一定量的硅溶胶(浓度为10%)在搅拌状态下加入到15g pH值分别为2、3、4、8、9、9.5的水溶液中,考察硅溶胶的加入量对溶液电导率的影响。用0.1mol/L的NaOH和HCl溶液来调节水溶液的pH值,实验结果见图5。
由图5(b)可知,当3#硅溶胶加入到pH值为3、4、8、9.5的水溶液中,由于胶体本身呈碱性(pH=8.91),因此混合后二氧化硅的浓度高于1.667%时,混合液的pH值都在8.50~8.82。当离子强度一定、pH≥6.5时,硅溶胶颗粒表面带负电,其ζ电位趋于稳定[17-18],因此导电性随二氧化硅的增加呈线性增加,且斜率几乎相同,如图6(b)。典型二氧化硅胶体的等电点约为2[19],也就是说,当溶液pH>2时,颗粒表面带负电;pH<2时,颗粒表面带正电。因此,当水溶液酸性较强(pH=2或3)时,添加少量二氧化硅(浓度低于1.667%),混合液的pH值在2.33~4.90,颗粒表面的ζ电位接近零或带微弱负电,由于二氧化硅颗粒对溶液中导电离子的位阻作用,胶体溶液的导电性随二氧化硅的添加逐渐降低。当加入量增加时,溶液pH值高于6.5,导电性随二氧化硅的添加而逐渐增加,期间出现一拐点。因为酸性的差别,pH=3的拐点出现得更早,而在实验范围内,pH=2时混合液的导电性无明显增加。由图5(a)、图6(a)可知,其导电性和pH值的变化与图5(b)、图6(b)相近,但pH=2、3时的拐点出现较晚,在较高二氧化硅的添加量时出现,这与二氧化硅胶体制备过程中残留的氨及其引起的pH值升高(2#胶体的pH值为8.31)有关,较低的碱性降低了硅溶胶中和酸的能力。即使当二氧化硅的浓度达5%时,硅溶胶与pH=2的水溶液混合时混合液的pH值仍低于6.5,颗粒表面带微弱负电,未能引起导电性的升高。

图5 与不同pH值水溶液混合后混合液的pH值与二氧化硅浓度的关系
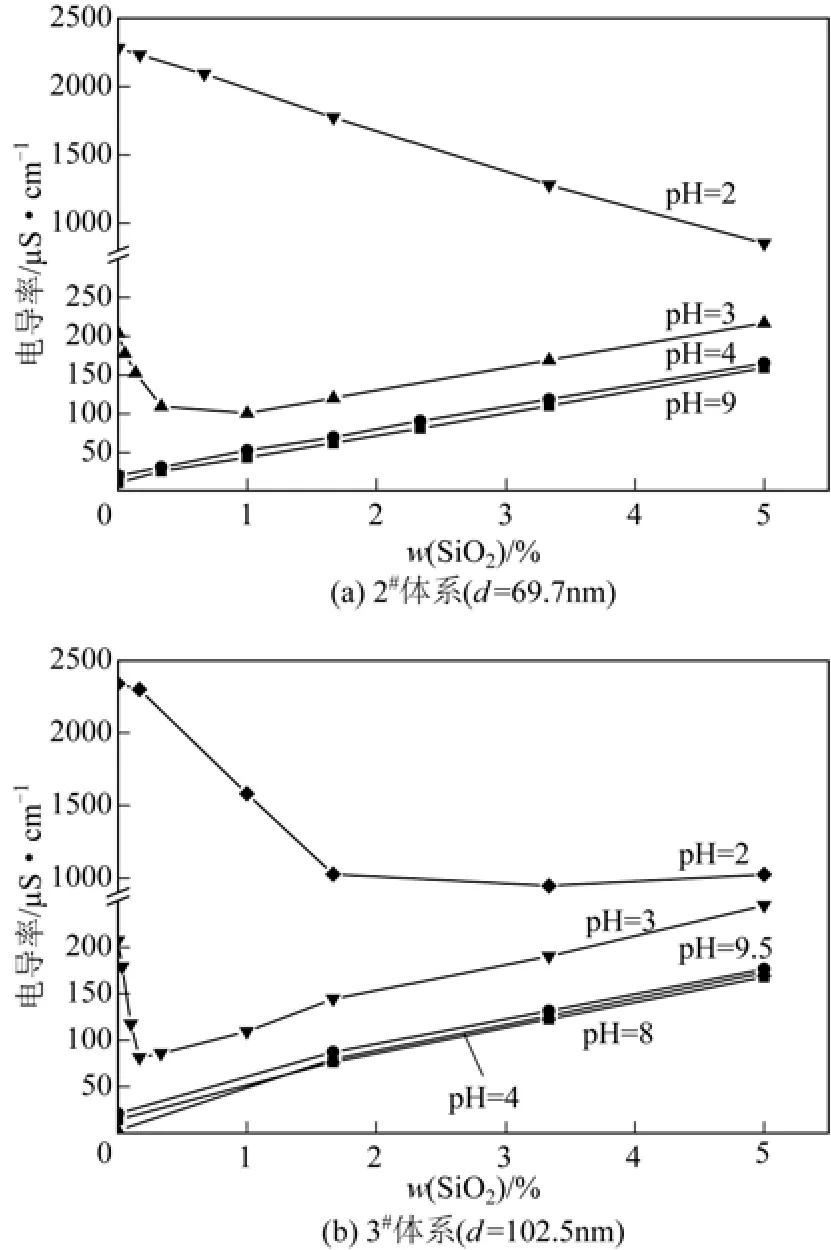
图6 混合液的电导率与二氧化硅浓度的关系
2.6电解质对二氧化硅溶胶体系电导率的影响
电解质的存在会影响硅溶胶的电导率。溶液中的电解质浓度与离子强度成线性关系,离子强度高,会压缩胶体的双电层,降低胶体的ζ电位绝对值[17],从而影响体系的电导率。实验中以NaCl为例,比较了硅溶胶的加入量对混合体系电导率的影响,将硅溶胶(d=69.7nm,pH=8.31)分别加入到离子强度不同的去离子水和0.001mol/L NaCl溶液中,其结果见图7。比较图7中的曲线a和曲线c可以发现,硅溶胶与NaCl溶液混合后,混合液的电导率比SiO2水溶液的电导率明显升高,差值约为120μS/cm,此值低于0.001mol/L NaCl溶液的电导率134.3μS/cm,说明NaCl溶液中离子强度的增加压缩了SiO2颗粒的双电层,降低了SiO2颗粒的ζ电位,其总的电导率(曲线a)并非曲线b和曲线c的叠加,而是略低于曲线b和曲线c的叠加。

图7 与水和氯化钠溶液混合后混合液的电导率与二氧化硅浓度的关系
3 结论
采用Stöber法制备了分散性较好的非晶型二氧化硅纳米微球,利用电导率的变化可以实时监测溶胶-凝胶动力学过程。结果发现,氨水的用量对反应平衡时间有很大的影响,氨水用量少,体系的平衡时间短;氨水用量大,体系的平衡时间延长。通过对二氧化硅溶胶体系的电导行为研究发现,溶胶体系的电导率与温度、微粒的总比表面积和ζ电位密切相关。体系的SiO2浓度高,粒径小,总的比表面积增加,体系的电导率相应增加。相同粒径时,胶体的电导率与SiO2浓度呈线性关系。分散介质的pH值和离子强度会影响胶体的ζ电位,从而影响体系的电导率。
参考文献
[1]李良,梁汉东,张海军,等.硅溶胶应用评述[J].无机盐工业,2006,38(8):8-10.
[2]Snyder K L,Holmes H R,van Wagner M J,et al.Development of vapor deposited silica sol-gel particles for use as a bioactive materials system[J].Journal of Biomedical Materials Research Part A,2013,101(6):1682-1693.
[3]廖婵娟,赵健全,于萍,等.不同结构二氧化硅对聚偏氟乙烯超滤膜的性能影响[J].化工进展,2011,30(s1):277-281.
[4]Atalay S,Ma Y,Qian S Z.Analytical model for charge properties of silica particles[J].Journal of Colloid and Interface Science,2014,425:128-130.
[5]Lu F,Wu S H,Hung Y,et al.Size effect on cell uptake in well-suspended,uniform mesoporous silica nanoparticles[J].Small,2009,5(12):1408-1413.
[6]Leroy P,Devau N,Revil A,et al.Influence of surface conductivity on the apparent zeta potential of amorphous silica nanoparticles[J].Journal of Colloid and Interface Science,2013,410:81-93.
[7]Barisik M,Atalay S,Beskok A,et al.Size dependent surface charge properties of silica nanoparticles[J].Journal of Physical Chemistry C,2014,118(4):1836-1842.
[8]Abbas Z,Labbez C,Nordholm S,et al.Size-dependent surface charging of nanoparticles[J].Journal of Physical Chemistry C,2008,112(15):5715-5723.
[9]Leroy P,Tournassat C,Bizi M.Influence of surface conductivity on the apparent zeta potential of TiO2nanoparticles[J].Journal of Colloid and Interface Science,2011,356(2):442-453.
[10]Crespy A,Bolèveb A,Revil A.Influence of the Dukhin and Reynolds numbers on the apparent zeta potential of granular porous media[J].Journal of Colloid and Interface Science,2007,305(1):188-194.
[11]Lyklema J,Minor M.On surface conduction and its role in electrokinetics[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,1998,140(1):33-41.
[12]董鹏.单分散二氧化硅颗粒的研究进展[J].自然科学进展,2000,10(3):201-207.
[13]王金忠,赵岩,张彩碚.单分散球形SiO2形成过程的电导率和粘度变化[J].硅酸盐通报,2003(1):88-91.
[14]Stöber W,Fink A,Bohn E.Controlled growth of monodisperse silica spheres in the micron size range[J].Journal of Colloid and Interface Science,1968,26(1):62-69.
[15]Giesche H.Synthesis of monodispersed silica powders I.Particle properties and reaction kinetics[J].Journal of the European Ceramic Society,1994,14(3):189-204.
[16]Razo D A S,Pallavidino L,Garrone E,et al.A version of Stöber synthesis enabling the facile prediction of silica nanospheres size for the fabrication of opal photonic crystals[J].Journal of Nanoparticle Research,2008,10(7):1225-1229.
[17]Kim J,Lawler D F.Characteristics of zeta potential distribution in silica particles[J].Bulletin of the Korean Chemical Society,2005,26(7):1083-1089.
[18]Ceram Research Ltd.Zeta potential[J/OL].[2001-10-09].http://www.azom.com/article.aspx?ArticleID=935.
[19]Elimelech M,Jia X D,Gregory J,et al.Particle Deposition and Aggregation:Measurement,Modelling and Simulation[M].U.K.,Oxford:Butterworth- Heinemann Ltd.,1998:23-32.
基金项目:国家自然科学基金(21373034,31470599)及江苏省高校优势学科建设工程(PAPD)项目。
收稿日期:2014-11-04;修改稿日期:2015-01-14。
DOI:10.16085/j.issn.1000-6613.2015.08.029
文章编号:1000–6613(2015)08–3093–06
文献标志码:A
中图分类号:TQ 170.2
