丙酮-异丙醇-甲基烯丙醇体系气液平衡数据测定及关联
2015-11-13
丙酮-异丙醇-甲基烯丙醇体系气液平衡数据测定及关联
李静,齐鸣斋
(华东理工大学化工学院,上海200237)
摘要:采用双循环气液平衡釜,测定了常压(101.3 kPa)下丙酮-甲基烯丙醇和异丙醇-甲基烯丙醇二元体系以及部分丙酮-异丙醇-甲基烯丙醇三元体系的气液平衡数据。二元气液平衡数据经Herington面积检验法检验,符合热力学一致性。用Wilson和NRTL液相活度系数方程对两个二元体系的气液平衡数据进行关联,效果良好。由关联得到的两个二元体系的Wilson和NRTL模型参数,及Aspen Plus数据库中的丙酮-异丙醇体系的Wilson和NRTL模型参数预示部分三元体系的气液平衡数据,与实验值相比,丙酮、异丙醇和甲基烯丙醇气相摩尔分率平均绝对偏差分别小于0.0137、0.0113、0.0117。实验数据和关联结果为该三元体系的精馏分离提供了一定的基础数据。
关键词:甲基烯丙醇;气液平衡;模型;测定与关联
第一作者:李静(1988—),男,硕士研究生,主要从事化工分离研究。E-mail lijing_ecust@163.com。联系人:齐鸣斋,教授,主要从事化工单元操作的研究。E-mail qimz@ecust.edu.cn。
甲基烯丙醇(MAO)是一种重要的化工中间体,主要用于合成香料、树脂等。以甲基烯丙醇和环氧乙烷为原料合成的甲基烯丙醇聚氧乙烯醚(TPEG),是生产新一代高性能混凝土减水剂的重要原料[1]。应用领域非常广阔。
目前,文献中报道的甲基烯丙醇的工业合成方法较少,武汉凯森化学有限公司[2]采用催化剂循环催化甲基丙烯醛的氢化法合成甲基烯丙醇,该方法具有原子经济性、环境友好、收率高、后处理简单等优点,但是生产成本较高。由甲代烯丙基氯[3]水解能够很容易得到高纯度的甲基烯丙醇,但同样存在生产成本高的问题。采用甲基丙烯醛与异丙醇在催化剂异丙醇铝的催化作用下经Meerwein- Ponndorf-Verley(MPV)[4-5]还原反应生产甲基烯丙醇,该生产工艺简单、成本低,在理想情况下异丙醇铝循环使用,反应产物为丙酮(ACT)、甲基烯丙醇(MAO)以及未反应完的异丙醇。为完善丙酮、异丙醇和甲基烯丙醇的分离,需这三元之间的气液平衡数据。
本工作测定了常压下丙酮-甲基烯丙醇、异丙醇-甲基烯丙醇二元体系以及部分丙酮-异丙醇-甲基烯丙醇三元体系的气液平衡数据,用Herington面积检验法对实验数据进行了热力学一致性检验。然后通过Aspen Plus软件,采用Wilson和NRTL活度系数模型关联实验数据,并得到相应的模型参数。用关联得到的丙酮-甲基烯丙醇、异丙醇-甲基烯丙醇的Wilson、NRTL模型参数以及Aspen Plus数据库中的丙酮-异丙醇模型参数预测了三元体系的气液平衡数据,并与实验值比较,为精馏提纯甲基烯丙醇的过程开发提供了基础数据。
1 实验材料与方法
1.1材料
丙酮,分析纯,质量分数≥99.5%,天津市科密欧化学试剂有限公司;异丙醇,分析纯,质量分数≥99.5%,天津市科密欧化学试剂有限公司;甲基烯丙醇,化学纯,纯度≥99.5%,山东易达利化工有限公司。
1.2实验装置
实验仪器:双循环气液平衡釜,天大北洋化工实验设备有限公司,如图1所示。
1.3实验方法[6-7]
把配好的待测溶液加入到气液平衡釜中,在常压(101.3kPa)下开始加热,待温度稳定,气相冷凝液回流稳定后,继续回流一段时间。每30min取一次气相冷凝液试样,当两次气相组成不变时,认为达到了稳定的相平衡。达到稳定相平衡后,记下温度,分别对液相和气相冷凝液取样,并分析组成,停止加热。
1.4色谱分析方法
采用安捷伦7820A气相色谱仪,通过内标法分析有机组成。色谱条件为检测器280℃;进样口220℃;色谱柱型号为DB-624毛细色谱柱;色谱柱规格为30m×320μm×1.8μm;柱箱温度为初始40℃,保持4min,然后以8℃/min升至80℃,再以25℃/min至240℃,保持10min;进样量:0.4μL。

图1 气液平衡测定装置
1.5实验装置及实验方法的可靠性验证
利用该双循环气液平衡釜,按照以上实验方法测定了部分丙酮-异丙醇常压下的气液平衡数据,并将实验数据与丙酮-异丙醇常压下的气液平衡数据计算值进行比较,见图2。由图可见,该实验装置及试验方法具有可靠性。

图2 丙酮(1 )-异丙醇(2 )气液平衡相图
2 实验数据与关联
2.1实验结果
实验测定了101.3kPa下丙酮-甲基烯丙醇和异丙醇-甲基烯丙醇体系等压下的气液平衡数据见表1和表2,部分丙酮-异丙醇-甲基烯丙醇三元体系等压气液平衡数据见表3。气液平衡相图见图3。表中的气液平衡数据均用摩尔分数表示。

表1常压下丙酮(1)-甲基烯丙醇(3)二元体系气液平衡实验数据与关联结果对比

表2常压下异丙醇(2)-甲基烯丙醇(3)二元体系气液平衡实验数据与关联结果对比

表3常压下丙酮(1)-异丙醇(2)-甲基烯丙醇(3)体系气液平衡数据实测值与计算值偏差比较

图3 丙酮(1 )-甲基烯丙醇(3 )和异丙醇(2 )-甲基烯丙醇(3 )气液平衡相图
2.2热力学一致性检验
表1和表2为等压下的气液平衡数据,由于混合热数据未知,采用Herington推荐的经验方法进行热力学一致性检验[8]。于是,需要由气液平衡关系式(1)计算活度系数。

式(1)中饱和蒸气压pis由Antoine方程计算,计算公式如式(2)。

式(2)中pis单位为kPa,丙酮、异丙醇和甲基烯丙醇的Antoine常数见表4。

表4丙酮、异丙醇和甲基烯丙醇的Antoine常数
为了进行热力学一致性检验,分别将ln(γ1/γ3)拟合为x1的二次多项式,将ln(γ2/γ3)拟合为x2的二次多项式,以便计算积分值(即面积),图4所示为热力学一致性检验图。Herington建议采用的判别标准为:若(D−J)<10,则该实验数据可认为符合热力学一致性。计算式为式(3)、式(4)。

Tmax、Tmin分别为最高、最低热力学温度,计算结果见表5。由表5可知,(D−J)<10,因此这二组气液平衡数据均符合热力学一致性。
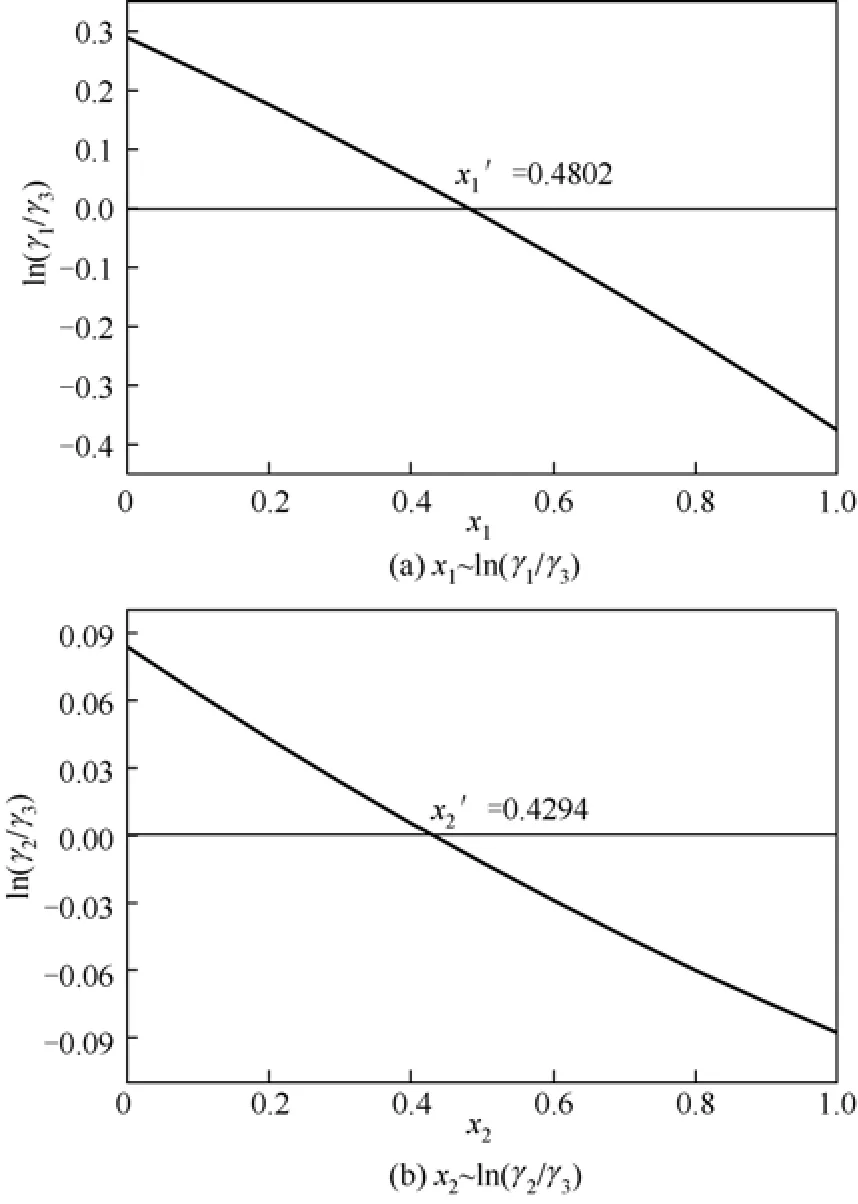
图4 x1 ~ ln(γ1 /γ3 )与x2 ~ ln(γ2 /γ3 )关系图

表5气液平衡数据的热力学一致性检验
2.3实验数据的关联
在常压下,丙酮-甲基烯丙醇和异丙醇-甲基烯丙醇二元体系的气相可视为理想气体,液相为非理想溶液,用活度系数计算液相逸度,见式(1)。通过Aspen Plus软件分别采用Wilson和NRTL活度系数模型关联实验数据[11],实验数据与关联的结果对比见表1和表2,表中列出了气相摩尔分数绝对偏差、温度绝对偏差。
通过表1和表2中温度和气相组成的误差比较,发现对于丙酮-甲基烯丙醇和异丙醇-甲基烯丙醇两个二元体系,Wilson和NRTL模型都能够很好地描述实验数据。关联得到的Wilson、NRTL模型二元交互作用参数见表6。用关联的上述两个二元体系的交互作用参数和Aspen Plus数据库中已有的丙酮-异丙醇的Wilson、NRTL模型参数可计算丙酮-异丙醇-甲基烯丙醇三元体系的温度和气相平衡组成,表3所示为计算值与实验值的偏差比较。由表3可以看出,丙酮、异丙醇和甲基烯丙醇的气相平衡组成的平均绝对偏差分别小于0.0137、0.0113、0.0117,温度的平均绝对偏差为1.1℃。实验值与预测值吻合较好。

表6二元气液平衡数据关联得到的Wilson和NRTL模型参数
3 结论
(1)实验测定了丙酮-甲基烯丙醇和异丙醇-甲基烯丙醇在常压下的气液相平衡数据以及部分三元气液相平衡数据。用Herington面积法检验了二元体系气液相平衡实验数据的热力学一致性,结果表明实验数据符合热力学一致性要求。
(2)用Wilson和NRTL方程分别对丙酮-甲基烯丙醇、异丙醇-甲基烯丙醇二元气液相平衡实验数据进行了关联,误差比较结果表明,Wilson和NRTL方程计算值与实验值吻合较好,并得到相应的Wilson和NRTL模型参数。
(3)采用回归得到的两个二元体系的模型参数及Aspen Plus数据库中已有的丙酮-异丙醇的Wilson、NRTL模型参数计算丙酮-异丙醇-甲基烯丙醇三元体系的气相相平衡组成和温度,计算值与实验值吻合,说明数据和模型可靠,为精馏提纯甲基烯丙醇的模拟计算提供了基础数据。
符号说明
p——压强,Pa
ps——组分i的饱和蒸气压,kPa i
R——通用气体常数,J/(mol·K)
T——热力学温度,K
xi——组分i的液相摩尔分数
yi——组分i的气相摩尔分数
γi——组分i的液相活度系数
参考文献
[1]吴长龙,辛德胜,王跃松,等.醚类聚羧酸系高性能减水剂的研究与应用[J].当代化工,2010,39(6):617-619.
[2]武汉凯森化学有限公司.一种催化剂可循环使用的制备2-甲基丙烯醇的氢化合成法:中国,2011100719548[P].2012-08-31.
[3]陈伟雄.高纯异丁烯化工利用前景广阔[J].化工科技市场,2005(11):42-44.
[4]孟翠敏.烯丙醇的合成与应用[J].中国氯碱,2007(6):18-20.
[5]石能富,张波,徐春雷,等.MgZrAlO复合氧化物催化酮氢转移还原反应[J].高校化学工程学报,2011,25(1):61-66.
[6]邵荣,许伟,冒爱荣,等.化学工程与工艺实验[M].上海:华东理工大学出版社,2010:140-146.
[7]李柏春,王琮,黄岩,等.丙酮-水-丙酮连氮体系汽液平衡测定与关联[J].化工进展,2013,32(10):2292-2296.
[8]冯新,宣爱国,周彩荣.化工热力学[M].北京:化学工业出版社,2009:194-198.
[9]时钧,汪家鼎,余国琮,等.化学工程手册[M].第2版.上卷.北京:化学工业出版社,1996:109-112.
[10]李静,齐鸣斋.甲基烯丙醇饱和蒸汽压的测定与关联[J].上海化工,2014,39(8):5-7.
[11]包宗宏,武文良.化工计算与软件应用[M].北京:化学工业出版社,2013:31-39.
研究开发
研究开发
Measurement and correlation of vapor-liquid equilibria data for acetone-isopropanol-methallyl alcohol system
LI Jing,QI Mingzhai
(School of Chemical Engineering,East China University of Science and Technology,Shanghai 200237,China)
Abstract:Vapor-liquid equilibrium(VLE)data for acetone(ACT)-methallyl alcohol(MAO)binary system,isopropanol(IPA)-methallyl alcohol binary system and parts of ACT-IPA-MAO ternary system were determined in an Othmer equilibrium at atmospheric pressure(101.3 kPa).The experimental data of binary system were verified by Herington method and were consistent with thermodynamics.The data of ACT-MAO and IPA-MAO binary systems were correlated with the Wilson and NRTL models by Aspen Plus.Respectively,the two models were correlated well with the VLE data and the interaction parameters of ACT-MAO and IPA-MAO were obtained.The Wilson and NRTL interaction parameters of ACT-IPA were already available in Aspen Plus database.Then the vapor compositions of the ternary system were calculated with these interaction binary parameters.Compared with measured experimental VLE data,the mean absolute error of mole fraction for ACT,IPA and MAO is less than 0.0137,0.0113 and 0.0117.The experimental and correlative data could provide a basis for the distillation separation of ACT-IPA-MAO system.
Key words:methallyl alcohol;vapor liquid equilibria;model;measurement and correlation
收稿日期:2014-12-16;修改稿日期:2015-01-04。
DOI:10.16085/j.issn.1000-6613.2015.08.006
文章编号:1000–6613(2015)08–2946–05
文献标志码:A
中图分类号:O 642.42
