脱硫化反应在汞离子传感器中的应用进展
2015-11-13
脱硫化反应在汞离子传感器中的应用进展
程晓红1,2,王松1
(1湖北文理学院低维光电材料与器件湖北省重点实验室,湖北襄阳441053;2湖北文理学院物理与电子工程学院,湖北襄阳441053)
摘要:汞离子具有独特的嗜硫性,因此脱硫化反应被广泛地应用于汞离子传感器的设计之中,并表现出超高的选择性。本文在前期研究工作的基础上,结合相关文献报道,综述了脱硫化反应在汞离子化学传感器中的应用,包括汞离子与硫代羰基化合物发生脱硫反应、汞诱导硫脲衍生物脱硫化氢生成胍类化合物的反应、汞诱导的方酸化合物脱硫醇反应、汞促进氨基硫脲转化为二唑反应以及缩硫醛化合物的脱保护反应。分析文献表明,该领域的研究目前仍存在一些尚未解决的问题:有些化学反应的反应条件较苛刻;有些化学反应在室温下反应速率较慢;一些传感体系对汞离子检测的灵敏度较低。因此,需要更好地利用化学反应,探索并优化传感条件,为反应型汞离子传感器的发展提供更多契机。
关键词:有机化合物;传感器;选择性;化学反应;汞离子
第一作者及联系人:程晓红(1986—),女,博士,讲师,主要从事新型化学与生物传感器的设计合成与性能研究。E-mail chengxiaohong 0807@126.com。
近年来,利用化学传感器来检测环境中的有害物质已成为一个新兴的研究热点。汞离子广泛存在于人们生存的环境中,使人类和生物的持续生存和繁衍受到威胁。它主要以无机汞离子的形式由工业废水排放至环境中,被细菌类微生物从无机汞离子转化为甲基汞,并在生物体如鱼类体内快速积累从而进入食物链。汞对人体的危害主要累及中枢神经系统、消化系统及肾脏,此外对呼吸系统、皮肤、血液及眼睛也有一定的影响。因此,环境中汞离子的分析检测引起人们的极大关注,设计并发展能够高效地识别与检测汞离子的化学传感器已经成为国际上的研究热点。
根据传感过程是否可逆,化学传感器的设计方法可分为两类:传统的超分子传感器和反应型传感器。如图1(a)所示,传统的超分子传感器是利用传感器与客体分子之间的非共价键作用(如配位作用、氢键等)进行识别,传感过程一般是可逆的。当客体分子与传感器分子中的识别位点发生作用时,会引起信号报告单元电子性质的改变,进而导致体系的颜色或荧光的变化。这是一种最经典的识别方式,也是传感器设计之中用到的最主要方式。然而,这类传感器存在灵敏度有限、专一性不强等不足之处,尤其是在水相中,强的溶剂化作用使主-客体之间的相互作用变弱,导致检测的灵敏度显著降低[4-5]。这些问题的存在极大地限制了此类传感器的应用。
1 反应型化学传感器的设计方法
1992年,Czarnik研究组[6]首次报道了一类新型的化学传感器——反应型传感器(reaction-based chemosensor),这类传感器的出现成功地解决了传统超分子传感器中存在的问题,成为国际上研究的热点[图1(b)]。反应型传感器也称化学计量传感器,是基于传感器与客体分子之间的特殊化学反应而实现的(一般是不可逆的)。通过巧妙地设计分子结构,将反应活性基团与荧光团或发色团结合起来,利用反应前后化合物光物理性质的不同,可以实现对被分析物的检测。这种不可逆体系充分利用了化学反应的专一性,因此通常具有较好的选择性[7-10]。
基于特殊化学反应的汞离子传感器得到了极大的发展,越来越多的化学反应被应用于汞离子传感器的设计之中:水溶液中Hg2+离子可与炔烃或烯烃发生羟汞化反应、汞诱导的脱硒反应、加汞化反应以及其他一些反应,均可作为汞离子传感器的设计基础。基于其独特的嗜硫性,脱硫化反应被广泛应用于反应型汞离子传感器的设计之中(图2)。例如,汞离子可与硫代羰基化合物发生脱硫反应生成相应的羰基化合物[图2(a)],能诱导硫脲衍生物脱硫化氢生成胍类化合物[图2(b)],汞诱导的方酸化合物脱硫醇反应[图2(c)],汞促进氨基硫脲转化为1,3,4-二唑[图2(d)],汞离子诱导缩硫醛化合物经历脱保护反应[图2(e)]等。本文将在前期研究工作的基础上,结合相关文献报道,综述基于脱硫化反应的汞离子传感器的研究进展,以及该领域目前的局限及发展趋势。

图1 化学传感器的设计方法

图2 汞离子诱导的脱硫化反应
2 基于脱硫化反应的汞离子传感器
2.1汞诱导硫代羰基化合物的脱硫反应
1992年,Czarnik研究组[6]报道了第一例反应型的汞离子化学传感器1(图3)。化合物1中的硫代酰胺基团既可作为Hg2+离子的反应位点,同时又是光致电子转移过程(photoinduced electron transfer,PET)的电子受体,可有效地猝灭蒽荧光团的荧光。Hg2+离子的加入,诱导化合物1发生脱硫反应,硫代酰胺水解生成酰胺基团,导致PET过程被打断,体系的荧光得以恢复。加入汞离子之后,化合物1溶液的荧光发射增强了近56倍。该传感器对汞离子的检测灵敏度高,响应速度快,可实现在纯水中对汞离子的检测。然而,作为第一例反应型的汞离子传感器,化合物1存在一些不足之处:银离子的加入也能够引起荧光光谱的变化,导致其对汞离子的选择性识别受到限制。
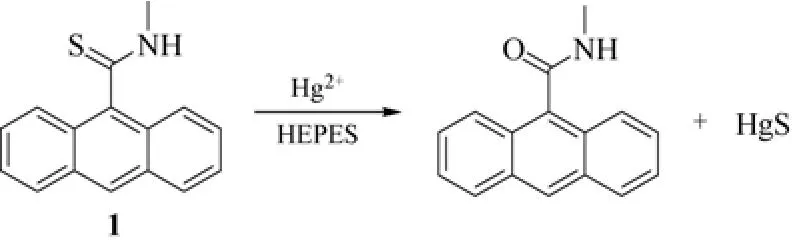
图3 含硫代酰胺基团的化合物1 对汞离子的传感过程
张德清研究组[11]报道了汞离子的荧光传感器2,以蒽为荧光团,以硫代羰基作为汞离子的反应位点(图4)。在化合物2中,1,3-二硫杂环戊烯-2-硫酮基团和蒽荧光团之间存在光诱导电子转移(photoinduced electron transfer,PET)以及荧光共振能量转移(fluorescence resonance energy transfer,FRET)过程,因此,化合物2在溶液中只有很弱的荧光,荧光量子产率为0.01。而汞离子的加入,诱导化合物2发生脱硫反应生成相应的羰基化合物,导致从蒽荧光团到1,3-二硫杂环戊烯-2-硫酮基团的FRET效率降低,同时,PET过程受到抑制,导致体系的荧光增强。随着Hg2+离子的加入,化合物2的溶液在418nm的荧光强度逐渐增强,且与汞离子的浓度呈较好的线性关系。传感器2对Hg2+离子具有很高的灵敏度,检出限为0.05μmol/L。该传感器弥补了上述化合物1在选择性方面的不足,对包括银离子在内的其他金属离子几乎无响应,可实现对汞离子的高选择性检测。
2.2汞诱导硫脲衍生物脱硫生成胍类化合物的反应
化合物3是第一例以硫脲为识别基团的反应型汞离子传感器,可实现对汞离子的比色-荧光双通道检测[12]。如图5所示,汞离子的加入,诱导化合物3经历分子内脱硫成环过程,生成含咪唑啉的化合物4,导致萘酰亚胺4位上氨基的给电子能力大大减弱。相应地,溶液的最大吸收峰从435蓝移至350nm,溶液由黄绿色变为无色;最大发射光谱从530蓝移至475nm,由黄绿光变为蓝光,可实现通过比色法和比率荧光法双通道检测Hg2+离子。
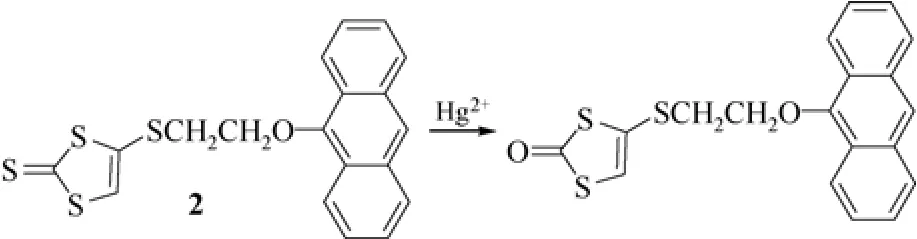
图4 硫代羰基化合物2 对汞离子的传感过程

图5 基于萘酰亚胺-硫脲的汞离子传感器
为了将上述传感器功能化并使其具有良好的水溶性,2009年,该研究组[13]将类似的反应型传感器以共价键固载到金纳米颗粒表面,得到具有传感性能的纳米金传感器5(图6)。负载在传感器5表面的功能分子可与Hg2+离子发生化学反应,使其可实现在乙腈溶液中对Hg2+的比色识别:加入Hg2+后,体系颜色由黄褐色变为黄色。而且,借助阴离子表面活性剂以改善纳米金颗粒的水溶性,并通过胶束的静电作用富集汞离子,增大其局部浓度,可大大提高传感体系在纯水中对汞离子检测的灵敏度。
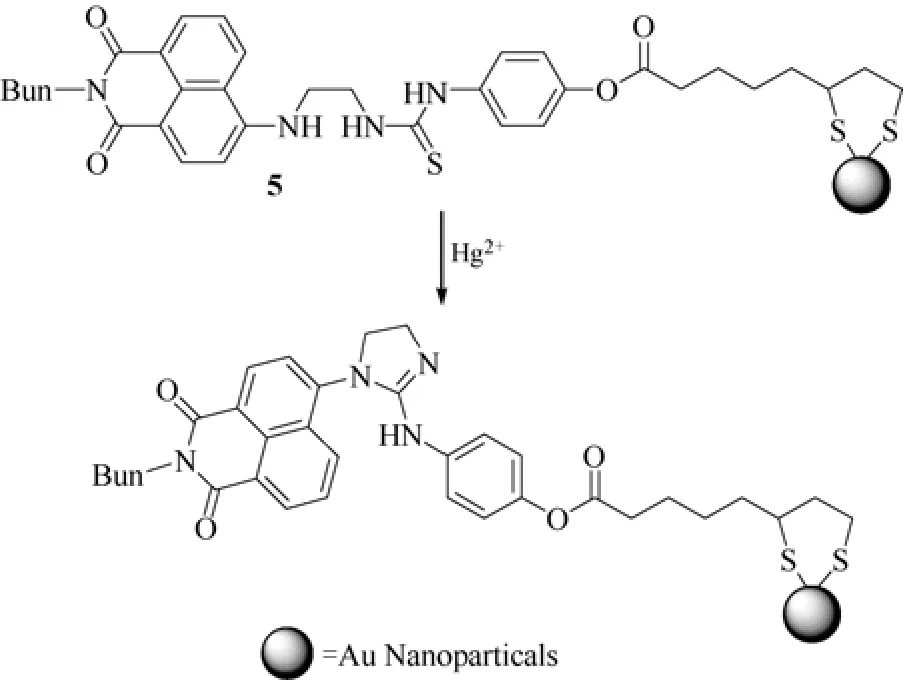
图6 基于纳米金-硫脲的汞离子传感器
Lee等[14]报道了基于奈尔蓝(Nile blue)的反应型汞离子化学传感器6。如图7所示,汞离子的加入,导致化合物6经历分子内脱硫成环过程,生成胍类衍生物7。由硫脲转变为咪唑啉基团,导致分子内电荷转移效率降低,溶液的吸收及荧光光谱均有明显蓝移,从而实现对汞离子的有效检测。紫外光谱测试表明,化合物6的吸收峰位于630nm[ε =1.9×104L/(mol·cm)]和592nm[ε =1.6×104L/(mol·cm)],溶液为蓝色。而加入汞离子之后,最大吸收峰蓝移至583nm[ε =1.2×104L/(mol·cm)]和546nm[ε =1.6×104L/(mol·cm)],溶液变为红色。荧光光谱测试表明,只有汞离子的加入能引起发射光谱的蓝移(最大发射峰由652nm蓝移至626nm),化合物6对Hg2+离子的响应远远超过对其他金属离子的响应。值得一提的是,该体系能够在100%水溶液中检测汞离子,检出限低于1.0×10−9,满足美国环境保护总署(U.S.EPA)对饮用水中汞离子含量的最低要求(2.0×10−9)。

图7 基于奈尔蓝的化合物6 对汞离子的传感过程
2.3汞诱导的脱硫醇反应
Martínez-Máñez等[15]合成了一种基于方酸染料的汞离子传感器8(图8)。硫醇作为一种光谱抑制剂(spectroscopic inhibitor),容易进攻染料分子9中环丁烯缺电子中心,生成几乎无荧光的化合物8,化合物由原来的共轭结构转变为非共轭结构,从而引起体系光学特性的变化。加入Hg2+离子之后,由于其独特的嗜硫性,可诱导化合物8发生脱硫醇反应,抑制剂除去,染料分子9被释放出来,体系荧光得以恢复,从而实现对汞离子的检测。汞离子加入之后,化合物8的溶液在642nm的吸收峰及670nm的荧光发射明显增强,对Hg2+离子的检出限低于2×10−9。通常而言,反应型传感器的传感过程是不可逆的,而化合物8具有可再生性,将其固载在聚对苯二甲酸乙二醇酯薄膜上,制得固体传感材料,可实现对Hg2+离子的循环检测。

图8 方酸化合物8 对汞离子的传感过程
2005年,Tae研究组[16]报道了基于罗丹明的化合物10(图9)。加入汞离子之前,化合物10中罗丹明以内酯螺环态存在,溶液为无色,发射很强的绿色荧光。而汞离子加入之后,诱导罗丹明螺环内酰胺发生开环,伴随着分子内脱硫成环过程,生成唑类化合物11。相应地,溶液由无色变为玫红色,由绿光变为黄光,荧光强度增强了26倍。化合物10对Hg2+离子的识别是通过二者之间1∶1的计量反应实现的,检出限为2×10−9。而且,这一传感过程可以在室温下进行,能够实现对汞离子的快速响应(响应时间小于1min)。得益于化学反应的专一性,化合物10对包括Ag+离子在内的其他金属离子均无明显响应。传感器10有良好的水溶性及生物相容性,可用于生物细胞荧光成像和动物器官内Hg2+离子的实时检测。作为第一例用于活体内Hg2+离子检测的传感器,化合物10存在不足之处:只能检测无机汞离子,而对生物组织中广泛存在且毒性更大的甲基汞(MeHg+)的响应较弱。
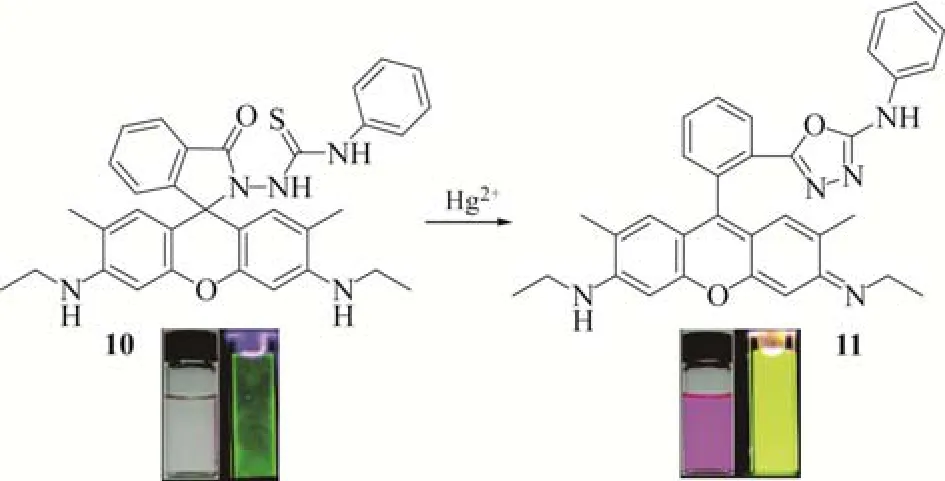
图9 基于罗丹明的化合物10 对汞离子的传感过程
2.5汞诱导的缩硫醛脱保护反应
在基础有机化学中,硫醇可与醛类化合物发生亲核加成反应,生成相应的缩硫醛化合物。该反应是平衡反应,但是平衡有利于缩硫醛的形成。当在反应体系中加入Hg2+后,由于汞与硫有很强的结合力,汞离子可与体系中极微量的硫醇反应,生成(RS)2Hg沉淀,这样就推动平衡逆向移动,又恢复为原来的醛基化合物(图10)。缩硫醛可以看成是一个较弱的给电子基团,而加入汞之后,生成的醛基则是一个拉电子基团。从缩硫醛基团到醛基,官能团推-拉电子性能的改变,必然会引起化合物分子内电荷转移效率的变化,从而引起化合物荧光性能的改变。这一反应的优势在于无需任何催化剂便能在室温下快速完成,有望实现对汞离子的快速、实时、原位检测。

图10 汞离子诱导的缩硫醛脱保护反应
2011年,Li研究组[17]以三苯基胺这一明星分子为基础,设计合成了具有简单结构的汞离子荧光传感器12。如图11所示,醛基取代的三苯基胺(TPA-CHO)的溶液发射很强的蓝光。与乙硫醇反应之后,得到的缩硫醛化合物12的荧光却很弱(量子产率仅为0.048)。这表明,从醛基转变成缩硫醛后,官能团电子特性的改变,导致其荧光性能的变化。将汞离子定量地加入化合物12的稀溶液中,随着体系中Hg2+浓度的增加,在470nm的荧光强度逐渐增强。并且随着汞离子浓度的逐渐增大,体系的荧光发射光谱越来越接近于醛基化合物的发射光谱,表明汞离子诱导缩硫醛化合物经历脱保护反应,生成原来的醛基化合物,导致体系由几乎无荧光变为很强的蓝光。红外光谱实验结果证实了上述传感机理:对于缩硫醛化合物12,在1695cm−1处没有明显的吸收峰;加入汞离子之后,在1695cm−1处出现了明显的醛基特征峰,而且与相应的醛基化合物TPA-CHO的红外图谱一致。该传感体系的优势在于结构简单,可快速、准确、低成本地分析检测汞离子,为反应型汞离子传感器的设计提供了新的思路。

图11 具有简单结构的汞离子荧光传感器
在此基础上,考虑到共轭高分子荧光传感器具有“分子导线“及信号放大等优异特性[18-22],该研究组通过后功能化的方法,将缩硫醛基团引入到高分子链上,合成了高分子传感器13(图12)[17]。荧光滴定实验表明,高分子传感器具有更高的灵敏度:随着体系中Hg2+浓度的增加,高分子13在434nm的荧光强度逐渐减弱。当体系中Hg2+浓度仅为0.6×10−6mol/L时,在434nm的荧光强度降低了12%。而且,当加入的汞离子浓度仅为10μmol/L时,凭肉眼便可看到溶液从蓝光到绿光的变化。同时,该作者考察了分子量与分散度对高分子传感器性能的影响,实验表明,分子量和分散度对高分子传感器的传感性能有一定的影响,当分子量越大、分散度越小时,分子的共轭主链越长,“分子导线”效应这一优势越显著,因此,传感器的灵敏度越高。
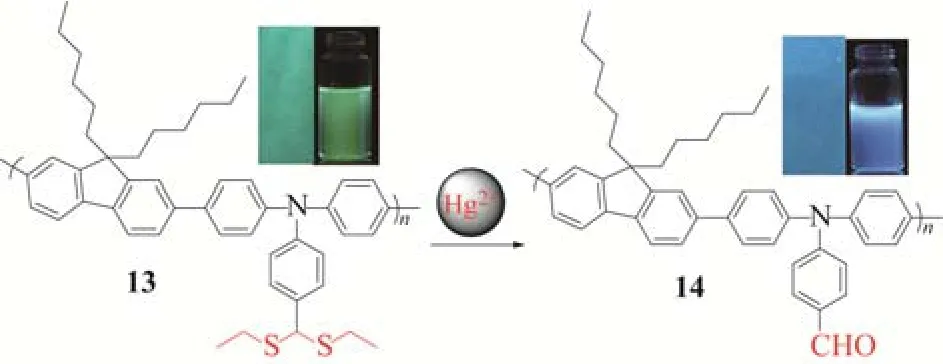
图12 基于共轭高分子的汞离子荧光传感器

图13 汞离子比率荧光传感器
比率荧光技术是荧光分析中的一项重要技术,这种方法是以荧光传感器的两个特征波长在与被分析物作用后荧光强度的比值作为定量信号,因此可有效地消除传感器自身、样品及设备等因素引起的背景误差,从而得到更准确的结果[23-27]。为了得到汞离子的比率荧光传感器,该研究组将二氧乙撑基噻吩引入到三苯胺母体上,得到了化合物15[28]。荧光滴定实验表明,随着体系中Hg2+浓度的增大,在440nm的荧光强度逐渐降低,而在525nm的荧光强度逐渐增强,表明化合物15可实现对汞离子的比率荧光检测。重要的是,利用荧光显微镜,化合物15可实现在HeLa细胞荧光成像中的应用。只在15的溶液中培养而没有加Hg2+离子,细胞的蓝光通道要比绿光强,绿光与蓝光的平均荧光强度的比值(FG/FB)为0.36;而加入汞离子之后,细胞在蓝光通道(激发波长400~410nm)的强度减弱,绿光通道(激发波长460~490nm)的强度增强,FG/FB值为6.09。这一结果与荧光滴定实验结果一致,证明传感器15可以作为比率荧光传感器,实现生物细胞内Hg2+的检测。
比色传感器最大的优势在于可以不借助任何仪器而实现方便快捷的“裸眼”检测[29-32]。在荧光传感器的基础之上,利用相同的传感机制,该课题组设计并合成了基于偶氮苯的化合物16和17[33],可作为汞离子的比色传感器,实现对汞离子的“裸眼”检测。化合物16和17均为D-π-A结构,二者的最大吸收峰都位于可见光范围内(16,λmax=455nm;17,λmax=460nm),溶液的颜色为红色。而与乙硫醇反应之后,生成的缩硫醛化合物18和19,最大吸收峰蓝移至420nm,溶液颜色变为较浅的黄色。汞离子的加入,诱导缩硫醛化合物经历脱保护反应,生成原来的醛基化合物,分子结构由D-π-D转变为D-π-A,引起分子内电荷转移(intramolecular charge transfer,ICT)效率的改变,导致溶液颜色由浅黄色变为红色,从而实现对汞离子的“裸眼”检测。将不同浓度的汞离子依次加入到19的溶液中,随着汞离子浓度的增大,溶液颜色逐渐从浅黄色变为深红色。虽然不如紫外-可见分光光度计那么灵敏,但在汞离子浓度仅为20μmol/L时,便可凭肉眼观察到溶液的颜色变化,实现对汞离子的“裸眼”检测。更重要的是,将化合物19吸附在滤纸上,制备成金属离子试纸条,无需借助任何仪器,便可实现对汞离子方便、快捷的检测。红外光谱、核磁共振氢谱及质谱都证实了该体系的传感机理:汞离子的加入,诱导缩硫醛化合物经历脱保护反应,生成相应的醛基化合物,导致体系光学性质的改变。

图14 基于偶氮苯的汞离子比色传感器
3 结语
近几年来,由于科学家的努力,反应型汞离子传感器得到了极大的发展。然而,该领域的研究工作是一个逐步发展的过程,目前还存在一些尚未解决的问题。例如,有些传感体系所利用的化学反应条件较苛刻,使其在细胞及生物体荧光成像中的应用受到限制;目前已报道的有些方法在室温下对汞离子响应速度慢,不利于实现对汞离子的快速、实时、原位检测;一些传感体系对汞离子检测的灵敏度不够高,使其实际应用受到限制。因此,需要更好地利用化学反应,探索并优化传感条件,为反应型汞离子传感器的设计与发展提供更多契机。利用反应型化学传感器,实现细胞及生物体内汞离子的荧光成像分析,实现在饮用水、食品、环境样品等实际样品中汞离子的分析检测是该领域的发展趋势所在。
参考文献
[1]舒杰明,高云玲,姚克俭,等.香豆素类荧光传感器检测金属离子的研究进展[J].化工进展,2014,33(12):3144-3156.
[2]de Silva A P,Gunaratne H Q N,Gunnlaugsson T,et al.Signaling recognition events with fluorescent sensors and switches[J].Chem.Rev.,1997,97:1515-1566.
[3]Kim J S,Quang D T.Calixarene-derived fluorescent probes[J].Chem.Rev.,2007,107:3780-3799.
[4]Kim S K,Lee S H,Lee J Y,et al.An excimer-based,binuclear,on-off switchable calix[4]crown chemosensor[J].J.Am.Chem.Soc.,2004,126:16499-16506.
[5]Matsushita M,Meijler M M,Wirsching P,et al.A blue fluorescent antibody-cofactor sensor for mercury[J].Org.Lett.,2005,7:4943-4946.
[6]Chae M Y,Czarnik AW.Fluorometric chemodosimetry.Mercury(Ⅱ)and silver(I)indication in water via enhanced fluorescence signaling[J].J.Am.Chem.Soc.,1992,114:9704-9705.
[7]Cho D G,Sessler J L.Modern reaction-based indicator systems[J].Chem.Soc.Rev.,2009,38:1647-1662.
[8]Du J,Hu M,Fan J,et al.Fluorescent chemodosimeters using“mild”chemical events for the detection of small anions and cations in biological and environmental media[J].Chem.Soc.Rev.,2012,41:4511-4535.
[9]冷冰,田禾.反应型汞离子光化学传感器[J].化学进展,2010,22(5):837-844.
[10]Jun M E,Roy B,Ahn K H.“Turn-on”fluorescent sensing with “reactive”probes[J].Chem.Commun.,2011,47:7583-7601.
[11]Zhang G,Zhang D,Yin S,et al.1,3-Dithiole-2-thione derivatives featuring an anthracene unit:New selective chemodosimeters for Hg(Ⅱ)ion[J].Chem.Commun.,2005,41:2161-2163.
[12]Liu B,Tian H.A selective fluorescent ratiometric chemodosimeter for mercury ion[J].Chem.Commun.,2005,41:3156-3158.
[13]Leng B,Zou L,Jiang J,et al.Colorimetric detection of mercuric ion(Hg2+)in aqueous media using chemodosimeter-functionalized gold nanoparticles[J].Sensors and Actuat.B,2009,140:162-169.
[14]Lee M H,Lee S W,Kim S H,et al.Nanomolar Hg(Ⅱ)detection using Nile blue chemodosimeter in biological media[J].Org.Lett.,2009,11:2101-2104.
[15]Ros-Lis J,Marcos M D,Martínez-Máñez R,et al.A regenerative chemodosimeter based on metal-induced dye formation for the highly selective and sensitive optical determination of Hg2+ions[J].Angew.Chem.,Int.Ed.,2005,44:4405-4407.
[16]Yang Y K,Yook K J,Tae J.A rhodamine-based fluorescent and colorimetric chemodosimeter for the rapid detection of Hg2+ions in aqueous media[J].J.Am.Chem.Soc.,2005,127:16760-16761.
[17]Cheng X,Li S,Zhong A,et al.New fluorescent probes for mercury(Ⅱ)with simple structure[J].Sensor and Actuat B:Chemical,2011,157:57-63.
[18]Tang Y,He F,Yu M,et al.A reversible and highly selective fluorescent sensor for mercury(Ⅱ)using poly(thiophene)s that contain thymine moieties[J].Macromol.Rapid Commun.,2006,27:389-392.
[19]Fan L,Zhang Y,Jones W E.Design and synthesis of fluorescence “turn-on”chemosensors based on photoi nduced electron transfer in conjugated polymers[J].Macromolecules,2005,38:2844-2849.
[20]Yao Z,Bai H,Li C,et al.Analyte -induced aggregation of conjugated polyelectrolytes:Role of the charged moieties and its sensing application[J].Chem.Commun.,2010,46:5094-5096.
[21]Lv F,Feng X,Tang H,et al.Development of film sensors based on conjugated polymers for copper(Ⅱ)ion detection[J].Adv.Funct.Mater.,2011,21:845-850.
[22]Lee S,Park K,Kim K,et al.Activatable imaging probes with amplified fluorescent signals[J].Chem.Commun.,2008,44:4250-4260.
[23]Chen C,Chen Y,Chen C,et al.Dipyrrole carboxamide derived selective ratiometric probes for cyanide ion[J].Org.Lett.,2006,8:5053-5056.
[24]Qian G,Li X,Wang Z.Visible and near-infrared chemosensor for colorimetric and ratiometric detection of cyanide[J].J.Mater.Chem.,2009,19:522-530.
[25]Liu Z,Wang X,Yang Z,et al.Rational design of a dual chemosensor for cyanide anion sensing based on dicyanovinyl-substituted benzofurazan[J].J.Org.Chem.,2011,76:10286-10290.
[26]Hong S J,Yoo J,Kim S H,et al.β-Vinyl substituted calix[4]pyrrole as a selective ratiometric sensor for cyanide anion[J].Chem.Commun.,2009,45:189-191.
[27]Divya K P,Sreejith S,Balakrishna B,et al.A Zn2+-specific fluorescent molecular probe for the selective detection of endogenous cyanide in biorelevant samples[J].Chem.Commun.,2010,46:6069-6071.
[28]Cheng X,Li S,Jia H,et al.Fluorescent and colorimetric probes for mercury(Ⅱ):Tunable structures of electron donor and π-conjugated bridge[J].Chem.Eur.J.,2012,18:1691-1699.
[29]Amendola V,Fabbrizzi L.Anion receptors that contain metals as structural units[J].Chem.Commun.,2009,38:513-531.
[30]Gale P A,García-Garrido S E,Garric J.Anion receptors based on organic frameworks:Highlights from 2005 and 2006[J].Chem.Soc.Rev.,2008,37:151-190.
[31]Gunnlaugsson T,Glynn M,Tocci G M,et al.Anion recognition and sensing in organic and aqueous media using luminescent and colorimetric sensors[J].Coord.Chem.Rev.,2006,250:3094-3117.
[32]Cametti M,Rissanen K.Recognition and sensing of fluoride anion[J].Chem.Commun.,2009,45:2809-2829.
[33]Cheng X,Li Q,Li C,et al.Azobenzene-based colorimetric chemosensors for rapid naked-eye detection of mercury(Ⅱ)[J].Chem.Eur.J.,2011,17:7276-7281.
综述与专论
Applications progress of desulfurization reaction in chemosensors for mercury ion
CHENG Xiaohong1,2,WANG Song1
(1Hubei Key Laboratory of Low Dimensional Optoelectronic Materials and Devices,Hubei University of Arts and Science,Xiangyang 441053,Hubei,China;2School of Physics and Electronic Engineering,Hubei University of Arts and Science,Xiangyang 441053,Hubei,China)
Abstract:Because of the thiophiolic property of mercury ions,desulfurization reactions have been widely used in the design of reactive sensors for mercury ions and provide us methods of investigating mercury ions with superior selectivity.This review mainly focused on the applications of desulfurization reactions in the design of chemosensers for mercury ions,including the Hg2+-promoted desulfurization reactions of thiocarbonyl compounds,derivatives of thiourea,squaraine-based compounds,thiosemicarbazide compounds,as well as the Hg2+-promoted deprotection of dithioacetals.Several obstacles in this field include harsh reaction conditions for some chemical reactions in the design of sensors of mercury ions,slow reaction rate of some chemical reactions at room temperature;low sensitivity of some sensor systems.Therefore,optimization of the sensing conditions is needed in order to provide more opportunities in the development of reactive sensors for mercury ions.
Key words:organic compounds;sensors;selectivity;chemical reaction;mercury
基金项目:国家自然科学基金项目(21401053)、湖北文理学院博士科研基金项目及低维光电材料与器件湖北省重点实验室开放课题项目(HLOM 142012)。
收稿日期:2015-01-06;修改稿日期:2015-03-17。
DOI:10.16085/j.issn.1000-6613.2015.08.03
文章编号:1000–6613(2015)08–2925–07
文献标志码:A
中图分类号:O 622.4
