MPN—PCR法定量检测武汉鸡肉制品中的空肠弯曲菌
2015-11-12韩梅董俊邵华斌等
韩梅+董俊+邵华斌+等
摘要:空肠弯曲菌(Campylobacter jejuni)是引起人类细菌性腹泻的主要人畜共患病原菌之一,严重时可导致人类格林-巴利综合征。其中鸡肉污染导致的食源性传播是人类感染的重要原因。为了调查武汉市鸡肉制品的空肠弯曲菌污染情况,运用最可能数法(MPN)及聚合酶链式反应(PCR)技术结合,即MPN-PCR方法,对市场采集的128份鸡肉样品进行了空肠弯曲菌的定量检测,结果阳性检出率为18.75%,其中鲜鸡肉检出率为28.26%,冻鸡肉检出率为13.41%,含菌量范围为3.6~92.0 MPN/g。
关键词:空肠弯曲菌(Campylobacter jejuni);MPN-PCR法;定量检测
中图分类号:TS207.4 文献标识码:A 文章编号:0439-8114(2015)20-5084-03
DOI:10.14088/j.cnki.issn0439-8114.2015.20.040
Quantitative Detection of Campylobacter jejuni in Chicken Products
by MPN-PCR in Wuhan
HAN Mei1,2,DONG Jun1,SHAO Hua-bin1,LUO Ling1,LUO Qing-ping1,PAN Ling2,ZHANG Teng-fei1
(1. Institute of Animal Husbandry and Veterinary/Hubei Key Laboratory of Animal Embryo Engineering and Molecular Breeding, Hubei Academy of Agricultural Sciences,Wuhan 430064,China;2.College of Animal Science and Technology,Anhui Agricultural University,Hefei 230036,China)
Abstract: Campylobacter jejuni was one of the most common zoonosis pathogen which caused human bacterial diarrhea, and could lead to Guillian-barre syndrome in severe cases. Human being infected with C. jejuni was most from foodborne transmission caused by chicken products contamination. In order to investigate the contamination of C. jejuni in chicken products in Wuhan,128 chicken products were collected from the markets in Wuhan and detected by most probable number (MPN) method combined with Polymerase chain reaction (PCR).The results showed that the positive rate of C. jejuni was 18.75%, in which the positive rate in fresh chicken and frozen chicken was 28.26%, and 13.41%,respectively.The content of C. jejuni was from 3.6 to 92.0 MPN/g.
Key words: Campylobacter jejuni ; MPN-PCR; quantitative detection
空肠弯曲菌(Campylobacter jejuni)是近年来影响动物源性食品安全的主要人畜共患病原菌之一,是引起全世界人类细菌性腹泻的主要食源性致病菌,与沙门氏菌(Salmonella)、志贺氏菌(Shigella castellani)并列为人类三大腹泻致病菌,严重者可导致心内膜炎、关节炎、败血症等,还与格林-巴利综合征密切相关。该菌广泛存在于家禽肠道中,并通过污染肉品、食物或水源导致人类感染[1-3]。鉴于空肠弯曲菌对食品安全和公众健康造成严重的威胁,控制食品中空肠弯曲菌的污染并加强食品中空肠弯曲菌的监测具有重要意义。
常规PCR、荧光定量PCR等检测技术只能对反应体系中模板DNA进行定量,无法鉴别与区分污染食品中的细菌为死菌还是活菌。MPN法(Most probable number,最可能数法)采用多管发酵法,通过概率计算,测定样品中含有细菌的最可能数,该方法已用于食品病原菌及工农业微生物的定量检测[4,5]。本研究利用空肠弯曲菌的特异性引物进行PCR扩增,结合MPN法,对市场上的鸡肉进行了空肠弯曲菌的快速定量检测,为调查鸡肉中空肠弯曲菌的带菌状况提供了科学数据。
1 材料与方法
1.1 菌株
空肠弯曲菌(Campylobacter jejuni ATCC 33291)标准菌株购自中国微生物菌种保藏中心,该菌分离自人的粪便。
1.2 试剂与仪器
2 000 bp DNA Marker、小量细菌DNA提取试剂盒均购自宝生物工程(大连)有限公司。2×Es Taq MasterMix购自北京康为世纪生物科技有限公司。Bolton肉汤(GB标准)、Bolton肉汤添加剂、布氏肉汤培养基均购自青岛高科园海博生物技术有限公司。脱纤维无菌裂解马血购自广州蕊特生物科技有限公司。厌氧培养罐和微需氧产气袋均购自OXOID公司。超细匀浆器(型号:F6/10-8G)购自上海弗鲁克公司。endprint
1.3 试验方法
1.3.1 引物设计与合成 本试验参考Linton等[6]的方法设计并合成了特异性扩增空肠弯曲菌特有的马尿酸酶hipO基因的引物,扩增片段长度为735 bp。引物由生工生物工程(上海)股份有限公司合成,引物序列如下:HIP400F:5′-GAAGAGGGTTTGG
GTGGTG-3′,HIP1134R:5′-AGCTAGCTTCGCATAA
TAACTTG-3′。
1.3.2 样品采集 按照食品样品的采样方法从湖北省武汉市超市与生鲜市场分次采集鸡肉样品128份,其中新鲜鸡肉46份,冻鸡肉82份。用保鲜袋包好采集的样品于冰盒中运送到实验室检验。
1.3.3 样品处理及增菌培养 将采集的肉样剪碎,并称取约10 g放入200 mL的无菌烧杯中,加入90 mL布氏肉汤,用超细匀浆器进行匀浆,获得匀浆液,将其以5个连续稀释度进行10倍系列稀释。取1 mL稀释液加入9 mL Bolton肉汤增菌液中,每个稀释度接种3管,42 ℃微需氧环境下增菌培养48 h。
1.3.4 模板制备及PCR扩增 取2 mL上述增菌培养的样品,12 000 r/min 离心5 min,弃上清液,用50 μL 灭菌水重新悬浮沉淀,置于100 ℃水浴中煮沸5 min,冰浴5 min,12 000 r/min 离心5 min,取上清液作为PCR模板。
PCR扩增反应总体积为25 μL,包括:2×Es Taq MasterMix 10 μL(包括Es Taq DNA Polymerase, 2×Es Taq PCR Buffer,3 mmol/L MgCl2, 400 μmol/L dNTP mix),DNA模板5 μL,上下游引物各1 μL,灭菌去离子水8 μL 。PCR扩增条件为:94 ℃预变性5 min,94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸1 min,30个循环;72 ℃ 延伸10 min。配制1%琼脂糖凝胶,取8 μL PCR产物加样,120 V电压电泳30 min,凝胶成像系统拍照、分析试验结果。
如果在735 bp处出现特异性条带,即可判断样品中含有空肠弯曲菌。按照刘淑艳等[7]研究的MPN法稀释度选择原则,选择3个连续稀释度,查最可能数表[8],根据空肠弯曲菌出现的阳性管数情况,计算空肠弯曲菌的含量。
2 结果与分析
2.1 MPN-PCR法检测空肠弯曲菌的灵敏性
将浓度为1.4×108 CFU/mL 的空肠弯曲菌菌液进行10倍倍比稀释,每个梯度3个平行,42 ℃微需氧条件增菌培养后,提取模板DNA进行PCR扩增,并根据最终出现的阳性管数查MPN表,结果最低检测限为3.6 MPN/g。而直接对倍比稀释的样品进行PCR扩增,无法检测到该浓度的细菌,说明该方法相比直接进行PCR检测显著提高了检测灵敏度。MPN-PCR法整个检测过程包括样品处理、增菌培养、模板制备、PCR扩增,实现了对空肠弯曲菌的快速定量检测。
2.2 鸡肉中空肠弯曲菌的检测
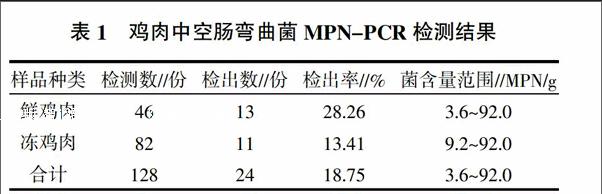
本研究运用MPN-PCR法对部分市场128份鸡肉样品进行定量检测,结果(表1)表明鸡肉中空肠弯曲菌的污染率为18.75%,其中鲜鸡肉和冻鸡肉均有不同程度的污染,阳性检出率分别为28.26%和13.41%。
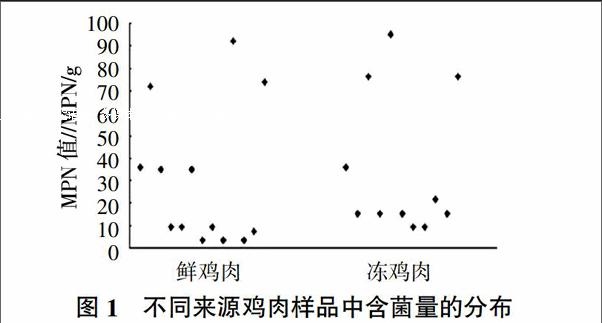
根据检测样品的PCR阳性管数,查阅MPN值表,获得鲜鸡肉与冻鸡肉空肠弯曲菌阳性样品的菌含量范围分别为3.6~92.0 MPN/g和9.2~92.0 MPN/g,其含菌量分布见图1,显示鲜鸡肉与冻鸡肉的含菌量主要集中在3.6~20.0 MPN/g范围内,其中部分样品含菌量高达92.0 MPN/g。
3 小结与讨论
空肠弯曲菌是引起急性腹泻的主要病原菌,近年来弯曲菌肠炎在人群肠道感染中所占的比例不断上升,空肠弯曲菌已成为发达国家最主要的腹泻病原菌之一[9]。欧盟以及很多国家明确规定出口到该地区的禽肉制品中不得检出空肠弯曲菌。本次检测武汉市鸡肉样品共检出24份空肠弯曲菌污染的鸡肉,检出率达18.75%,含菌量范围在3.6~92.0 MPN/g。表明武汉市禽肉制品中存在较为严重的空肠弯曲菌污染,还需加强对在售食品中空肠弯曲菌的监测及控制,也提示人们一定要注意食品卫生,食用加热彻底的熟食。
此次检测的128份鸡肉样品中,鲜鸡肉的检出率为28.26%,冻鸡肉的检出率为13.41%,鲜鸡肉的阳性率高于冻鸡肉,与文献[1,10,11]报道中两类鸡肉样品检测结果一致,可能是由于新鲜鸡肉在屠宰、加工、销售等过程中的交叉污染,致使新鲜鸡肉带菌增加。冻鸡肉中也可检出空肠弯曲菌,可能目的菌在冻鸡肉上处于“活的但非可培养状态”(Viable but non-culturable state,VBNC)。有大量报道指出许多细菌可以逃避正规的检测标准,进入VBNC状态,其本身丧失了生长及繁殖的能力,无法用常规培养方法检测,但其仍然具有代谢活性,在DNA合成抑制剂的作用下,添加一定量的营养物培养时,在一定条件下可以复苏,并具有与正常状态下原菌相似的致病能力[12,13]。食源性病原菌一旦进入VBNC状态,常常会造成漏检,从而引起严重的公共卫生危机。因此生禽肉类加工销售企业自身必须建立内部卫生质量保证体系,并配合检验检疫部门的卫生检验及监督,以保证生禽肉制品的生产销售安全。
对空肠弯曲菌采用生化试验的方法进行鉴定步骤繁琐,采用平板计数方法进行定量检测误差较大,且容易漏检VBNC状态的细菌,采用MPN-PCR法对空肠弯曲菌进行定量检测简单易行,是一种非常有效的方法。
参考文献:
[1] 骆海朋,陈 倩.应用PCR方法对生鸡肉中分离到的空肠弯曲菌进行鉴定[J].中国卫生检验杂志,2008,18(2):297-298.endprint
[2] 史艳宇,刘金华,薛力刚,等.PCR-ELISA法检测食品中空肠弯曲菌[J]. 食品科学, 2013, 34(10):246-249.
[3] 王君玮,王 娟,曲志娜,等.空肠弯曲菌对动物源性食品安全的影响及对策[J].中国人兽共患病学报,2013,29(11):1119-1123.
[4] SEI K,INOUE D, WADA K, et al. Monitoring behavior of catabolic genes and change of microbial conmmity stluetures in seawater microcosms during aromatic compound degradation[J].Water Res,2004,38(20):4405-4414.
[5] YU Z,MOHN W W. Bioaugmentation with resin-acid-degrading bacteria enhances resin acid removal in sequencing batch reactors treating pulp mill effluents[J]. Water Res,2001,35(4):883-890.
[6] LINTON D, LAWSON A J, OWEN R J, et al.PCR detection, identification to species level, and fingerprinting of Campylobacter jejuni and Campylobacter coli direct from diarrheic samples[J]. Journal of Clinical Microbiology, 1997,35(10):2568-2572.
[7] 刘淑艳,马慧蕊,蒋 丹,等.最可能数的精确计算及其在食品微生物检验中的应用[J].中国卫生统计,2011,28(5):516-519.
[8] 中国人民共和国卫生部,中国国家标准化管理委员会.GB 4789.3-2010 食品安全国家标准 食品微生物学检验 大肠菌群计数[S].
[9] OzFoodNet Working Group.Burden and causes of food-borne disease in Australia,Annual report of the OzFoodNet network,2005[J].Commun Dis Intell,2006,30(3):278-300.
[10] 乔 昕,袁宝君,吴高林.南京市2006年鸡肉产品中空肠弯曲菌污染状况调查[J].江苏预防医学,2007,18(2):37-38.
[11] 陈尚林,李 娜,葛 莉,等.宿迁市肉鸡沙门菌和空肠弯曲菌污染状况调查[J].江苏预防医学,2014,25(1):75-76.
[12] 潘 乐,孟庆峰,钱爱东,等.VBNC状态细菌检测方法的研究进展[J].中国农学通报,2012,28(5):32-35.
[13] 郑桂丽,廖绍安,翟俊辉,等.环境中“活的非可培养(VBNC)”细菌的研究进展[J].2004,32(4):58-66.endprint
