蜡样芽胞杆菌蛋白酶的克隆及在枯草芽胞杆菌系统中的高效表达
2015-11-11承龙飞,朱富成,刘可可等
蜡样芽胞杆菌蛋白酶的克隆及在枯草芽胞杆菌系统中的高效表达
承龙飞,朱富成,刘可可,何冰芳
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
基于来源于Bacillus cereus WQ9-2的耐有机溶剂蛋白酶WQ的液相色谱-双质谱(LC-MS-MS)分析结果,设计引物,克隆耐有机溶剂蛋白酶WQ的基因,测序分析表明该蛋白酶的开放阅读框(ORF)大小为1 701 bp,编码566个氨基酸,其中含有信号肽(28个氨基酸)、前肽(220个氨基酸)及成熟肽序列(含954 bp编码318个氨基酸),相对分子质量约为3.7×104。将不带自身信号肽的蛋白酶基因aprWQ插入穿梭质粒pMA5中,构建了表达载体pMA5/aprWQ。该表达载体导入枯草芽胞杆菌WB600中获得阳性重组子WB600-pMA5/aprWQ,通过优化培养基成分以及培养条件,重组子发酵产蛋白酶体积酶活达到17 400 U/mL,约为高产野生菌产酶量的5倍。重组蛋白酶在多种有机溶剂(体积分数为50%)中表现出了良好的耐受性,验证了重组菌表达的蛋白酶与来源于B.cereus WQ9-2的耐有机溶剂蛋白酶性质一致,该耐有机溶剂蛋白酶的高效表达为进一步发挥其高效生物催化作用等实际应用奠定了基础。
耐有机溶剂蛋白酶;枯草芽胞杆菌;高表达;发酵优化
蛋白酶广泛应用于食品、制药、纺织等领域,在世界酶类销售市场中占有主要地位[1-2]。蛋白酶为典型的水解酶,通常在水相中催化肽链水解反应,而在非水相中,往往其逆反应占主导地位,能够催化肽链的合成[3-4]。利用蛋白酶进行有机相催化反应有诸多优势:使水解反应的热力学平衡转向合成反应,抑制不良反应的进行,提高底物溶解度和改变底物特异性等。然而,大多数蛋白酶在高浓度亲水性有机溶剂中易于失活、酶活力低、稳定性差,限制了蛋白酶在有机相催化中的应用[5-6]。耐有机溶剂蛋白酶能耐受高浓度的亲水性有机溶剂,可应用于催化肽合成以及手性药物拆分等反应[7]。
近年来,耐有机溶剂蛋白酶不断地被发现和开发,多数耐有机溶剂蛋白酶来自于极端微生物,并且以 Pseudomonas属和 Bacillus属细菌居多[8-13]。然而大多数的极端微生物产酶能力弱,限制了这类高性能的耐有机溶剂蛋白酶的使用。为了进一步开发并拓宽这类酶的应用,基因工程的方法是一种有效的手段。Ogino等[14]筛选到了1株耐有机溶剂蛋白酶产生菌Pseudomonas aeruginosa PST-01,并在大肠杆菌宿主中对PST-01蛋白酶进行了克隆表达,但表达的酶产量较低,限制了进一步应用。
笔者所在课题组在前期研究中筛选到1株产耐有机溶剂蛋白酶菌株Bacillus cereus WQ9-2[15],该菌所产耐有机溶剂蛋白酶对广泛Log P值的亲水性以及疏水性有机溶剂具有很好的耐受性,该酶在有机相中能有效催化内吗啡肽-1[16]、内吗啡肽-2[17]以及水凝胶[18]等产物的合成。尽管野生型菌株所产蛋白酶产量已达到3 500 U/mL,但仍然难以满足后续开发应用的需求,因此,笔者进一步研究耐有机溶剂蛋白酶WQ的克隆及表达,以期通过优化提高耐有机溶剂蛋白酶的产量,使其更有利于实际应用与开发。
1 材料与方法
1.1 菌株与质粒
耐有机溶剂蛋白酶产生菌为 Bacillus cereus WQ9-2,由笔者所在课题组分离筛选并寄存于中国典型菌种保藏中心(保藏登记号为 CCTCC No.M2010010)。克隆宿主Escherichi coli DH5α保存于笔者所在实验室,穿梭载体pMA5以及枯草芽胞杆菌宿主 WB600由江南大学周哲敏教授惠赠[19]。
1.2 实验材料
1.2.1 培养基
LB培养基[20](g/L):蛋白胨 10、酵母粉 5、NaCl 10。
LB牛奶平板培养基:LB培养基中添加质量分数1%的脱脂奶粉以及1.5%的琼脂粉,脱脂奶粉混悬液分开灭菌后,按照比例混合。
Superrich改善培养基[21](g/L):酵母粉20、胰蛋白胨25、KH2PO43、MnSO40.1、酪蛋白水解物10、葡萄糖30。
培养基均在121℃灭菌20min,1%脱脂奶粉溶液在115℃下灭菌20min。
1.2.2 试剂以及工具酶
有机溶剂购买于国药集团药业股份有限公司;DNA Marker、pfu DNA聚合酶、限制性内切酶SalⅠ、BamHⅠ、T4 DNA连接酶、质粒提取试剂盒、胶回收试剂盒购于宝生物工程有限公司(TaKaRa);PCR引物由上海英骏生物技术有限公司合成;其余试剂和药品均为进口或国产分析纯。
1.3 蛋白酶基因的克隆和表达载体 pMA5/ aprWQ的构建
Bacillus cereus WQ9-2所产蛋白酶分离纯化后,经SDS-PAGE分析,切下所示蛋白条带送至国家医学分析中心进行氨基酸测序,并进行液相色谱-双质谱(LC-MS-MS)分析,通过序列比对,参考相似度最高的蛋白酶的氨基酸序列设计扩增引物,并经过测序确定了该蛋白酶的基因aprWQ的序列[22]。
笔者采用载体pMA5自带信号肽序列,因此去除蛋白酶基因自带信号肽,表达引物分别引入SalI和BamHI酶切位点(下划线部分):F:5′-GGGGTCGACTCTAAAAATGTTCTCTCT-3′;R:5′-GGGGGGATCCTTAGTTTATACCAACA-3′。克隆产物aprWQ基因经两酶切割后插入相同酶切的载体pMA5中,经 T4连接酶连接后得到表达载体pMA5/aprWQ。最后,重组质粒pMA5/aprWQ经双酶切验证阳性克隆。
1.4 重组菌WB600-pMA5/aprWQ的构建
将重组质粒pMA5/aprWQ导入枯草芽胞杆菌WB600感受态中,涂布于含50 μg/mL的卡那霉素LB牛奶平板培养基,挑取周边有显著透明圈的转化子,提取质粒 pMA5/aprWQ送至公司进行测序验证。
1.5 蛋白酶WQ在重组菌中的表达以及表达条件的优化
将重组菌与含空质粒pMA5的WB600菌株接入含50 μg/mL的卡那霉素的LB培养基中,在37℃、180r/min条件下过夜培养。以2%的接种量接入50mL含50 μg/mL的卡那霉素的Superrich改善培养基中,于37℃、180r/min条件下培养,每24 h取样1次测蛋白酶酶活以及菌体生物量(OD660)。为了进一步提高重组菌的产酶能力,考察培养基的不同初始pH、培养温度以及培养基成分对表达酶活的影响。
1)蛋白酶活力测定 参照文献[23]方法。酶活定义:在40℃、pH8.0条件下,每分钟催化酪蛋白底物水解产生1 μg酪氨酸所需要的酶量为1个酶活单位,即1 U。
2)相对酶活 在发酵优化过程中,以相同因素下每次发酵最高的酶活力为100%,其他发酵情况下酶活与最高酶活的比例。
1.6 蛋白酶有机溶剂耐受性的检测
将酶液加入到等体积的有机溶剂中,亲水性有机溶剂选取二甲基亚砜(DMSO)、二甲基甲酰胺(DMF)和乙醇等,疏水性有机溶剂选取环己烷、甲苯等,对照组为无菌水,在37℃、180r/min条件下振荡24 h后,检测蛋白酶的残余活力。
2 结果与讨论
2.1 目的蛋白酶基因的克隆
蛋白酶WQ9-2经水解后的多肽片段经LC/ MS/MS分析获得部分氨基酸序列,通过序列比对,发现蛋白酶WQ9-2与Bacillus cereus分泌的中性蛋白酶(gi|76364030)的氨基酸序列具有最高的相似性,叠合片段为SLNTTLSGSSYYLQDNTRGATIFTYDAK,NSINGAGAPLK,PDWEIGEDIYTPGK。
根据该中性蛋白酶基因序列进行扩增引物的设计,以本研究自行筛选的蜡样芽胞杆菌WQ9-2的基因组为模板,对蛋白酶基因aprWQ进行扩增,经测序表明扩增产物编码基因开放阅读框(ORF)为1 701 bp,包含信号肽、前肽序列及成熟肽3部分,编码566个氨基酸,其中含有信号肽(28个氨基酸)、前肽(220个氨基酸)及成熟肽序列(含954 bp编码318个氨基酸),相对分子质量约为3.7×104,将该序列提交GenBank进行BLAST分析,发现其与蜡样芽胞杆菌Bacillus cereus ATCC14579的芽胞菌粘素基因同源性为92%。
2.2 表达载体及重组菌WB600-pMA5/aprWQ的构建结果
企业外宣从本质上来讲属于传播行为,因而企业外宣文本的翻译问题可以纳入传播学的范畴内展开研究。本文从传播学理论出发,探讨企业外宣翻译如何确保信息传播的信度和效度。从传播学的视角看,企业外宣翻译应该有所为,亦应当有所不为。有所为是指,在文本处理中,尤其是在词汇和句式的选择上,采用归化策略,尽可能照顾西方受众的思维特点和阅读习惯。有所不为是指,在文化层面不要求全然反映源语的文化元素,而应该努力避免文化误读,尽可能地实现信息的传递,达到预期的传播效果。总而言之,企业外宣翻译应确保语言的动态对等,追求不同文化间的审美共鸣和心理认同。
去除蛋白酶WQ自带信号肽,设计分别带有Sal I和BamH I酶切位点的引物,扩增产物经双酶切后插入到载体pMA5中得到pMA5/aprWQ重组质粒,其构建图见图1。重组质粒导入枯草芽胞杆菌WB600中得到重组菌WB600-pMA5/aprWQ,重组子培养24 h后菌落周围有明显的透明圈,表明重组子有较高的蛋白酶活力。
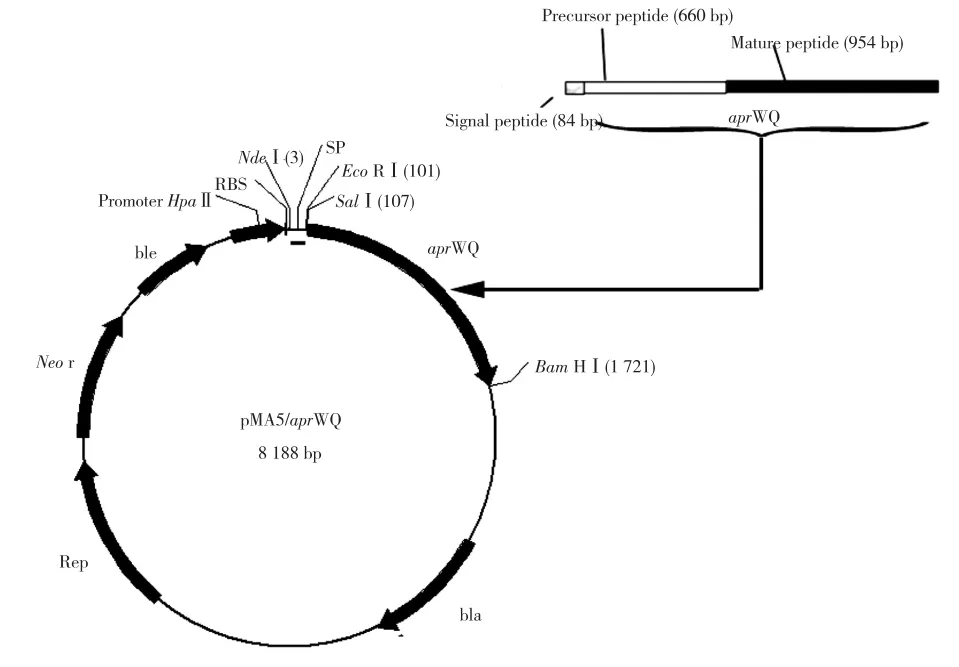
图1 重组质粒pMA5/aprWQ的物理图谱Fig.1 Physical map of recombinant plasmid pMA5/aprWQ
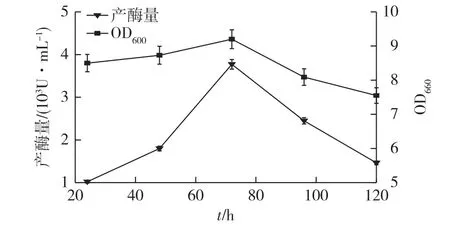
图2 重组菌的生长与产酶曲线Fig.2 Cell growth curves and protease production of recombinant strain
2.3 蛋白酶WQ基因表达以及表达条件优化
重组菌WB600-pMA5/aprWQ发酵上清液蛋白酶活力以及菌体生长曲线见图2。由图2可知:对照组重组菌WB600-pMA5发酵后未检测到蛋白酶酶活,重组菌WB600-pMA5/aprWQ在发酵72 h时酶活达到3 772 U/mL,已经超过了野生型蜡样芽胞杆菌WQ9-2的产酶水平(3 500 U/mL)[15]。这表明该菌在大量表达蛋白酶后菌体量迅速下降,推测有溶融现象,重组菌的菌体生物量较低,表明有较大的优化提升空间。
2.3.1 发酵碳源对重组菌产酶的影响
在Superrich改善培养基中,葡萄糖质量浓度为30g/L,占碳源比例较大,且葡萄糖代谢较易产酸。因此,考察不同碳源(蔗糖、甘油、糊精、玉米粉)替代葡萄糖对发酵产酶的影响,结果见图3。由图3可知:使用玉米粉作为碳源时显著促进菌体生长与产酶,菌体生长旺盛,菌体生物量最高,此时菌体生物量约为以葡萄糖(对照)为碳源条件下的2.1倍,且酶活为对照的3.5倍。因此,选择玉米粉作为碳源进行后续优化。
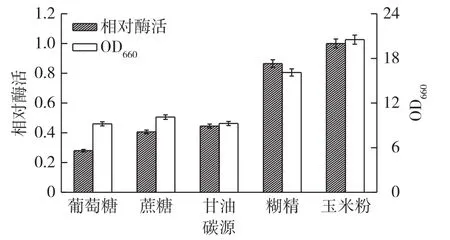
图3 碳源对重组菌产酶的影响Fig.3 Effects of carbon sources on protease production of recombinant strain
2.3.2 发酵氮源对重组菌发酵产酶的影响
氮源是发酵产酶的关键因素,在Superrich改善培养基中,氮源加入量为10g/L,其中氮源酪蛋白水解物成本较高,考察不同氮源(棉酚蛋白、豆粕粉、豆饼粉和尿素)替代酪蛋白水解物对发酵产酶的影响,结果见图4。由图4可知:添加酪蛋白水解物时重组菌的产酶量最高,豆粕粉、豆饼粉和棉酚蛋白均有促进菌体生长的作用,但发酵液中酶产量较低。尿素作为无机氮源替代氮源时,菌体生长较差,但是产酶效果与酪蛋白水解物相近,考虑到生产成本原因,选用无机氮源尿素替代酪蛋白水解物进行发酵产酶。

图4 氮源对重组菌产酶的影响Fig.4 Effects of nitrogen sources on protease production of recombinant strain
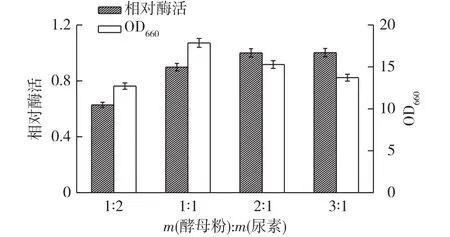
图5 氮源比例对重组菌产酶的影响Fig.5 Effects of the proportion of nitrogen sources on protease production of recombinant strain
2.3.3 发酵温度及培养基初始pH对重组菌发酵产酶的影响
图6为发酵温度对重组菌发酵产酶的影响结果。由图6可知:重组菌在30℃下利于菌体生长,但酶活较低;而在发酵温度37℃下,重组菌发酵后产酶效果较好。因此,选用37℃作为培养条件进行后续优化。
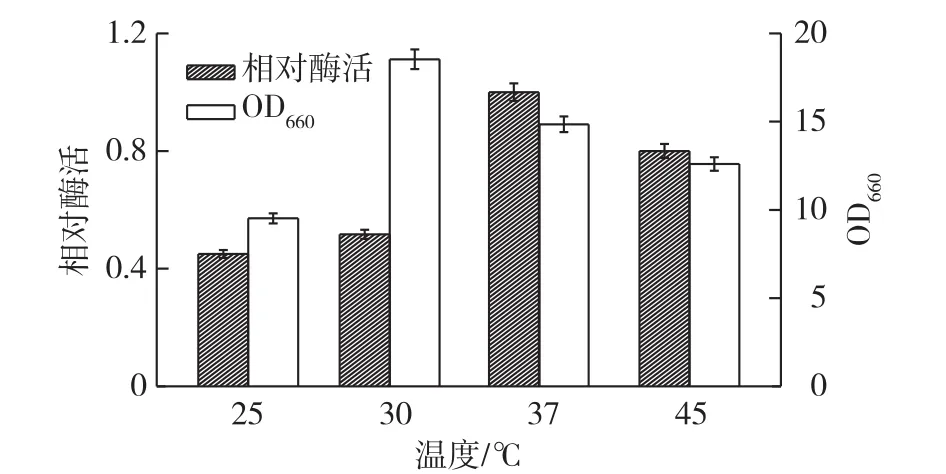
图6 温度对重组菌产酶的影响Fig.6 Effects of temperatures on protease production of recombinant strain
图7是培养基初始pH对重组菌发酵产酶的影响结果。由图7可知:该重组菌在pH 8.0时有利于菌体生长,而在初始pH 7.0、7.5、8.0及8.5条件下对重组菌的发酵产酶均较适宜,该培养基初始pH为7.4,因此可以采用不调节 pH直接进行发酵培养。
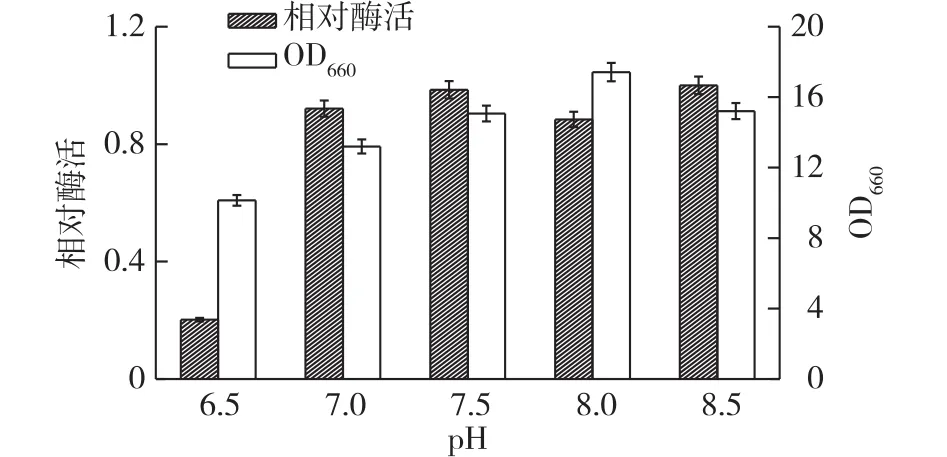
图7 初始pH对重组菌产酶的影响Fig.7 Effects of medium initial pH on protease production of recombinant strain
2.4 优化后重组菌的发酵产酶曲线
优化后重组菌WB600-pMA5/aprWQ的产酶曲线见图8。由图8可知:重组菌发酵24 h内开始产酶,到72 h时菌体快速生长且达到最高产酶量17 400 U/mL,约为Bacillus cereus WQ9-2菌产酶量的5倍。与优化前比较,产酶量显著增加,为实现该酶的扩大化应用生产奠定了基础。

图8 重组菌在优化培养基中生长曲线Fig.8 Growth curves and protease production of recombinant strain in optimized medium
2.5 重组菌表达产物有机溶剂耐受性及 SDSPAGE分析
2.5.1 表达蛋白酶的有机溶剂耐受性
重组蛋白酶在有机溶剂中(体积分数50%)的耐受性见表1。由表1可知:该重组蛋白酶在有机溶剂中显示了很好的耐受性,亲水性有机溶剂DMSO、甘油以及疏水性有机溶剂正辛烷、环己烷、己烷、甲苯对该酶有促进作用,在上述有机溶剂中放置24 h后显示了一定程度的激活现象,而亲水性有机溶剂DMF和乙醇对该酶有一定的影响,重组菌表达的蛋白酶与野生菌产生的蛋白酶的溶剂耐受性基本一致,其微量差异可能是溶剂体系中蛋白酶的含量差异所致。

表1 表达蛋白酶WQ的有机溶剂耐受性Table 1 Tolerance in organic solvent of recombinant protease WQ

图9 发酵上清的SDS-PAGE电泳图谱Fig.9 SDS-PAGE analysis of recombinant strain
2.5.2 SDS-PAGE分析
取重组菌WB600-pMA5/aprWQ以及含空质粒的WB600-pMA5(对照)的发酵上清液进行SDS-PAGE蛋白电泳,结果见图9。由图9可知:重组菌WB600-pMA5/aprWQ发酵上清酶液在3.7× 104处有1条明显的条带,发酵酶液的条带位置与前期研究中Bacillus cereus WQ9-2所分泌蛋白酶的相对分子质量一致,说明重组酶与野生酶成熟肽的大小一致,并且重组菌在表达过程中自行剪切前肽成为成熟的蛋白酶WQ,而对照组在3.7×104处没有相应条带。以上分析进一步验证了重组菌高效表达的蛋白酶,即为目标蛋白酶WQ。
3 结论
克隆了Bacillus cereus WQ9-2的耐有机溶剂蛋白酶基因aprWQ,构建了表达载体pMA5/aprWQ并在枯草芽胞杆菌WB600中实现了分泌表达,通过对重组菌WB600-pMA5/aprWQ表达条件的优化调整了Superrich培养基中碳氮源及培养条件,在37℃下重组菌发酵产酶量最高可达17 400 U/mL,约为野生菌产酶的5倍,表明达到了高效分泌表达。有机溶剂耐受性实验表明蛋白酶WQ在亲水性以及疏水性有机溶剂中均有良好的耐受性,与本实验室前期研究的野生型蛋白酶WQ耐受性基本一致。该耐有机溶剂蛋白酶的高效表达为进一步发挥其高效生物催化作用等实际应用奠定了基础。
[1]Anwar A,Saleemuddin M.Alkaline proteases:a review[J]. Bioresour Technol,1988,64(3):175-183.
[2]Gupta R,Beg Q K,Lorenz P.Bacterial alkaline proteases:molecular approaches and industrial applications[J].Appl Microbiol Biotechnol,2002,59(1):15-32.
[3]Gupta A,Khare S K.A protease stable in organic solvents from solvent tolerant strain of Pseudomonas aeruginosa[J].Bioresour Technol,2006,97(15):1788-1793.
[4]Kumar D,Bhalla T C.Microbial protease in peptide synthesis:approaches and applications[J].Appl Microbiol Biotechnol,2005,68(6):726-736.
[5]Ogino H,Ishikawa H L.Enzymes which are stable in the presence of organic solvents[J].J Biosci Bioeng,2001,91(2):109-116.
[6]Gupta M N,Roy I.Enzymes in organic media:forms,functions and applications[J].Eur J Biochem,2004,271(13):2575-2583.
[7]Bordusa F.Proteases in organic synthesis[J].Chem Rev,2002,102(12):4817-4868.
[8]Ikura Y,Yoshida Y,Kudo T.Physiological properties of two Pseudomonas mendocina strains which assimilate styrene in a twophase(solvent-aqueous)system under static culture conditions[J].J Ferment Bioeng,1997,83(6):604-607.
[9]Ogino H,Watanabe F,Yamada M,et al.Purification and characterization of organic solvent-stable protease from organic solvent-tolerant Pseudomonas aeruginosa PST-01[J].J Biosci Bioeng,1999,87(1):61-68.
[10]Bustard M T,Whiting S,Cowan D A,et al.Biodegradation of high concentration isopropanol by a solvent-tolerant thermophile,Bacillus pallidus[J].Extremophiles,2002,6(4):319-323.
[11]Sareen R,Mishra P.Purification and characterization of organic solvent stable protease from Bacillus licheniformis RSP-09-37[J]. Appl Microbiol Biotechnol,2008,79(3):399-405.
[12]Rahman R,Mahamad S,Salleh A B,et al.A new organic solvent tolerant protease from Bacillus pumilus 115b[J].J Ind Microbiol Biotechnol,2007,34(7):509-517.
[13]Ghorbel B,Sellami-Kamoun A,Nasri M.Stability studies of protease from Bacillus cereus BG1[J].Enzyme Microb Technol,2003:32(5):513-518.
[14]Ogino H,Yokoo J,Watanabe F,et al.Cloning and sequencing of a gene of organic solvent-stable protease secreted from Pseudomonas aeruginosa PST-01 and its expression in Escherichia coli[J]. Biochem Eng J,2000,5(3):191-200.
[15]Xu J X,Jiang M,Sun H L,et al.An organic solvent-stable protease from organic solvent-tolerant Bacillus cereus WQ9-2:purification,biochemical properties,and potential application in peptide synthesis[J].Bioresour Technol,2010,101(20):7991-7994.
[16]Sun H L,He B F,Xu J X,et al.Efficient chemo-enzymatic synthesis of endomorphin-1 using organic solvent stable protease to green the synthesis of peptide[J].Green Chem,2011,13(7):1680-1685.
[17]Xu J X,Sun H L,He X J,et al.Highly efficient synthesis of endomorphin-2 under thermodynamiccontrol catalyzed by organic solvent stable proteases with in situ product removal[J].Bioresour Technol,2013,129:663-666.
[18]Xu J X,Zhou Z,Wu B,et al.Enzymatic formation of a novel celladhesive hydrogel based on small peptides with a laterally grafted L-3,4-dihydroxyphenylalanine group[J].Nanoscale,2014,6(3):1277-1280.
[19]Gao X X,Cui W J,Tian Y P,et al.Over-expression,secretion,biochemical characterization,and structure analysis of Bacillus subtilis aminopeptidase[J].J Sci Food Agric,2013,93(11):2810-2815.
[20]萨姆布鲁克J,拉塞尔 D W.分子克隆实验指南[M].2版.黄培堂,译.北京:科学出版社,2002.
[21]何小丹,李霜,孙蓓蓓,等.地衣芽胞杆菌YP1A耐有机溶剂蛋白酶基因的克隆与功能表达[J].生物加工过程,2009,7(6):67-73.
[22]何冰芳,欧阳平凯,许家兴,等.一种耐有机溶剂蛋白酶产生菌及其所产耐有机溶剂蛋白酶的基因和应用:中国,201010103804.1[P].2011-04-20.
[23]Tang X Y,Pan Y,Li S,et al.Screening and isolation of an organic solvent-tolerant bacterium for high-yield production of organic solvent-stable protease[J].Bioresour Technol,2008,99(3):7388-7392.
(责任编辑 荀志金)
Cloning and over-expression of protease gene from Bacillus cereus WQ9-2 in Bacillus subtilis
CHENG Longfei,ZHU Fucheng,LIU Keke,HE Bingfang
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
Based on the liquid chromatography-mass-mass spectrometry(LC-MS-MS)analysis of trypsindigested protein fragments of the solvent-stable protease WQ from a solvent-stable strain Bacillus cereus WQ9-2,solvent-stable protease gene was successfully cloned.The gene contains an open reading frame of 1 701 bp,encoding a pre-pro-protein enzyme of 566 amino acids(28-aa pre-signal peptide,220-aa propeptide and 318-aa mature protein with the molecular mass of 3.7×104).The expression plasmid pMA5/ aprWQ was constructed by inserting the aprWQ gene into the vector pMA5 without native signal peptide sequence.The maximum concentration of the recombinant protease was 17 400 U/mL,5 fold higher than the natural production level.Molecular weight,tolerance in organic solvent of recombinant solvent-stable protease was identical to the native protease.The findings provides the basis for further expansion of the catalytic applications of organic solvent-stable protease.
solvent-stable protease;Bacillus subtilis;over-expression;fermentation optimization
Q786
A
1672-3678(2015)03-0020-06
10.3969/j.issn.1672-3678.2015.03.004
2014-05-06
国家高技术研究发展计划(863计划)重大项目(2012AA022205);国家重点基础研究发展计划(973计划)(2011CB710800)
承龙飞(1988—),男,江苏宜兴人,硕士研究生,研究方向:生物化工;何冰芳(联系人),教授,博士生导师,E-mail:bingfanghe@njtech.edu.cn
