大肠杆菌AFP111利用玉米粉全水解液厌氧发酵合成丁二酸
2015-11-11张汉文刘嵘明梁丽亚马江锋
张汉文,刘嵘明,梁丽亚,姜 岷,马江锋
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 210009)
大肠杆菌AFP111利用玉米粉全水解液厌氧发酵合成丁二酸
张汉文,刘嵘明,梁丽亚,姜 岷,马江锋
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 210009)
利用双酶法制得的玉米粉糖液及制糖过程中玉米糖渣酶解后含氮水解液作为发酵培养基,考察在不添加其他营养物质条件下大肠杆菌(E.coli)AFP111专一厌氧发酵产丁二酸的可能性。结果表明:E.coli AFP111厌氧发酵48 h后,丁二酸质量浓度达到15.24g/L,丁二酸的得率为0.76g/g。与在LB培养基中发酵相比,产量提高了14.41%。对关键酶酶活和辅因子NAD(H)含量的测定结果显示,能利用玉米粉全水解液的苹果酸脱氢酶(MDH)、磷酸烯醇式丙酮酸(PEP)羧化酶(PPC)、PEP羧化激酶(PCK)酶活及辅因子NAD(H)含量分别为0.88 U、0.29 U、0.31 U和15.09 μmol/g,均比LB培养基中关键酶酶活和辅因子NAD(H)含量高。由此推测,玉米粉全水解液中关键生长因子(D-生物素、VB1和烟酸)的含量影响了关键酶酶活和辅因子NAD(H)的含量,从而影响丁二酸的产量。在5 L罐中厌氧发酵120 h,利用玉米粉全水解液,丁二酸的得率为0.84g/g,比利用LB培养基发酵得到的丁二酸得率提高了21.74%。
玉米粉糖液;玉米渣;大肠杆菌;丁二酸;厌氧发酵
丁二酸(succinic acid)又称琥珀酸,是一种重要的C4平台化合物,广泛应用于食品、医药、染料、香料和塑料等行业,可作为合成1,4-丁二醇、四氢呋喃、N-甲基吡咯烷酮及可降解生物高分子材料聚丁二酸丁二醇酯(PBS)等的原料[1],被美国能源部认为是未来12种最有价值的生物炼制品之一[2]。大肠杆菌具有代谢背景清楚、操作简便、调控容易、培养基要求简单和生长速度快等优点,近年来被广泛用于研究发酵生产丁二酸[3-5]。
丁二酸主要的产生途径为葡萄糖经过糖酵解途径生成磷酸烯醇式丙酮酸,进而代谢合成草酰乙酸、苹果酸和富马酸,最终以丁二酸的形式积累[6]。Vemuri等[7-8]报道利用大肠杆菌两阶段发酵产丁二酸的方法,首先有氧生长发酵,使菌体得到快速积累,然后转为厌氧发酵,使菌体产生大量的丁二酸。然而两阶段发酵过程中,需要消耗大量的营养成分用于菌体的生长,导致丁二酸总得率下降;同时由于菌体有氧生长对溶氧要求较高,搅拌及冷却等需要较高的能耗及成本投入,因此,专一性厌氧发酵产丁二酸受到越来越多的关注。在专一性厌氧条件下,重组大肠杆菌生产丁二酸需要酵母粉、蛋白胨等复合氮源作为培养基成分,价格过于昂贵。此外,还伴随菌株生长缓慢、丁二酸终浓度和得率较低等问题。例如,重组 Escherichia coli AFP111是E.coli NZN11(pflAB、ldhA双缺陷)的ptsG自发突变的菌株,是一株两阶段发酵生产丁二酸的菌株[9],利用合成培养基专一性厌氧发酵时,E.coli AFP111菌体不生长,不产酸;在LB培养基中进行专一性厌氧发酵,菌株恢复一定的生长能力,但是丁二酸得率较低。
玉米粉是工业制作葡萄糖的重要原料[10],在过滤工艺之后,产生了大量的滤渣——玉米糖渣,滤渣中富集了大量的蛋白质。因此,将玉米糖渣经蛋白酶水解生产的玉米糖渣水解液作为唯一有机氮源,玉米粉双酶法生产的玉米葡萄糖水解液作为唯一碳源,将这2种水解液相结合,形成玉米粉全水解液发酵培养基,代替含有蛋白胨和酵母粉的LB培养基,考察该培养基对重组大肠杆菌厌氧发酵生产丁二酸的影响。
1 材料与方法
1.1 材料
1.1.1 菌株
Escherichia coli AFP111[F+λ-rpoS396(Am)rph-1 Δ(pflAB::Cam)ldhA::Kan 95 ptsG],由David P.Clark教授(Southern Illinois University)惠赠。
1.1.2 主要试剂
氯霉素、卡那霉素,上海生工生物工程有限公司;高温α-淀粉酶、糖化酶,苏柯汉生物工程有限公司;中性蛋白酶,南宁庞博生物工程有限公司;酵母粉、胰蛋白胨,Oxoid公司;CO2气体,南京上元工业气体厂;其他试剂为市售国产分析纯。
1.2 方法
1.2.1 葡萄糖水解液的制备
将玉米粉与纯水以固体质量分数38%的比例混合均匀,每克原料添加0.175mg Ca2+,在pH 6.5、95℃条件下添加7 U/g原料的液化酶,保温至液化结束,液化终点为1滴液化液加入到含有2滴碘液的10mL纯水中,充分振荡后显无色;将液化液灭完酶活后,在pH 4.5、60℃条件下添加200 U/g原料的糖化酶,并保温60℃,48 h后,所得糖化液经过滤得到的滤液为玉米葡萄糖水解液[11]。
1.2.2 玉米淀粉糖渣水解液的制备
糖化液过滤后的滤渣与纯水按固体质量分数10%的比例混合,在pH 7.0、55℃条件下添加中性蛋白酶,其添加量为滤渣质量的0.3%,保温55℃,24 h后过滤所得滤液为含氮的玉米糖渣水解液。
1.2.3 玉米淀粉糖渣水解液氮含量的测定
取5mL玉米淀粉糖液并称质量,连同0.1g CuSO4、1.5g K2SO4和10mL浓H2SO4一起加入消解管中,420℃消解150min。然后利用全自动凯式定氮仪,将消解好的玉米淀粉糖渣水解液进行总氮含量的测定[12]。
1.2.4 玉米葡萄糖水解液和玉米糖渣水解液添加量的标准
玉米葡萄糖水解液添加量的标准:因玉米葡萄糖水解液中含有高浓度的葡萄糖,所以,根据玉米葡萄糖水解液中葡萄糖的浓度和发酵培养基中葡萄糖的终浓度,计算出发酵培养基中所加玉米葡萄糖水解液的体积。
玉米糖渣水解液添加量的标准:根据生产厂家所提供的总氮含量和凯式定氮法的验证,得知LB培养基中总氮含量为1.85g/L,为保证各发酵培养基中总氮含量的一致性,将总氮含量1.85g/L作为发酵培养基的氮源终浓度;再根据凯式定氮法测出玉米糖渣水解液中总氮含量和发酵培养基氮源终含量1.85g/L,从而计算出发酵培养基中玉米糖渣水解液所添加的体积。
1.2.5 生物素、烟酸和VB1的检测
30mL LB培养基:10g/L蛋白胨、5g/L酵母粉、5g/L NaCl、20g/L葡萄糖。
30mL全玉米粉水解液培养基:20g/L玉米葡萄糖水解液(20g/L为发酵培养基中葡萄糖终浓度)、含1.85g/L总氮的玉米糖渣水解液。
2种培养基在121℃、15min条件下湿热灭菌,灭菌后的2种培养基送至江苏省理化检测中心检测D-生物素、烟酸和VB1的含量。
1.2.6 酶活检测
样品处理:采取超声3 s、停5 s的策略共超声破碎3min,于4℃、12 000r/min离心15min,取上清液即粗酶液,测定酶活。
苹果酸脱氢酶(MDH)酶活标准反应体系参照文献[13]。
磷酸烯醇式丙酮酸(PEP)羧化激酶(PCK)酶活标准反应体系参照文献[14]。
PEP羧化酶(PPC)酶活标准反应体系参照文献[15]。采用联机紫外-可见分光光度计连续监测412nm处吸光值的变化,根据测定的标准曲线换算成底物浓度。
MDH酶活定义:25℃、1min内催化草酰乙酸(OAA)生成1 μmol苹果酸所需要的酶量,即1 U。
PCK酶活定义:25℃、1min内催化PEP生成1 μmol OAA所需要的酶量,即1 U。
PPC酶活定义:25℃、1min内催化PEP生成1 μmol OAA所需要的酶量,即1 U。
1.2.7 培养基及培养条件
种子培养基,即LB培养基:酵母粉5g/L、蛋白胨10g/L、NaCl 5g/L;pH 7.0,氯霉素和卡那霉素的终质量浓度分别为100 μg/mL。
专一性厌氧发酵用培养基有以下2种。①30mL LB培养基:添加16g/L碱式MgCO3、20g/L葡萄糖。②30mL玉米粉全水解液培养基:20g/L玉米葡萄糖水解液(20g/L为发酵培养基中葡萄糖终质量浓度)、含1.85g/L总氮的玉米糖渣水解液、添加16g/L碱式MgCO3,pH 7.0,氯霉素和卡那霉素的终质量浓度分别为100 μg/mL。
1.2.8 培养方法
种子培养:将保存于-80℃冻存管的菌种按1%接种量接种到5mL LB试管,37℃、200r/min培养11 h,1%接种量接种到 LB培养基中有氧培养,37℃、200r/min培养6 h。
专一性厌氧发酵:转接10%的菌液到血清瓶中,通入过滤除菌后的CO2气体2min,保证血清瓶中为厌氧环境,37℃、200r/min发酵48 h。
1.2.9 发酵及代谢物分析
细胞生长是用紫外-可见分光光度计于波长600nm处测定吸光度值,细胞干质量(ρ(DCW),g/L)是由ρ(DCW)与OD600测定的标准曲线换算得到,换算公式为ρ(DCW)=0.4×OD600。培养基中的葡萄糖用SBA40C型生物传感仪(山东省科学院生物研究所)检测,有机酸用高效液相色谱法(HPLC)检测,色谱柱为Prevail Organic Acid,流动相为25mmol/L KH2PO4,pH 2.5,流速1.0mL/min,紫外检测波长215nm。
2 结果与讨论
2.1 专一性厌氧条件下重组大肠杆菌利用玉米粉全水解液发酵
选用富含营养物的玉米粉全水解液作为培养基,在专一性厌氧条件下,重组大肠杆菌AFP111发酵生产丁二酸。37℃、200r/min有氧培养菌体到OD600为10左右,菌液转接厌氧血清瓶,48 h后测定细胞干质量、残糖、乙酸及丁二酸的含量,结果如表1所示。
由表1可知:E.coli AFP111厌氧发酵48 h后细胞干质量达到2.34g/L,乙酸积累较少,丁二酸产量和得率分别为15.24g/L和0.76g/g。与在LB培养基中厌氧发酵结果相比,丁二酸的产量和得率分别提高了14.42%和13.43%。由此可见,玉米粉全水解液有作为发酵培养基厌氧合成丁二酸的潜质。

表1 玉米粉全水解液作为培养基厌氧发酵结果Table 1 Results of anaerobic fermentation by Escherichia coli AFP111 using the complete hydrolysate of corn flour medium
2.2 玉米粉全水解液对丁二酸合成的影响初探
由上述实验结果可知,玉米粉全水解液厌氧合成丁二酸的产量较高,玉米粉全水解液有作为丁二酸发酵培养基的潜质。经凯式定氮法测定,玉米粉全水解液含有充足的总氮含量(表2),可以代替酵母粉和蛋白胨,作为菌体生长和发酵的有机氮源。娄秀平等[16]研究发现,VB1对菌体生长和代谢有促进作用,Tyler等[17]等研究发现,D 生物素对菌体生长和产酸有促进作用;烟酸是生物合成NADH、NAD+等辅酶的前体物质[18]。将灭过菌的、相同体积的玉米粉全水解液和LB培养基送至江苏省理化检测中心,检测结果如表2所示。由表2可知:玉米粉全水解液中总氮的质量分数为0.35%,D 生物素、VB1和烟酸的质量浓度分别为11.6mg/L、139.0mg/L和12.7mg/L,明显高于LB培养基中总氮、D 生物素、VB1和烟酸的含量。所以推测玉米粉全水解液中富含菌体生长和产酸所需的有机氮源、烟酸、生物素和VB1等营养物质,有利于丁二酸的积累。

生物素、VB1、烟酸和总氮含量的对比Table 2 Comparing of two kinds of culture medium concentration of D-biotin,VB1,nicotinic acid and total nitrogen表2 2种培养基中D
通过对关键酶酶活和辅因子含量的测定,考察玉米粉全水解液对厌氧合成丁二酸的影响,实验结果见表3。由表3可知:使用玉米粉全水解液做培养基,E.coli AFP111发酵48 h后,菌体内辅酶NAD(H)总含量、MDH、PPC和PCK的酶活分别为15.09 μmol/g、0.88 U、0.29 U和0.31 U,玉米糖渣水解液作为培养基菌体内辅酶NAD(H)总含量和3种关键酶的酶活均比在LB培养基菌体内的辅酶NAD(H)总含量和3种酶酶活要高。再与表2结合分析,可以发现辅酶NAD(H)总含量和关键酶酶活与关键生长因子含量成正相关关系,由此推测,玉米粉全水解液中较多的关键生长因子含量使菌体在培养过程中产生较高的酶活和较多的辅因子供给重组大肠杆菌E.coli AFP111厌氧代谢生产丁二酸。
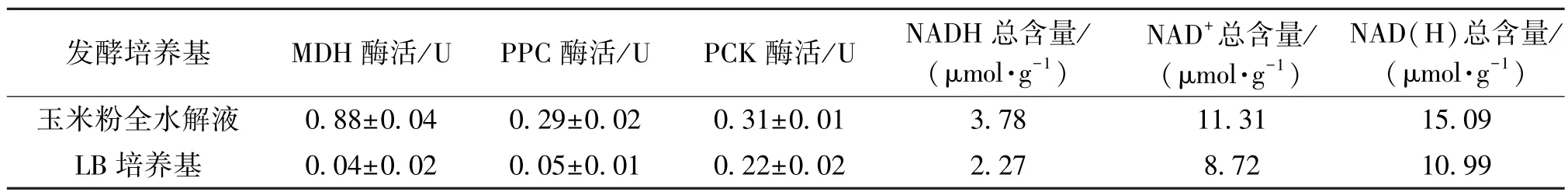
表3 E.coli AFP111厌氧发酵中MDH、PPC和PCK酶活以及辅因子NAD(H)的对比Table 3 Comparing the enzyme activity of MDH,PPC,PCK and NAD(H)during anaerobic fermentation by E.coli AFP111
2.3 碳氮比对发酵的影响
培养基中的碳氮比对于菌体的培养有关键性的作用[19]。笔者设计单因素实验,培养基中总氮浓度不变,添加不同浓度的初糖,考察不同碳氮比对于重组大肠杆菌利用玉米粉全水解液厌氧发酵丁二酸的影响。实验结果见图1。
由图1可知:当初糖质量浓度为20g/L时,E.coli AFP111在玉米粉全水解液培养基厌氧发酵48 h后,菌体细胞干质量、糖消耗量以及丁二酸积累都是最高的,丁二酸的产量为15.21g/L,丁二酸转化率为0.76g/g。与其他初糖浓度的发酵结果相比,初糖质量浓度为20g/L时,是菌体生长和产酸较适宜的碳氮比。

图1 不同初糖浓度专一性厌氧发酵结果Fig.1 Results of anaerobic fermentation by different initial glucose concentration
2.4 5 L发酵罐厌氧发酵丁二酸结果
选用上节实验所得到的碳氮比,在5 L发酵罐中分别进行玉米粉全水解液培养基和LB培养基厌氧发酵的放大实验,发酵结果如图2、图3和表4所示。
由图2、图3和表4可知:专一性厌氧条件下发酵120 h,E.coli AFP111在玉米粉全水解液培养基中消耗50g/L葡萄糖,发酵生产丁二酸42.29g/L,得率为0.84g/g,与在LB培养基中发酵生产丁二酸相比,丁二酸产量相差无几,但得率提高了21.74%。

图2 玉米粉全水解液培养基专一性厌氧5 L发酵罐发酵结果Fig.2 Results of anaerobic fermentation by the complete hydrolysate of corn flour medium in a 5-L bioreactor
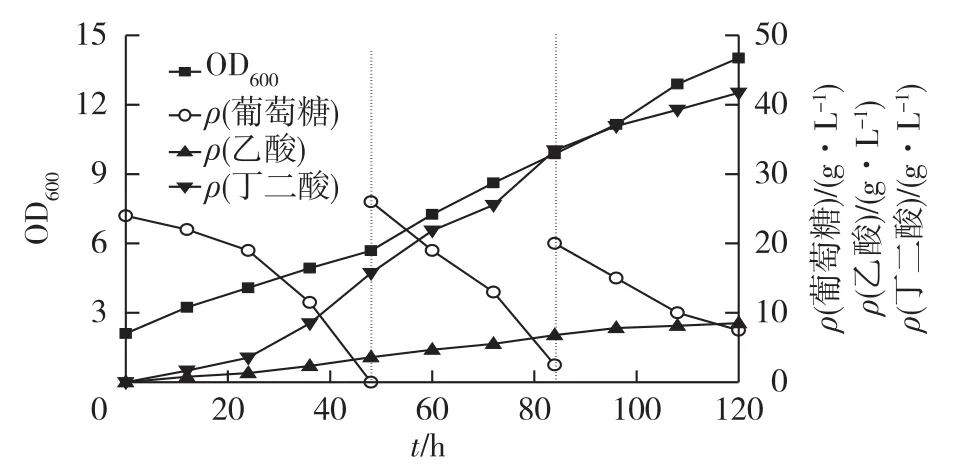
图3 LB培养基专一性厌氧5 L发酵罐发酵结果Fig.3 Results of anaerobic fermentation by the LB medium in a 5-L bioreactor

表4 5 L发酵罐中2种培养基专一性厌氧发酵结果对比Table 4 Comparing with the results of anaerobic fermentation of two kinds of medium in a 5-L bioreactor
3 结论
用不同的酶水解得到葡萄糖水解液和玉米糖渣水解液,在不添加其他碳、氮源的前提下,利用玉米粉全水解液作为培养基代替含有价格昂贵的酵母粉和蛋白胨的LB培养基。重组大肠杆菌E.coli AFP111在专一性厌氧条件下利用玉米粉全水解液发酵生产丁二酸,发酵120 h,利用玉米粉全水解液做培养基,消耗50g/L的葡萄糖,丁二酸产量为42.29g/L,与用LB培养基消耗60g/L葡萄糖生产的丁二酸产量相差无几;但利用玉米粉全水解液的丁二酸得率为0.84g/g,比利用LB培养基的得率提高了21.74%。对玉米粉全水解液的部分成分分析,发现与LB培养基相比,D-生物素、烟酸和VB1的含量较高,D-生物素和VB1对菌体以糖为底物的代谢有着密不可分的联系,而烟酸是能量与辅酶系统中的重要前体物质。由此可见,D-生物素、烟酸和VB1对于玉米粉全水解液做发酵培养基厌氧发酵生产丁二酸有促进作用。除此之外,玉米粉全水解液的原料成本低于LB培养基的原料成本。由此可以表明,玉米粉全水解液作为发酵培养基有代替LB培养基厌氧发酵生产丁二酸的潜力。
[1]姜岷,马江锋,陈可泉,等.重组大肠杆菌产琥珀酸研究进展[J].微生物学通报,2009,36(1):120-124.
[2]王庆昭,吴巍,赵学明.生物转化法制取琥珀酸及其衍生物的前景分析[J].化工进展,2004,23(7):794-798.
[3]Jiang M,Liu S W,Ma J F,et al.Effect of growth phase feeding strategies on succinate production by metabolically engineered Escherichia coli[J].Appl Environ Microbiol,2010,76(4):1298-1300.
[4]San K Y,Bennett G N,Berríos-Rivera S J,et al.Metabolic engineering through cofactor manipulation and its effects on metabolic flux redistribution in Escherichia coli[J].Metab Eng,2002,4(2):182-192.
[5]Jiang M,Wan Q,Liu R M,et al.Succinic acid production from corn stalk hydrolysatein an E.colimutantgenerated by atmosphericand room temperature plasmasand metabolic evolution strategies[J].J Ind Microbiol Biotechnol,2014,41(1):115-123.
[6]Clark D P.The fermentation pathways of Escherichia coli[J]. FEMS Microbiol Rev,1989,5(3):223-234.
[7]Vemuri G N,Eiteman M A,Altman E.Succinate production in dual-phase Escherichia coli fermentations depends on the time of transition from aerobic to anaerobic conditions[J].J Ind Microbiol Biotechnol,2002,28(6):325-332.
[8]Vemuri G N,Eiteman M A,Altman E.Effects of growth mode and pyruvate carboxylase on succinic acid production by metabolically engineered strains of Escherichia coli[J].Appl Environ Microbiol,2002,68(4):1715-1727.
[9]Ma J F,Jiang M,Chen K Q,et al.Succinic acid production with metabolically engineered E.colirecovered from two-stage fermentation[J].Biotech Lett,2010,32(10):1413-1418.
[10]Wu Q Y,Miao Y L.Mechanochemical effects of micronization on enzymatic hydrolysis of corn flour[J].Carbohydr Polym,2008,73(3):398-402.
[11]Wang F Q,Gao C J,Yang C Y,et al.Optimization of an ethanol production medium in very high gravity fermentation[J]. Biotechnol Lett,2007,29(2):233-236.
[12]中华人民共和国卫生部.GB 5009.5—2010 食品中蛋白质的测定方法[S].北京:中国标准出版社.
[13]Liang L Y,Liu R M,Ma J F,et al.Increased production of succinic acid in Escherichia coli by overexpression of malate dehydrogenase[J].Biotechnol Lett,2010.doi:10.1007/s10529-011-0707-4.
[14]Millard C S,Chao Y P,Liao J C,et al.Enhanced production of succinic acid by overexpression of phosphoenolpyruvate carboxylase in Escherichia coli[J].Appl Environ Microbiol,1996,62:1808-1810.
[15]Kim P,Laivenieks M,Vieille C,et al.Effect of over-expression of Actinobacillus succinogenes phosphoenolpyruvate carboxykinase on succinate production in Escherichia coli[J].Appl Environ Microbiol,2004,70:1238-1241.
[16]娄秀平,沈健增,蔡宇杰,等.维生素对大肠杆菌 Escherichia coli.JN8产L-色氨酸的影响[J].食品与生物技术学报,2013,(9):921-926.
[17]Tyler C B,Amanda E P,Susan M L,et al.Complex formation and regulation ofEscherichia coliacetyl-CoA carboxylase[J]. Biochemistry,2013,52(19):3346~3357.
[18]Jiang M,Chen X,Liang L Y,etal.Co-expression of phosphoenolpyruvate carboxykinase and nicotinic acid phosphoribosyltransferase for succinate production in engineered Escherichia coli[J].Enzym Microb Technol,2014,56(5):8-14.
[19]郑淑真.重组大肠杆菌生产基因治疗质粒DNA发酵工艺研究[D].厦门:厦门大学,2007.
(责任编辑 管 珺)
Succinic acid production from complete hydrolysate of corn flour by anaerobic fermentation with Escherichia coli AFP111
ZHANG Hanwen,LIU Rongming,LIANG Liya,JIANG Min,MA Jiangfeng
(State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 210009,China)
This study aimed to use the complete hydrolysate of corn flour as medium instead of lysogeny broth(LB)medium for succinic acid production.The complete hydrolysate of corn flour contains two hydrolysates.The glucose hydrolysate derived from two enzymes hydrolysis of corn flour was used as carbon source,and the corn residue hydrolysate was used as nitrogen source.After 48 h of anaerobic fermentation by using the complete hydrolysate of corn flour without anyother nutrients,the concentration of succinic acid was 15.24g/L,which was 14.41%higher than that on LB medium,and the yield of succinic acid was 0.76g/g.The enzyme activity of key enzymes and the concentration of NAD(H)were measured.The enzyme activity of MDH,PPC,PCK and the concentration of NAD(H)were 0.88 U,0.29 U,0.31 U and 15.09 μmol/g respectively,higher than that on LB medium.Therefore it was assumed that the concentration ofgrowth factors(D-biotin,VB1and nicotin acid)affected the enzyme activity of key enzymes,the concentration of NAD(H)and the concentration of succinic acid.After 120 h of anaerobic fermentation,the yield of succinic acid was 0.84g/g,21.74%higher than that on LB medium.
the glucose hydrolysate;corn residue;E.coli;succinic acid;anaerobic fermentation
TQ921
A
1672-3678(2015)03-0014-06
10.3969/j.issn.1672-3678.2015.03.003
2014-05-09
国家重点基础研究发展计划(973计划)(2013CB733901);国家自然科学基金(21306087);新世纪优秀人才支持计划(NCET-12-0732)
张汉文(1986—),男,江苏南京人,硕士研究生,研究方向:生物化工;姜 岷(联系人),教授,E-mail:bioengine@njtech.edu.cn
