人乳头瘤病毒16型E6和E7癌基因对鸡前脂肪细胞增殖的影响
2015-11-11
人乳头瘤病毒16型E6和E7癌基因对鸡前脂肪细胞增殖的影响
王宁,于莹莹,王珊珊,乔书培,王伟,闫晓红,李辉
(农业部鸡遗传育种重点实验室,黑龙江省普通高等学校动物遗传育种与繁殖重点实验室,东北农业大学动物科学技术学院,哈尔滨150030)
摘要:人乳头瘤病毒的16型E6和E7癌基因已广泛用于建立哺乳动物的永生化细胞,但能否用于建立鸡的永生化细胞尚不清楚。试验究克隆人乳头瘤病毒16型(HPV16)E6和E7癌基因,分别构建这两个病毒癌基因的逆转录病毒表达载体,包装成逆转录病毒颗粒,感染鸡前脂肪细胞后,采用MTT比色法检测E6和E7基因对鸡前脂肪细胞增殖的影响。结果表明,与对照组相比,E7基因显著促进鸡前脂肪细胞增殖,而E6基因则作用不明显。本研究为E6和E7基因在鸡细胞永生化研究奠定基础。
关键词:鸡;人乳头瘤病毒;E6癌基因;E7癌基因;细胞增殖
网络出版时间2015-1-27 16:00:36
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150127.1600.009.html
王宁,于莹莹,王珊珊,等.人乳头瘤病毒16型E6和E7癌基因对鸡前脂肪细胞增殖的影响[J].东北农业大学学报, 2015, 46(2): 47-52.
人乳头瘤病毒(Human papillomaivrus,HPV)是一种双链环状DNA肿瘤病毒,根据其致癌风险性可分为高危型和低危型。HPVl6亚型属高危型,通常能够整合到宿主细胞的基因组DNA中,表达的原癌蛋白能激活宿主细胞中原癌基因,灭活宿主细胞抑癌基因,致使宿主细胞增殖失控、细胞凋亡异常,引起恶性肿瘤。HPV16编码的E6、E7蛋白在细胞转化中起重要作用,转染HPV-16 E6、E7基因可使多种正常组织细胞永生化[1]。HPV-16 的E6和E7癌基因可独立促进细胞增殖,诱导细胞进入的永生化,但诱导作用途径不同。E6蛋白是一种多功能蛋白,该蛋白包含四个特征性C-X-X-C基序,可形成两个锌指状结构,E6蛋白还包含具有p300/CBP、E6-AP、myc和PDZ等多种细胞增殖调控蛋白的结合位点。E6蛋白可降解p53蛋白,增强人端粒酶逆转录酶基因的(Human telomerase reverse transciptase,hTERT)表达和活性,改变细胞周期,促进细胞增殖[2-6]。E7蛋白能与pRb第649-72位氨基酸的口袋结构特异性结合,降解pRb,释放核转录因子E2F,促使细胞进入S期,避免进入DNA损伤应答途径,促进细胞永生化[7]。E7蛋白也可以与RAS、BRCA1和HAT蛋白相互作用,增强hTERT活性,促进细胞增殖[8]。
通过单独使用E6和E7癌基因或联合使用E6/E7基因与人端粒酶活性重建,已成功建立多个哺乳动物永生化细胞系,如人角质形成细胞、宫颈上皮细胞、人胚胎成纤维细胞和人关节软骨细胞等的永生化细胞系[9-12]。鸡细胞的永生化研究进展比较慢,已建立的鸡永生化细胞不多。目前已建立的鸡永生化细胞系主要是利用禽类病毒感染获得,这些细胞系均是转化细胞,已丧失其来源组织细胞特性。由于病毒感染具有宿主特异性,因此,这种方法并不能广泛使用。病毒癌基因法可建立鸡永生化细胞,但是,病毒癌基因(E6和E7)能否在鸡细胞中发挥作用,能否用于鸡细胞的永生化研究尚不清楚。为此,本试验构建HPV16的E6 和E7癌基因的逆转录病毒表达载体,包装成逆转录病毒颗粒后,感染鸡前脂肪细胞后,采用MTT比色法,分析E6和E7对鸡前脂肪细胞增殖的影响。本研究结果为鸡永生化细胞系的建立奠定基础。
1 材料与方法
1.1材料
1.1.1载体、菌株、细胞株及基因组DNA
本研究选用克隆载体pMDTM18-T Vector及菌株DH5α均购自大连宝生物工程公司;逆转录病毒载体pLHCX vector以及包装辅助载体pVSV-G Vector为日本Clontech公司产品;GP2-293包装细胞购自美国ATCC生物标准品资源中心;人乳头瘤病毒16型E6/E7质粒由北京协和医院许雪梅教授惠赠。
1.1.2主要试剂
限制性内切酶和T4DNA连接酶购自NEB公司;质粒小提试剂盒,DNA纯化回收试剂盒购自Axygen公司;质粒中提试剂盒购自Omega公司;Opti-MEM®、DMEM、DMEM/F-12购自Gibco公司;Trizol Reagent、Lipofectamine 2000购自Invitrogen公司;ImProm-IITMReverse Transcription System均购自美国Promega公司;胰酶、抗生素均购自Sigma公司;FuGENE HD Transfection Reagent购自Roche公司;E6、E7抗体购自北京博奥森试剂公司;ECL显色液、辣根过氧化物酶(HRP)标记山羊抗兔抗体(A0208)购自上海碧云天生物技术公司。
1.2方法
1.2.1引物设计与合成
参照NCBI数据库中人HPV16基因(NC_ 001526.2)序列,设计HPV-16 E6、E7基因CDS区克隆引物:E6-F: 5' GCCGAAGCTTATGCACCAAA A 3',E6-R: 5' CGGGTTAACTTACAGCTGGGG 3',上下游引物分别携带HindⅢ和HpalⅠ酶切位点。E7-F: 5' GCGGTTAACATGCATGGAGATA 3',E7-R: 5' CGGATCGATTTATGGTTTCTGA 3',上下游引物分别携带HpalⅠ和ClaⅠ酶切位点。选择β-actin基因作为内参基因,以鸡β-actin mRNA序列(NM_ 205518)为模版设计半定量RT-PCR检测引物actin-F: TCTTGGGTATGGAGTCCTG,actin-R:TAGA AGCATTTGCGGTGG。利用Primer Premier 5.0软件设计引物。引物由上海英俊生物技术有限公司合成。
1.2.2基因克隆及载体构建
以HPV-16 E6/E7质粒为模版,利用2×Pfu master mix DNA聚合酶,扩增E6和E7基因的全长编码区序列(Coding sequence,CDS)。PCR产物回收纯化后连接到pMD-18T载体上,转化大肠杆菌DH5α感受态细胞,提取质粒酶切鉴定正确后,进行测序。测序正确后,利用引物两端的酶切位点(HindⅢ和HpalⅠ;HpalⅠ和ClaⅠ)将目的片段亚克隆到pLHCX载体上,构建pLHCX-E6和pLHCXE7质粒。
1.2.3细胞培养
取12日龄AA肉鸡腹部脂肪组织(3~5 g),PBS清洗2遍后,用2 g·L-1的Ⅰ型胶原酶37℃消化1 h,每隔10 min上下颠倒混匀一次,然后,将消化后的组织液依次通过100和600 um的滤网,收集经过滤的组织消化液200 g离心10 min,弃上层液体,保留下层液体,加入红细胞裂解液处理后,2 000 g离心10 min,弃上清,加入常用培养基(DMEM/F12+10%FBS)重悬细胞(鸡前脂肪细胞),以1×105细胞·cm-2接种于细胞培养瓶中,37℃,5% CO2条件下培养。GP2-293细胞采用完全培养基(DMEM+ 10%FBS),37℃,5% CO2的条件下进行培养。
1.2.4 Western Blot分析
用6孔板培养GP2-293细胞,按照罗氏FuGENE HD转染试剂说明,分别转染2 μg的pLHCX-E6、pLHCX-E7质粒以及pLHCX质粒至GP2-293细胞,培养48 h后,弃去培养基,室温下用PBS洗3次细胞。按照每孔0.15 mL的量加入细胞裂解液(RIPA缓冲液),置于冰上,轻轻摇动15 min裂解完成后,用细胞刮将细胞刮于培养孔的一侧,用移液器将细胞裂解液移至1.5 mL离心管中。10 000 g 4℃离心10 min,上清即为细胞总裂解物。取细胞总裂解物40 ug,加入等体积的2×上样缓冲液与细胞裂解物混合,100℃加热5 min使蛋白质样品变性。取每个变性蛋白质样品10 uL,用BIO-RAD公司的Mini-PROTEAN3电泳系统进行SDS-PAGE。之后,采用BIO-RAD公司的Mini Trans-Blot系统将蛋白质样品由PAGE胶上转移至硝酸纤维素膜。用含有5%脱脂乳的PBST(含0.05%吐温的PBS)将硝酸纤维素膜室温封闭1 h,洗膜后,将膜分别置于一抗的PBST稀释液中,4℃过夜。其中孵GAPDH抗体的稀释浓度为1ϑ500,E6抗体和E7抗体的稀释浓度均为1ϑ500。次日用PBST洗膜3次,每次5 min,然后将膜孵育在含辣根过氧化物酶(HRP)标记的二抗(稀释浓度为1ϑ5 000)的PBST溶液中,置于水平摇床上,室温孵育1 h,再用PBST洗膜3次,每次5 min,之后进行常规ECL显色。
1.2.5逆转录病毒的制备及病毒滴度测定
将GP2-293细胞接种至10 cm细胞培养皿中培养,待细胞汇合至90%时,按照FuGENE HD Transfection Reagent转染试剂说明书,将pLHCX-E6、 pLHCX-E7和pLHCX分别与pVSV-G表达质粒共转染包装细胞GP2-293,72 h后收集病毒液,4℃低速离心去除细胞碎片,高速离心(50 000 g)90 min后,弃上清,重悬病毒,并利用稀释计数法测定病毒滴度后-70℃保存备用。
1.2.6总RNA提取及反转录
总RNA提取是利用Invitrogen公司的Trizol试剂按照操作说明完成。反转录(Reverse transcriptase,RT)以Oligo(dT)为引物,利用Promega公司的ImProm-Ⅱreverse transcriptase Kit完成。
1.2.7半定量RT-PCR检测
将鸡前脂肪细胞接种至12孔板中,待汇合度达80%~90%时,分别用pLHCX-E6、pLHCX-E7和pLHCX的逆转录病毒感染鸡前脂肪细胞,24 h后弃去培养基,PBS清洗3次后,利用Trizol法提取细胞总RNA,将RNA样品统一调到200 μg·L-1。以Oligo(dT)为引物,按照Promega公司的ImProm-Ⅱreverse transcriptase Kit试剂盒操作说明进行RNA反转录。利用E6、E7基因和β-actin基因表达引物(同克隆引物一致),采用半定量RT-PCR检测感染后鸡前脂肪细胞内E6和E7基因的mRNA表达。
1.2.8细胞增殖检测
将鸡前脂肪细胞接种至12孔板中,待汇合度达80%~90%时,分别利用pLHCX-E6、pLHCX-E7及pLHCX逆转录病毒感染鸡前脂肪细胞,24 h后弃去培养基,PBS清洗3次后,将细胞消化下来,终止消化,利用红细胞计数板计数后,接种至96孔板(5×103个·孔-1),每组3个复孔,设为0 h。然后分别在细胞生长至24、48、72和96 h时加入MTT (10 uL·孔-1),将细胞置于37℃、5% CO2培养箱继续培养4 h后,弃孔内培养液,每孔加入100 μL二甲基亚砜(DMSO),室温,摇床上避光振荡10 min,最后在酶标仪上测定各孔A490 nm吸光度,并记录结果。
1.2.9数据分析
运用SAS 9.2软件(SAS Institute Inc)分析试验数据,数据结果表示为xˉ±s,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 HPV-16 E6和E7基因的克隆
分别设计带有HindⅢ和HpalⅠ酶切位点和及带有HpalⅠ和ClaⅠ双酶切位点的E6和E7基因的PCR引物,以HPV-16 E6/E7质粒为模板进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测后分别获得一个477 bp的特异性条带(见图1a)和一个297 bp的特异性条带(见图1b),试验结果与预期相符。分别回收纯化E6和E7的PCR扩增产物,采用T载体克隆,分别获得HPV-16 E6和E7基因的T载体阳性克隆pMD18T-E6和pMD18T-E7。
2.2 HPV-16 E6、E7基因逆转录病毒载体的构建
分别双酶切pMD18T-E6和pMD18T-E7质粒,回收E6和E7基因片段,亚克隆到pLHCX逆转录病毒载体上获得重组子pLHCX-E6和pLHCX-E7。分别利用HindⅢ和HpalⅠ,HpalⅠ和ClaⅠ进行双酶切验证,琼脂糖电泳显示,载体和目的基因条带大小均与理论值相符(见图2),进一步测序,结果表明成功构建E6、E7基因逆转录病毒表达载体。
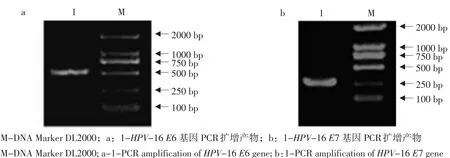
图1 HPV-16 E6(a)和E7(b)基因PCR扩增Fig. 1 PCR amplification of HPV-16 E6 (a) and E7 (b) genes
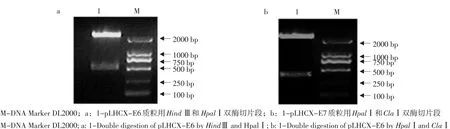
图2 逆转录病毒表达载体pLHCX-E6(a)和pLHCX-E7(b)的酶切鉴定Fig. 2 Identification of the retroviral expression vectors of pLHCX-E6 (a) and pLHCX-E7 (b) by double digestion
2.3 HPV-16 E6、E7基因病毒表达载体的过表达效果验证
为确认pLHCX-E6和pLHCX-E7病毒表达载体能正确表达相应癌基因E6和E7,将pLHCX-E6、pLHCX-E7和空载体pLHCX分别转染GP2-293细胞,48 h后提取细胞总蛋白,利用Western blot方法检测病毒表达载体转染细胞中E6和E7蛋白的表达情况。结果显示,pLHCX-E6和pLHCX-E7能表达出E6和E7蛋白,其中E6蛋白大小约为26 ku,E7蛋白大小约为17 ku,与报道结果相符(见图3),表明本研究构建的逆转录病毒载体能够在细胞中真实表达E6和E7蛋白,可用于下一步逆转录病毒的制备。
2.4 HPV-16 E6、E7基因mRNA水平检测
为确认包装的逆转录病毒能在鸡前脂肪细胞复制,检测病毒感染细胞中E6、E7基因的mRNA表达。将制备的E6、E7及空载病毒感染鸡前脂肪细胞后,48 h后收集细胞,提取总RNA,利用半定量RT-PCR方法检测细胞中HPV-16 E6、E7 mRNA的表达水平。结果显示,两组试验均扩增特异性条带,且条带大小正确(见图4),说明E6和E7基因逆转录病毒能够感染鸡前脂肪细胞。
2.5 MTT法检测E6、E7基因对鸡前脂肪细胞增殖的影响
将E6、E7和空载体病毒颗粒分别感染鸡原代前脂肪细胞后,利用MTT法检测三个处理组细胞的增殖情况。结果显示,接种后细胞生长至24~ 48 h时,三个处理组的细胞相对数和相对活力均呈现上升趋势,但各组间无明显差异;至72 h时,与感染空载体病毒的对照组相比,E6基因对鸡前脂肪细胞增殖作用不显著,但是E7基因表现出明显的促进鸡前脂肪细胞增殖作用(P<0.05),且在96 h时,这种作用达到极显著水平(P<0.01),由此可见,E7基因能促进鸡前脂肪细胞的增殖,而E6基因对鸡前脂肪细胞增殖无显著影响(见图5)。
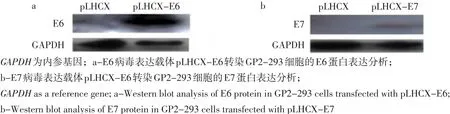
图3 重组质粒pLHCX-E6(a)和pLHCX-E7(b)的表达鉴定Fig. 3 Validation of E6 and E7 protein expression in GP2-293 cells transfected with pLHCX-E6 and pLHCX-E7

图4 E6(a)、E7(b)基因在感染E6和E7病毒鸡前脂肪细胞中半定量表达分析Fig. 4 SqRT-PCR analysis of E6 and E7 gene expression in the chicken preadipocytes infected by the retroviruses expressing E6 and E7
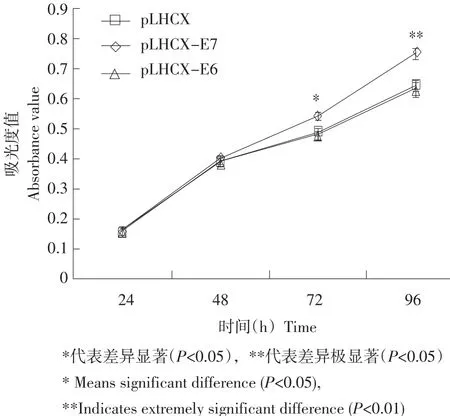
图5 E6和E7对鸡前脂肪细胞增殖的影响Fig. 5 Effects of E6 and E7 on chicken preadipocyte proliferation
3 讨论与结论
本研究成功构建HPV16病毒癌基因E6和E7的逆转录病毒载体,利用MTT法检测E6和E7基因对鸡前脂肪细胞增殖的影响,结果发现,E7基因能显著促进鸡前脂肪细胞增殖,而E6基因的作用不明显。Shai等医学研究发现,E6和E7基因促进细胞增殖的机制不同,其中E6基因主要通过与p53蛋白相互作用,使p53蛋白磷酸化,释放E2F使细胞增殖抑制解除,促进细胞增殖;而E7基因可使细胞的抑癌基因pRb失活,促进细胞增殖[13-16]。人和鸡的p53和pRb蛋白同源性分析显示,人和鸡p53蛋白的同源性比较低(62.8%),但pRb蛋白的同源性相对比较高(72.9%),这可能是E6基因对鸡前脂肪细胞增殖影响作用不显著,而E7基因却显著促进鸡前脂肪细胞增殖作用的原因之一。
在诱导哺乳动物细胞永生化过程中,HPV-16型E6和E7病毒癌基因具有协同作用。E7蛋白能够与pRb蛋白结合,使细胞周期失控而发生永生化[17],但同时E7蛋白也会增强细胞凋亡[13],而E6可以通过抑制p53和Bak阻断细胞凋亡[1, 18],对E7基因起协同作用。另外,E6和E7基因均可以增强人类细胞的端粒酶活性,且E7基因能够增强E6基因诱导的hTERT活性。以往脂肪细胞永生化研究发现,尽管E6蛋白可以阻止p300/CBP蛋白乙酰化p53蛋白,降低p53蛋白活性,但E6蛋白结合p300/CBP蛋白会抑制p300/CBP蛋白对脂肪细胞分化转录因子PPARγ和C/EBPα的激活作用,干扰脂肪细胞分化。E7蛋白促进前脂肪细胞增殖,但并不干扰脂肪细胞的分化特性[19]。鸡的脂肪细胞分化与哺乳动物的相似,也受到PPARγ、C/EBPα等转录调控因子的级联调控,p300/CBP蛋白是活化PPARγ、C/EBPα所必需的[20],由此推断,E6癌基因不适用于鸡前脂肪细胞永生化的建立。根据本研究结果,HPV-16的E7癌基因有望单独或联合其他癌基因或端粒酶基因用于鸡细胞的永生化研究。
[参考文献]
[1]Boulet G, Horvath C, Broeck D V. Human Papillomavirus: E6 and E7 oncogenes[J]. Int J Biochem Cell Biol, 2007, 39: 2006-2011.
[2]Yi J W, Jang M, Kim S J, et al. Degradation of p53 by natural variants of the E6 protein of human papillomavirus type 16[J]. Oncol Rep, 2013, 29: 1617-1622.
[3]Muench P, Probst S, Schuetz J, et al. Cutaneous papillomavirus E6 proteins must interact with p300 and block p53-mediated apoptosis for cellular immortalization and tumorigenesis[J]. Cancer Res, 2010, 70: 6913-6924.
[4]Sekaric P, Cherry J J, Androphy E J. Binding of human papillomavirus type 16 E6 to E6AP is not required for activation of Htert [J]. J Virol, 2008, 82: 71-76.
[5]Liu X, Dakic A, Chen R, et al. Cell-restricted immortalization by human papillomavirus correlates with telomerase activation and engagement of the hTERT promoter by Myc[J]. J Virol, 2008, 82: 11568-11576.
[6]Choi M, Lee S, Choi T, et al. Roles of the PDZ domain-binding motif of the human papillomavirus type 16 E6 on theimmortalization and differentiation of primary human foreskin keratinocytes [J]. Virus Genes, 2014, 48: 224-232.
[7]Gammoh N, Grm H S, Massimi P, et al. Regulation of human papillomavirus type 16 E7 activity through direct protein interaction with the E2 transcriptional activator[J]. J Virol, 2006, 80: 1787-1797.
[8]Mazurek S, Zwerschke W, Jansen-Dürr P. Metabolic cooperation between different oncogenes during cell transformation: interaction between activated ras and HPV-16 E7[J]. Oncogene, 2001, 20: 6891-6898.
[9]Miller J, Dakic A, Chen R, et al. HPV16 E7 protein and hTERT proteins defective for telomere maintenance cooperate to immortalize human keratinocytes[J]. PLoS Pathog, 2013, 9: e1003284.
[10]Cao Z Y, Zhao J, Liao Q P, et al. Immortalization of human embryonic cervical epithelial cells induced by E6, E7 genes of human papillomavirus 16[J]. Chinese Journal of Obstetrics and Gynecology, 2004, 39: 486-488.
[11]Yamamoto A, Kumakura S, Uchida M, et al. Immortalization of normal human embryonic fibroblasts by introduction of either the human papillomavirus type 16 E6 or E7 gene alone[J]. Int J Cancer, 2003, 106: 301-309.
[12]Grigolo B, Roseti L, Neri S, et al. Human articular chondrocytes immortalized by HPV-16 E6 and E7 genes: Maintenance of differentiated phenotype under defined culture conditions[J]. Osteoarthritis Cartilage, 2002, 10: 879-889.
[13]Shai A, Brake T, Somoza C. The human Papillomavirus E6 oncogene dysregulates the cell cycle and contributes to cervical carcinogenesis through two independent activities[J]. Cancer Res, 2007, 67: 1626-1635.
[14]Huibregtse J M, Scheffner M, Howley P M. Localization of the E6- AP regions that direct human papillomavirus E6 binding, association with P53, and ubiquitination of associated proteins[J]. Mol Cell Biol, 1993, 13: 4918-4927.
[15]Klingelhutz A J, Foster S A. Telomerase activation by the E6 gene product of human papillomavirus type 16[J]. Nature, 1996, 380: 79-82.
[16]Boyer S N, Wazer D E, Band V. E7 protein of human papilloma virus-16 induces degradation of retinoblastoma protein through the ubiquitin-proteasome pathway[J]. Cancer Res, 1996, 20: 4620-4624.
[17]Zhang Y, Dasgupta J, Ma R Z, et al. Structures of a HPV-E6 polypeptide bound to MAGUK proteins: mechanisms of targeting tumor suppressors by a high-risk HPV oncoprotein[J]. J Virol, 2007, 81: 3618-3626.
[18]Fragnet L, Kut E, Rasschaert D. Comparative functional study of the viral telomerase RNA based on natural mutations[J]. J Biol Chem, 2005, 280: 23502-23515.
[19]Darimont C, Macé K. Immortalization of human preadipocytes[J]. Biochimie, 2003, 85: 1231-1233.
[20]EricksonR L, Hemati N, Ross S E, et al. p300 coactivates the adipogenic transcription factor CCAAT/enhancer-binding protein alpha[J]. J Biol Chem, 2001, 276: 16348-16355.
Wang Ning, Yu Yingying, Wang Shanshan, et al. Effect of HPV-16 E6 and E7 oncogenes on chicken preadipocyte proliferation[J]. Journal of Northeast Agricultural University, 2015, 46(2): 47-52. (in Chinese with English abstract)
Effect of HPV-16 E6 and E7 oncogenes on chicken preadipocyte pro-
liferation
/WANG Ning, YU Yingying, WANG Shanshan, QIAO Shupei, WANG Wei, YAN Xiaohong,LI Hui(Key Laboratory of Chicken Genetics and Breeding, Ministry of Agriculture, Key Laboratory of Animal Genetics, Breeding and Reproduction, Education Department of Heilongjiang Province, School of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China)
Abstract:Human papillomavirus type 16 E6 and E7 oncogenes are widely used in the establishment of immortalized mammalian cells, but it is unclear whether E6 and E7 oncogenes can used for immortalizing chicken cells. In the present study, HPV-16 E6 and E7 genes were cloned and inserted into the retroviral expression vectors. E6 and E7 retroviral expression vectors were packaged into infectious virus particles, respectively. The primary chicken preadipocytes were infected by the retroviruses expressing E6 and E7, respectively. The proliferation of chicken preadipocytes was detected by MTT assay. The results showed that E7 gene significantly promoted chicken preadipocyte proliferation compared with the control group, but E6 gene had no obvious effect on chicken preadipocyte proliferation. Our findings lay the foundation for chicken cell immortalization by E6 and E7 gene.
Key words:chicken; HPV; E6; E7; cell proliferation
作者简介:王宁(1964-),男,教授,博士,博士生导师,研究方向为动物遗传育种。E-mail: ningwang2001@yahoo. com
基金项目:国家自然科学基金项目(30972086);973课题(2009CB941604);国家肉鸡产业技术体系建设资助项目(CARS-42)
收稿日期:2014-04-01
文章编号:1005-9369(2015)02-0047-06
文献标志码:A
中图分类号:S831
