鸡氨肽酶N蛋白多克隆抗体制备及其生物学功能研究
2015-11-11
鸡氨肽酶N蛋白多克隆抗体制备及其生物学功能研究
李广兴1,李兰兰1,潘龙1,洪琴1, 2,张恒1, 3,杨巍1,黄小丹1, 4,马德星1,张瑞莉1,杨贵君1
(1.东北农业大学动物医学学院,哈尔滨150030;
2.上海药明康德新药开发有限公司生物部,上海200131;
3.山东信得科技股份有限公司,山东潍坊262200;
4.黑龙江职业学院,哈尔滨150080)
摘要:试验参考GenBank上鸡氨肽酶N(gAPN)基因序列(登录号为NM_204861.1)设计多对特异性引物,利用RT-PCR分段克隆gAPN基因各段克隆产物并利用SOE-PCR将其进行连接,得到大小为2 906 bp的全长基因。利用原核表达载体pET-30a(+)构建重组质粒pET-gAPN并转化E. coli Rosetta,经诱导表达得到大小为113 ku目的条带。以纯化gAPN重组蛋白为免疫原制备兔抗gAPN多克隆抗体,间接Elisa方法检测多抗血清效价为215。Western Blot试验证明,此多克隆抗体可以与原核表达的蛋白产生特异性条带,同时与18日龄鸡肾组织中获得的天然gAPN蛋白样品有良好的反应性。间接免疫荧光试验显示,多克隆抗体可检测到pcDNA-gAPN转染HELA细胞所表达的gAPN蛋白。上述结果可为gAPN蛋白的深入研究奠定基础。
关键词:鸡氨肽酶N;多克隆抗体;免疫印迹;间接免疫荧光
网络出版时间2015-1-27 16:00:06
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150127.1600.004.html
李广兴,李兰兰,潘龙,等.鸡氨肽酶N蛋白多克隆抗体制备及其生物学功能研究[J].东北农业大学学报, 2015, 46(2): 24-31.
Li Guangxing, Li Lanlan, Pan Long, et al. Preparation of polyclonal antibody against chicken amino peptidase N protein and its biological functions[J]. Journal of Northeast Agricultural University, 2015, 46(2): 24-31. (in Chinese with English abstract)/LI Guangxing1, LI Lanlan1, PAN Long1, HONG Qin1, 2,
Preparation of polyclonal antibody against chicken amino peptidase N
protein and its biological functions
ZHANG Heng1, 3, YANG Wei1, HUANG Xiaodan1, 4, MA Dexing1, ZHANG Ruili1, YANG Guijun1(1. School of Veterinary Medicine, Northeast Agricultural University, Harbin 150030, China; 2. Biology Department, Wuxi AppTec Co., Ltd, Shanghai 200131, China; 3. Shandong Sinder Technology Co., Ltd, Weifang Shandong 262200, China; 4. Heilongjiang Polytechnic, Harbin 150080, China)
Abstract:In this study, specific primers were designed according to the reference gAPN gene (NM_204861.1) of GenBank. The complete chicken amino peptidase N (gAPN) gene of totally 2 906 bp was cloned and linked with RT-PCR and SOE PCR technique. The gAPN was expressed after construction of pET-30a-gAPN and transformed E. coli Rosetta, the molecular weight of gAPN recombinant protein is 113 ku. The purified recombinant protein was used as antigen for preparation of rabbit anti-gAPN polyclonal antibody, the titer of polyclonal antibody was 215. Western Blot showed that this polyclonal antibody had highly reactivity and specialty with recombinant protein and natural gAPN from kidney of 18-day-old of chicken. IFA test demonstrated that this polyclonal antibody could react with the HELA cell transfected with eukaryotic expression plasmid of pcDNA-gAPN.
Key words: chicken amino peptidase N; polyclonal antiserum; Western Blot; indirect fluorescence antibody assay
氨肽酶N(APN)是一种Ⅱ型金属蛋白酶,主要分布于肾脏、小肠和呼吸道上皮细胞等处,具有促进血管生成、充当病毒细胞受体、介导信号转导等多种功能[1]。冠状病毒在感染宿主细胞过程中需要受体参与,现已经鉴定出与冠状病毒S蛋白N-端RBDS结合的细胞受体包括唾液酸和癌胚抗原相关细胞黏附分子1(CEACAM1),与C-末端RBDS结合的细胞受体包括APN和血管紧张素转换酶2 (ACE-2)[2],但这些可能存在的病毒受体生物学功能尚需进一步研究。
APN可作为多种冠状病毒的细胞受体,Alpha属人和各种动物冠状病毒可利用其自然宿主APN和猫氨肽酶N(fAPN)作为受体[3]。唾液酸也可以作为受体或辅助受体发挥作用,Gamma属冠状病毒IBV以N-乙酰基神经氨酸(Neu5Ac)作为辅助受体,但IBV与Neu5Ac的结合域尚未确定[4]。小鼠CEACAM1主要生理功能是介导细胞黏附和信号转导,是所有小鼠肝炎病毒株的主要受体[5]。目前IBV感染是否利用APN作为其受体还未达成共识,且APN发挥受体作用的功能区尚不清楚。明晓波等对鸡APN在不同鸡组织中的分布、定量研究表明,IBV的组织嗜性与APN酶活性存在一定的相关性,但规律性不强;采用荧光定量PCR的方法测定不同日龄雏鸡主要组织器官中APN的mRNA表达量,结果表明IBV的组织嗜性与APN的自然分布存在明显的正相关性,同时克隆APN基因构建真核重组表达质粒,利用间接免疫荧光验证鸡APN作为IBV的受体可能性[6]。
本试验从鸡肾脏中分段克隆全长gAPN,蛋白成功表达后制备多克隆抗体,利用Western Blot和间接免疫荧光试验研究其生物活性及其天然活性,为进一步证实APN作为IBV功能受体的可能性奠定基础。
1 材料与方法
1.1试验载体、质粒、实验动物及主要试剂
原核表达载体pET-30a(+)由东北农业大学动物医学学院兽医病理解剖实验室保存;PCR试剂、T4DNA连接酶、限制性内切酶、IPTG、高分子质量蛋白质Maker购自大连宝生物工程有限公司;pMD-18T载体、质粒小量抽提试剂盒、琼脂糖凝胶回收试剂盒购自北京索莱宝生物公司;感受态细胞E. coli JM109、Rosetta购自北京全式金生物技术有限公司;HRP标记的山羊抗兔IgG购自北京中杉生物技术有限公司;新西兰雌性白兔购自哈尔滨市某养殖场。
1.2引物设计与合成
参考GenBank上登录号为(NM_204861.1)的gAPN基因序列用Premier 5.0和Oligo6.0设计以下特异性引物(见表1)对gAPN基因进行分段克隆及对原核质粒进行构建。
1.3鸡氨肽酶N总RNA的提取、目的基因的扩增及核苷酸序列分析
取28日龄SPF来航鸡的肾脏组织50~100 mg,按Trizol Reagent说明书提取总RNA,按照M-MLV反转录说明书以Oligo(dT)18 Primer为反转录引物将RNA反转录成cDNA,先用引物Apn1F,Apn1R;Apn2F,Apn2R;Apn3F,Apn3R分别克隆出三段基因,再采用SOE-PCR,按Ex Taq DNA聚合酶说明书分两次进行gAPN全长的克隆,先用引物Apn1F,Apn2R进行第一次合成,片段长度为2 062 bp,再使用引物Apn2F,Apn3R合成gAPN全长,反应条件为95℃预变性5 min,95℃30 s,63℃30 s,72℃3 min,30个循环;72℃延伸10 min。取5 μL PCR产物用1%琼脂糖凝胶电泳进行鉴定,将反应产物用DNA凝胶回收试剂盒回收,将回收的目的基因与pMD-18T载体连接,对重组质粒进行转化和鉴定,将鉴定阳性的重组质粒送至生工生物工程股份有限公司进行序列测定,将测序得到的gApn核苷酸序列用DNAstar软件进行分析。
1.4 gAPN原核重组表达质粒pET-gAPN和真核重组表达质粒pcDNA-gAPN的构建
用引物pET-ApnF、pET-ApnR;pcDNA-apnF、pcDNA-apnR对gAPN全长进行亚克隆,将亚克隆后的胶回收产物和原核表达载体pET-30 a(+)、真核表达载体pcDNA3.1同时用Eco RⅠ和HindⅢ进行双酶切,纯化后用T4DNA连接酶连接,产物转化JM109感受态,挑取单克隆,培养过夜,提取质粒进行鉴定,将鉴定正确的重组质粒命名为pET-gAPN、pcDNA-gAPN,将重组质粒进行测序鉴定。

表1 基因克隆所用特异性引物Table 1 Specific primers used for cloning
1.5重组质粒的诱导表达与纯化
将pET-gApn和空载体pET-30a(+)分别转化大肠杆菌Rossetta,取100 μL涂布在相应抗性的LB平板,37℃培养过夜。挑取单菌落于含相应抗生素的液体LB培养基中,37℃振荡培养,在波长600 nm处检测培养物的OD600=0.5数值,取1 mL重组菌液培养物作为诱导前对照,剩余培养物中加入终浓度为1 mmol·L-1的IPTG,继续在37℃振荡培养,每隔1 h取一次样,诱导7 h后进行SDS-PAGE分析。表达产物参照文献[7]所述方法进行纯化,获得的产物命名为gAPN蛋白,用透析袋复性,并进行SDS-PAGE分析。
1.6 gApn蛋白多克隆抗体的制备及效价测定
1.6.1多克隆抗体的制备
将复性的gApn蛋白(1 mg·mL-1)与等体积弗氏完全佐剂混合乳化为油乳剂,采用背部多点注射方法对新西兰白兔进行免疫,以后每隔一周将纯化复性后的蛋白与等体积弗氏不完全佐剂混合乳化采用皮下多点注射免疫白兔,共免疫4次,最后一次免疫后一周对白兔进行颈动脉无菌取血,分离血清。
1.6.2间接ELISA多克隆抗血清效价检测
用稀释液(0.1 mol·L-1pH 8.6 NaHCO3)稀释为10 μg·mL-1的gApn蛋白作为包被抗原,被检血清按2-5~2-16稀释度进行稀释,作为一抗进行间接ELISA,检测多克隆抗血清的抗体效价。
1.7多克隆抗体的鉴定及生物活性的检测
1.7.1抗体特异性的Western Blot检测
分别用天然gApn蛋白和重组gApn蛋白与兔抗gApn阳性血清进行Western Blot检测。重组gAPN融合蛋白检测时,使用gAPN融合蛋白进行SDS-PAGE电泳,转印至硝酸纤维素膜,将gAPN多抗做1ϑ5 000倍稀释,酶标二抗1ϑ1 000倍稀释,进行Western Blot检测;天然gAPN蛋白检测时,取20 mg鸡肾脏,加入100 μL组织裂解液进行研磨裂解,离心取上清,制备SDS-PAGE样品进行转印,将gAPN多抗做1ϑ1 000倍稀释,酶标二抗1ϑ1 000倍稀释,进行Western Blot检测。
1.7.2多克隆抗体的IFA检测
将表达gAPN蛋白的真核质粒pcDNA-gAPN和pcDNA3.1空载体转染长满单层70%的Hela细胞,24 h后用多聚甲醛固定,一抗为1ϑ100倍稀释的多抗血清,二抗为1ϑ200倍稀释的FITC标记山羊抗兔IgG,进行间接免疫荧光试验。
2 结果与分析
2.1鸡APN基因的克隆
从28日龄鸡肾脏提取总RNA进行RT-PCR,用引物Apn1F,Apn1R扩增片段大小为864 bp,用引物Apn2F,Apn2R扩增片段大小为1 327 bp,用引物Apn3F,Apn3R扩增片段大小为759 bp(见图1),经过两次SOE-PCR,第一次SOE-PCR扩增出片段长度约为2 062 bp(见图2),第二次SOE-PCR成功扩增出片段长度为2 906 bp的目的片段(见图2),将PCR产物亚克隆到pMD18-T载体,将鉴定阳性的重组质粒(见图3)送生物公司测序,结果表明所克隆的序列为gAPN全长。克隆的gAPN序列已经登录GenBank,登录号为JX014437.1。

图1 gAPN基因PCR扩增产物Fig. 1 PCR product of gAPN gene

图2 gAPN基因SOE PCR扩增产物Fig. 2 SOE-PCR product of gAPN gene
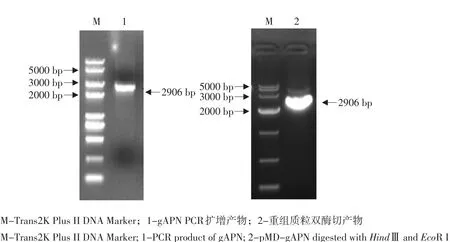
图3 gAPN基因鉴定结果Fig. 3 Identification of gAPN gene
2.2序列分析
利用DNAstar软件,将本试验克隆的gAPN基因和其他几种动物参考APN基因序列(见表2)进行比对(见表3)。通过比对发现本试验所克隆gAPN基因序列与其他几个物种APN序列之间的同源性均在69%以上,表明在各个物种中存在相同的高度保守区域,同时各物种间又存在各种差异的可变区;其中本文克隆gAPN基因与鸡APN参考序列(NM_204861.1)同源性为99.1%,表明鸡源APN基因高度保守。
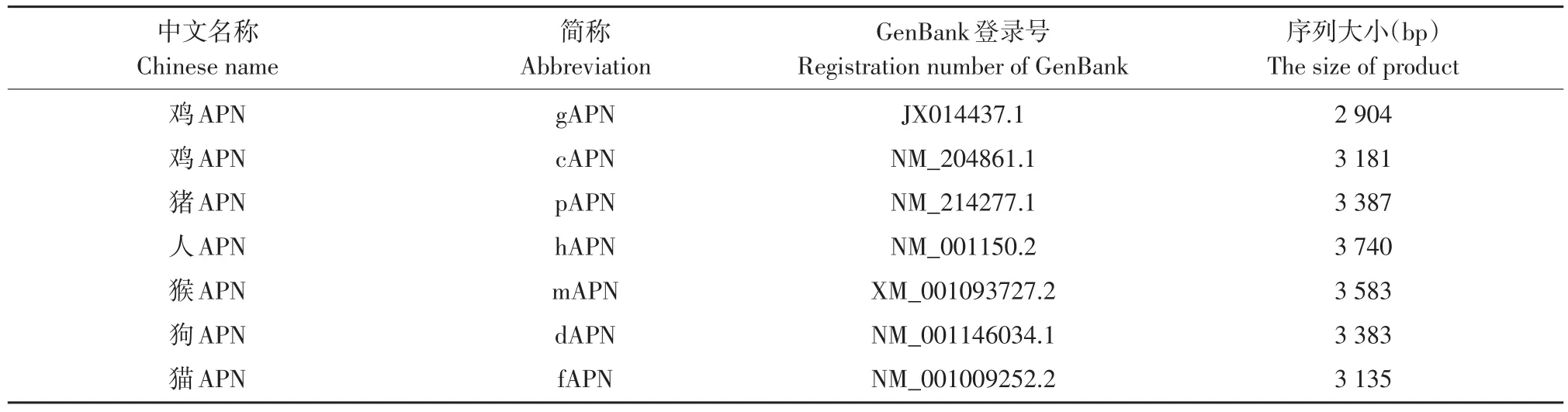
表2 参考动物的APN基因序列Table 2 Reference APN gene sequence of different animals
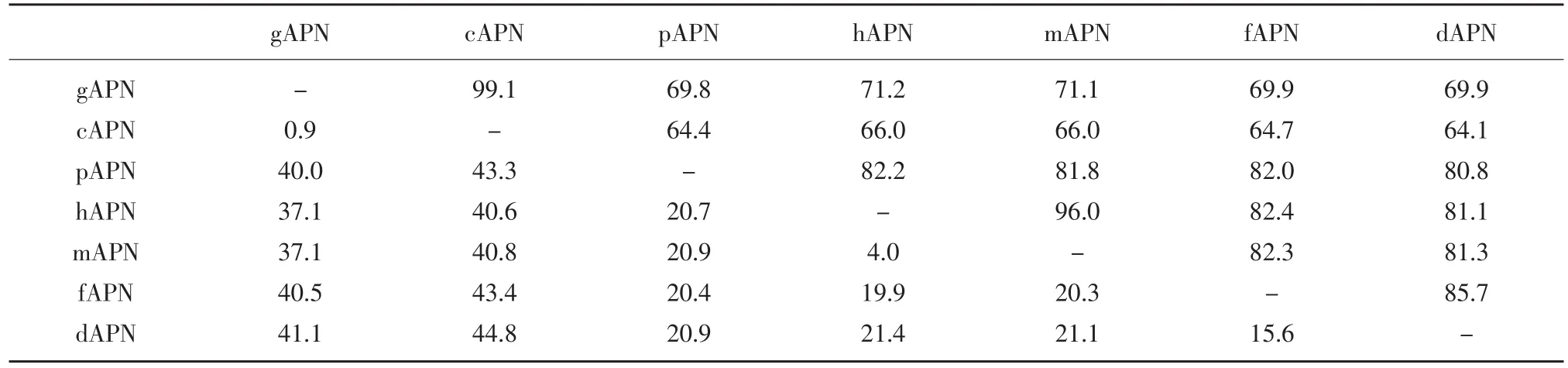
表3 参考动物的APN基因同源性分析结果Table 3 Percent identity analysis of different animal APN genes
2.3鸡APN基因的重组原核、真核表达质粒的构建、蛋白表达
2.3.1重组质粒的构建
亚克隆gAPN基因插入原核表达载体pET30a(+)和真核表达载体pcDNA3.1,PCR和双酶切鉴定结果显示,重组表达质粒pET-gAPN(见图4)和pcDNA-gAPN(见图5)均构建正确,测序结果证实成功构建重组质粒pET-gAPN和pcDNA-gAPN。
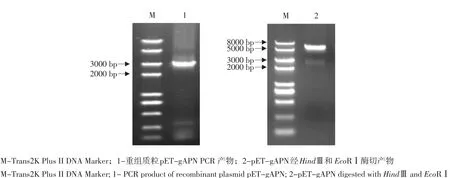
图4 重组质粒pET-gAPN鉴定结果Fig. 4 Identification of the recombinant plasmid pET-gAPN
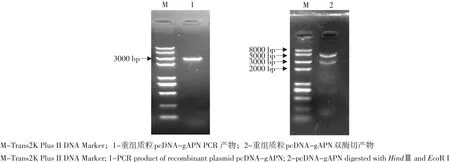
图5 重组质粒pcDNA-gAPN鉴定结果Fig. 5 Identification of the recombinant plasmid pcDNA-gAPN
2.3.2重组蛋白的表达
将鉴定正确的重组原核表达质粒pET-gAPN转化至Rosetta感受态,37℃,1 mmol·L-1IPTG诱导,共诱导7 h(见图6),可见在116和97 ku间出现一条目的条带,与预测的蛋白大小113 ku相符,随着诱导时间的延长表达量逐渐变大,在4 h时达到最大。
2.4多克隆抗体的鉴定
2.4.1 gAPN多克隆抗体血清的效价测定
用ELISA法测定gAPN多克隆抗体血清效价,结果显示随着血清稀释度的增高,OD值逐步降低,当多克隆血清稀释215倍时P/N>2,稀释216倍时P/N<2确定gAPN多克隆抗体血清效价为215(见图7)。
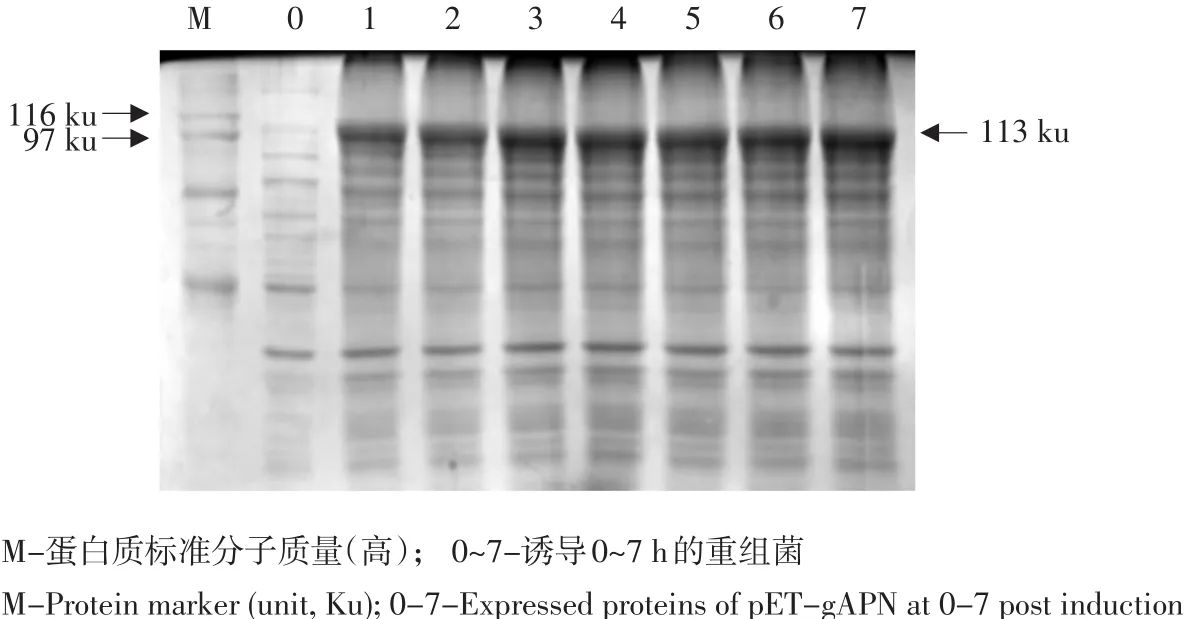
图6 gAPN蛋白表达的SDS-PAGE分析Fig. 6 SDS-PAGE analysis of gAPN protein expression

图7 多抗血清效价的ELISA检测结果Fig. 7 ELISA analysis of the binding activities of polyclonal antibody
2.4.2 gAPN蛋白的Western Blot检测结果
将原核表达的gAPN蛋白进行Western Blot,原核表达的gAPN大小为113 ku,在130和95 ku见可见特异性单一条带(见图8),证明制备的多克隆抗体可以和原核表达的蛋白产生特异性结合。
使用从鸡肾脏提取的总蛋白进行Western blot,天然gAPN蛋白的大小为160 ku,在150和230 ku间可见单一条带(见图9),证明制备的多克隆抗体与天然gAPN蛋白可产生特异性反应,反应性良好,条带单一,可用于后续试验。

图8 原核表达gAPN蛋白与gAPN多抗的Western BlotFig. 8 Western Blot of prokaryotic expression gAPN withrabbit anti gAPN antiserum
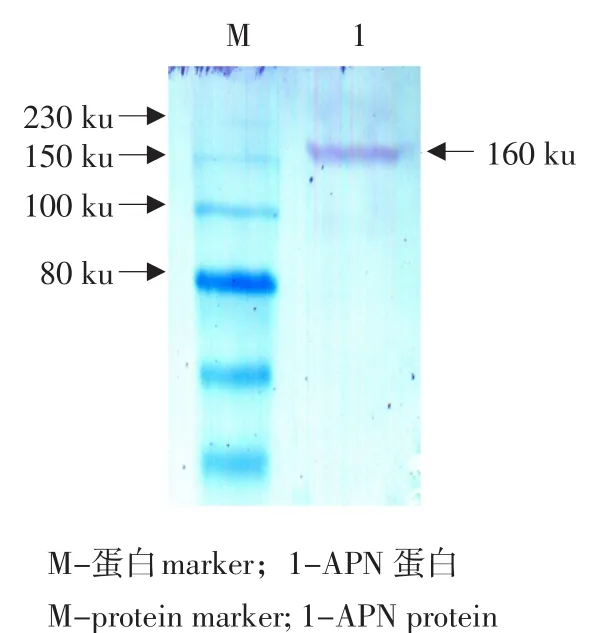
图9 gAPN多抗与天然gAPN的Western blotFig. 9 Detection Natural gAPN by Western blotting
2.4.3多克隆抗体的IFA检测
结果见图10。
间接免疫荧光试验显示,转染真核质粒pcDNA-gAPN的HELA细胞可以检测到特异性荧光(见图10A),而转染pcDNA3.1空载体的细胞未出现特异性荧光(见图10B)。
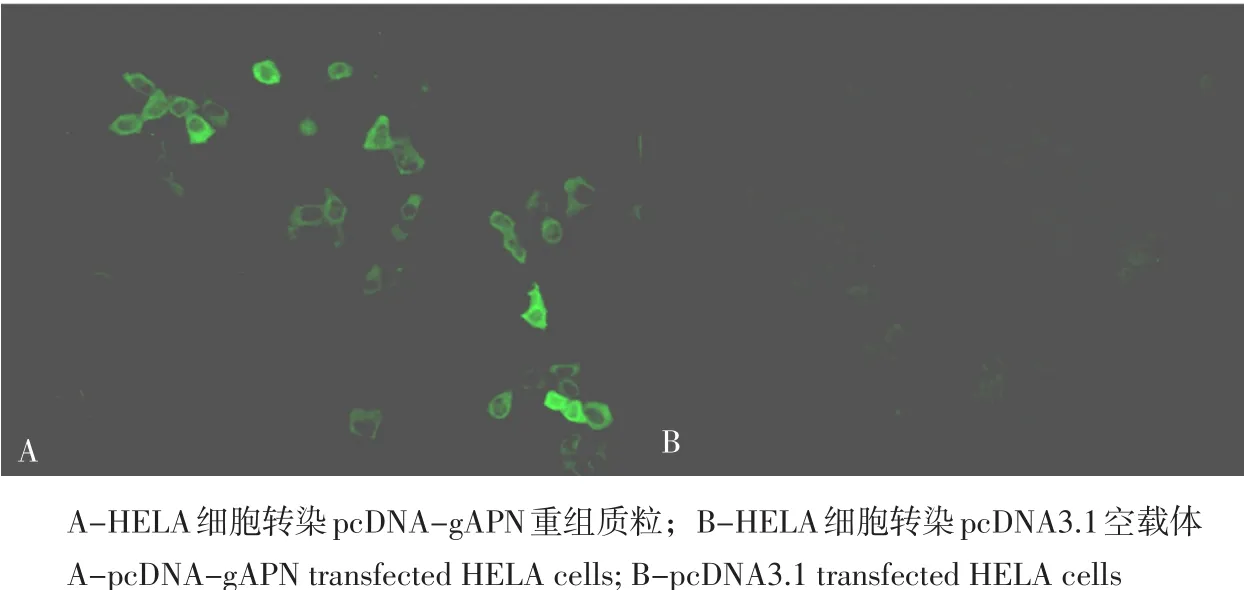
图10 多克隆抗体的IFA检测Fig. 10 Assay of the polyclonal antiserum with indirect fluorescence antibody
3 讨论与结论
氨肽酶N(APN)/CD13是II型金属蛋白酶,由一个短N-端胞浆域、跨膜部分和包含活性部位的大细胞胞外结构域组成,共计967个氨基酸。APN广泛存在于各种器官和组织中[8],高表达于肾小管上皮细胞、肠上皮细胞、肺上皮细胞和各种类型细胞[9]。天然APN分子质量为160 ku,哺乳动物APN是普遍存在的多功能酶,与肿瘤发生和免疫器官发育有关,参与抗原和抗原递呈过程中微调。功能有利于对生物活性肽反应(疼痛管理,血管加压素释放)调制和影响免疫功能和主要生物活动。目前已经证明氨肽酶N可作为Alpha属冠状病毒猪传染性胃肠炎病毒(TGEV)[10]、猪病毒性腹泻病毒(PEDV)[11]的受体。猪呼吸道冠状病毒(PRCoV)、人类冠状病毒229E(HCoV-229E)[12]、猫冠状病毒(FCoV)和犬冠状病毒(CCoV)利用其自然宿主和猫氨肽酶N(fAPN)作为受体,但猫APN不是Gamma属冠状病毒IBV受体[3]。冠状病毒在识别受体APN时是有种属特异性,且特异性与APN蛋白N-连接糖基化相关[13]。本研究从28日龄的来航鸡肾脏中提取RNA,利用设计的三对引物克隆出gAPN基因的3个片段,再利用两次SOE-PCR成功将3段基因连接在一起得到全长2 906 bp的gAPN基因。将本试验克隆的gAPN序列与其他几种动物APN序列进行同源性分析,表明本试验克隆gAPN基因序列与鸡APN参考序列(NM_ 204861.1)同源性为99.1%,表明鸡APN基因高度保守;与参考动物的序列同源性均在69%以上,各个物种间存在相同的保守区域,这些区域高度保守,各物种间又存在各种差异可变区,这些可变区是各物种在进化过程中形成。Wentworth等试验证明,受体结合位点和功能性的氨基酸都位于各物种APN基因的高变区,在APN上已经确定3个受体结合区域均位于其表面(AA 283-292,vbm 1;AA 728-744,vbm 2;AA 760-784,vbm 3),FCoV和CCoV可以结合vbm 2和vbm 3;PRCOV主要结合pAPN的AA 783 和787[14];HCoV-229E结合AA 283-292(vbm1)[15]。
本文进行gAPN原核重组蛋白的表达和多抗制备,间接免疫荧光试验证明制备多抗和真核表达质粒转染的HELA细胞呈现特异性荧光,同时此多抗还可以与鸡肾脏中的天然结构gAPN蛋白特异性结合,证明此多抗具有较好的与天然APN结合能力。本实验室利用Western Blot证明原核表达gAPN蛋白可以和IBV病毒反应,由于SDS-PAGE是变性电泳,SDS将蛋白质变性,使之失去天然结构,证明gAPN与IBV结合不依赖蛋白质的高级结构,与酶的活性中心无关,这与Costa等其他冠状病毒相关受体研究结果一致[16],提示gAPN可作为IBV可能的功能性受体在病毒侵染细胞过程中发挥作用。本文中gAPN重组蛋白表达和多克隆抗体的制备及其生物学活性研究对检测分析鸡各种组织和器官中gAPN的分布和含量,可为分析其在IBV侵染细胞中的生物学作用及阐明该病的发病机制提供理论依据。
[参考文献]
[1]Look A T, Ashmun R A, Shapiro L H, et al. Human myeloid plasma membrane glycoprotein CD13 (gp150) is identical to aminopeptidase N[J]. J Clin Invest, 1989, 83(4): 1299-1307.
[2]陈汉阳.鸡传染性支气管炎病毒感染HeLa细胞的研究及其天然受体的鉴定[D].武汉:华中农业大学, 2007.
[3]Tresnan D B, Holmes K V. Feline aminopeptidase N is a receptor for all group I oronaviruses[J]. Adv Exp Med Biol, 1998, 440: 69-75.
[4] Winter C, Herrler G, Neumann U. Infection of the tracheal epithelium by infectious bronchitis virus is sialic acid dependent [J]. Microbes Infect, 2008, 10(4): 367-373.
[5]De Groot R J. Structure, function and evolution of the hemagglutinin-esterase proteins of corona- and toroviruses[J]. Glycoconj J, 2006, 23(1-2): 59-72.
[6]明晓波.鸡APN组织定量、表达及其作为IBV受体可能性评价[D].哈尔滨:东北农业大学, 2009.
[7]王明翠,任晓峰,李广兴.缺失信号肽和跨膜区的PRRSV GP5融合蛋白基因的表达[J].中国兽医科学, 2010, 40(4): 342-346.
[8]Semenza G. Anchoring and biosynthesis of stalked brush border membrane proteins: glycosidases and peptidases of enterocytes and renal tubuli[J]. Annu Rev Cell Biol, 1986(2): 255-313.
[9]Look A T, Ashmun R A, Shapiro L H, et al. Human myeloid plasma membrane glycoprotein CD13 (gp150) is identical to aminopeptidase N[J]. J Clin Invest, 1989, 83(4): 1299-1307.
[10]Delmas B, Gelfi J, L'Haridon R, et al. Aminopeptidase N is a major receptor for the entero-pathogenic coronavirus TGEV[J]. Nature, 1992, 357(6377): 417-420.
[11]Li B X, Ge J W, Li Y J. Porcine aminopeptidase N is a functional receptorforthe PEDVcoronavirus[J].Virology,2007,365(1):166-172.
[12]Yeager C L, Ashmun R A, Williams R K, et al. Human aminopeptidase N is a receptor for human coronavirus 229E[J]. Nature, 1992, 357(6377): 420-422.
[13]Tusell S M, Schittone S A, Holmes K V. Mutational analysis of aminopeptidase N, a receptor for several group 1 coronaviruses, identifies key determinants of viral host range[J]. J Virol, 2007, 81 (3): 1261-1273.
[14]Reguera J, Santiago C, Mudgal G, et al. Structural bases of coronavirus attachment to host aminopeptidase N and its inhibition by neutralizing antibodies[J]. PLoS Pathog, 2012, 8(8): e1002859.
[15]Wentworth D E, Holmes K V. Molecular determinants of species specificity in the coronavirus receptor aminopeptidase N (CD13): influence of N-linked glycosylation[J]. J Virol, 2001, 75(20): 9741-9752.
[16]Costa T, Chaves A J, Valle R, et al. Distribution patterns of influenza virus receptors and viral attachment patterns in the respiratory and intestinal tracts of seven avian species[J]. Vet Res, 2012, 43(1): 28.
作者简介:李广兴(1968-),男,教授,博士,博士生导师,研究方向为动物病理学。E-mail: ligx@neau. edu. cn
基金项目:国家自然科学基金项目(31172295,31272569);黑龙江省自然科学基金项目(ZJN0702-01)
收稿日期:2014-02-27
文章编号:1005-9369(2015)02-0024-08
文献标志码:A
中图分类号:S852.23
