错构瘤性息肉病变的CT小肠造影表现及病理基础
2015-11-09唐永华赵雪松费晓春
陈 颖 缪 飞 唐永华 赵雪松 费晓春
胃肠道息肉存在多种病理类型,其中错构瘤性的息肉较少见,包括孤立性错构瘤性息肉和多发错构瘤性息肉病。本文回顾性分析27例错构瘤性息肉病变的临床特点、CT表现及影像病理联系,旨在提高对此病的认识和影像诊断水平。
方 法
1. 一般资料
收集2010年2月至2014年9月瑞金医院经手术病理证实的胃肠道错构瘤性息肉病变共27例(男15例,女12例),年龄7~70岁(41.3±21.6岁)。临床症状包括腹痛、腹泻、血便、贫血、营养不良等。其中,Peut-Jeghers综合征(PJS)11例,均出现口腔、唇黏膜或指/趾端皮肤黑色素斑,部分出现贫血、低蛋白、浮肿,有家族史者3例。Cronkhite-Canada综合征(CCS)3例,出现双手掌指面颜色变黑,口唇黑色素斑 ,双手、双脚指/趾甲变薄、脱落,头发、眉毛脱落及营养不良等症状。胃肠道孤立性息肉13例。
2. CT小肠造影检查
27例均行CT小肠造影检查,检查设备为GE公司64排light-speed螺旋CT和High Definition CT。方法是:检查前一天少渣饮食,晚饭后禁食并口服硫酸镁导泻。检查当天空腹,口服2.5%甘露醇1500~2000ml,40~60mon喝完。检查前10min静脉注射20mg 山莨菪碱(654-2)(禁忌证者除外),再口服500ml2.5%甘露醇后即刻检查。扫描分平扫、小肠动脉期(腹主动脉FOV自动触发)、肠壁期(小肠动脉期后延迟30s)。原始图像1.25mm重建,至工作站进行MIP、MPR等后期处理。
3. 病理检查
手术切除标本经4%甲醛固定,包埋,常规石蜡包埋,切片HE染色,Leica显微镜观察。
4. CT图像分析
由两名具有胃肠道影像经验的医生分别对图像进行分析,观察病变部位,息肉数目、大小、轮廓、密度,并发症等,各自做出独立诊断,对诊断不一致的商讨后得出一致结论。
5. 统计学处理
统计数据均应用SPSS17.0统计软件进行统计分析。计量资料用均数±标准差表示,计数资料用率表示。计数资料均列为四格表资料,采用Fisher确切概率法进行两两比较。定义P<0.05为差异有统计学意义。
结 果
1. 息肉部位及数量
27例错构瘤性息肉病变可累及从胃到直肠的各个消化段。PJS和CCS胃肠道息肉均多发,息肉从数十个到难以计数,累及多个消化段。孤立性息肉每例可出现1~4个息肉,其中单发息肉7例,2、3、4个息肉各出现2例,病变多位于结肠,共11例。几种错构瘤性息肉病变的发病部位及例数见表1。

表1 错构瘤性息肉病变发病部位及例数
2. CT小肠造影表现
胃肠道息肉大小不等,差异较大。最小1~2mm,最大者直径约66mm,位于十二指肠。小息肉无蒂,表面光整,密度均匀。大息肉表面多不光整,呈分叶状、乳头状改变(图1~5),可出现长蒂、亚蒂。部分密度不均匀,增强扫描息肉强化明显(图1~5)。息肉内出现沙砾状、点状低密度区5例(图2)。7例息肉中央见“树枝状轴心”(图3),平扫及增强均为相对低密度,这些息肉直径2~6cm,平均(3.6±1.4)cm。5例可见供血动脉增粗,进入息肉内(图2~4),这些息肉直径范围2.2~6.6cm,平均(4.1±1.8)cm。这5例息肉的部位及供血动脉分别为1例胃窦部息肉—胃右动脉,1例十二指肠息肉—胃十二指肠上动脉,3例小肠息肉—肠系膜上动脉分支。并发肠套叠PJS10例,孤立性错构瘤2例。肠套叠可见“同心圆征”和肠系膜血管包埋其中的“血管卷入征”(图1,4)。致肠套叠的息肉直径1.6~4.5cm,平均(3.1±1.4)cm。本组PJS出现肠套叠的概率与CCS和孤立性息肉比较,P值分别为0.011和0.001,差异具有统计学意义。1例CCS回肠末端及盲肠部多发息肉,几乎填塞肠腔,但未引起肠套叠或肠梗阻(图5)。
3. 病理表现
27例中,手术13例,内镜检查并内镜下息肉摘除手术14例。镜下所见:病变组织呈分枝乳头状,平滑肌伸入腺体形成圣诞树样结构,中央可见平滑肌束轴心,腺体增生,腺腔大小不一,腺上皮排列规则,细胞无明显异型(图3),间质内较多淋巴细胞、浆细胞及嗜酸性粒细胞浸润。错构瘤性息肉伴轻或中度上皮内瘤变3例,有腺瘤变趋势1例。错构瘤性息肉同时合并腺瘤性息肉4例,合并直肠绒毛管状腺瘤伴高级别上皮内瘤变1例,合并结肠腺癌2例。本组4例内镜活检组织病理为增生性息肉或绒毛管状腺瘤,但手术切除标本证实均为错构瘤性息肉。
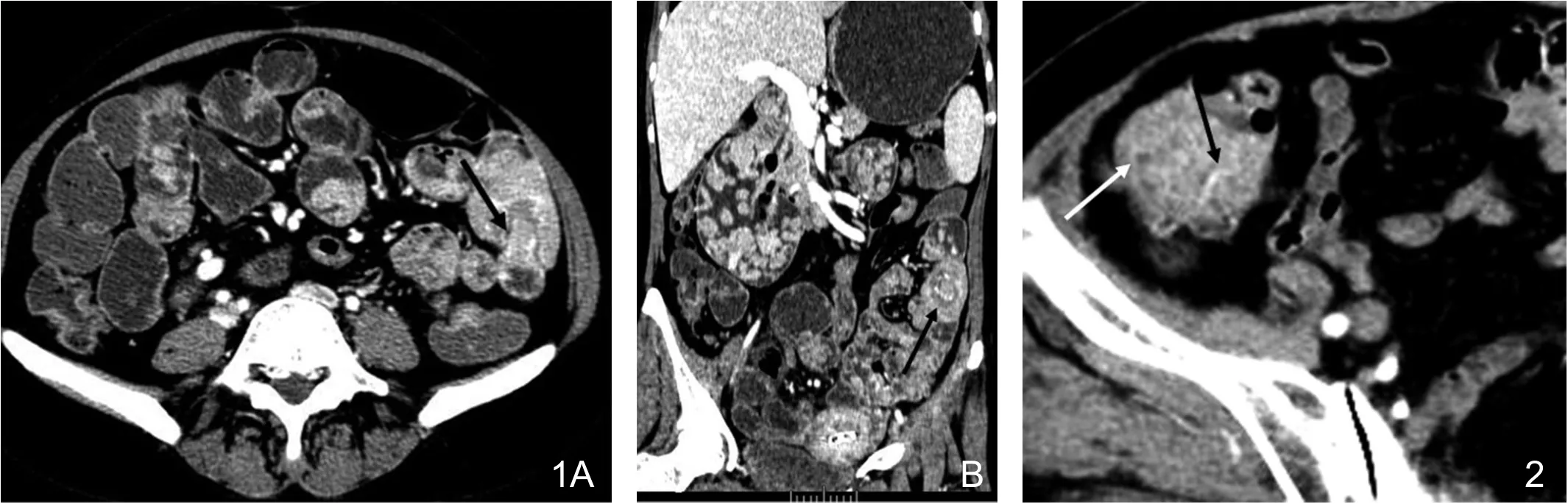
图1 Peutz-Jeghers综合征伴套叠。A.小肠多发息肉,大小不等,强化明显,降结肠套叠(黑箭);B.冠状面重建,显示十二指肠、空肠、回肠内多发息肉,小息肉表面光整,大息肉呈分叶状,降结肠套叠,见“同心圆征”(黑箭)。图2 孤立性错构瘤性息肉,盲肠息肉,强化明显,见多发沙砾状、点状低密度影(白箭),供血动脉增粗并进入息肉,为肠系膜上动脉分支(黑箭)。
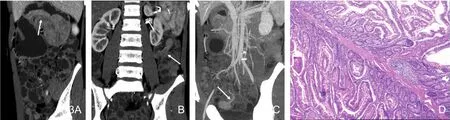
图3 Peutz-Jeghers综合征。A.十二指肠巨大息肉,约6cm×6.6cm,见低密度树枝状轴心(箭),小肠多发小息肉;B.空肠带蒂息肉,表面光整,密度均匀,强化明显,中央见低密度轴心(箭);C.冠状面MIP重建图像,显示回肠息肉供血动脉为肠系膜上动脉分支(箭);D.病理示黏膜肌层平滑肌伸入腺体,形成平滑肌束轴心,黏膜腺体增生,多数腺体杯状细胞丰富,形态无异型。(HE染色 ×100)。

图4 Peutz-Jeghers综合征伴套叠。A.息肉分叶状,强化明显,根部见供血动脉(箭),近端肠腔扩张积液,肠套叠;B.肠套叠,见“同心圆征”(箭),近端肠管扩张积液。图5 Cronkhite-Canada综合征。A.小肠、结肠多发息肉,回肠末段及回盲部息肉几乎阻塞肠腔(箭),未引起肠套叠或梗阻;B.患者指甲萎缩、灰黄,甲床破坏,以远端为主(黑箭),手背及手指伸侧多发大小不等的色素斑(白箭)。
讨 论
胃肠道息肉的组织病理类型包括肿瘤性息肉和非肿瘤性息肉。肿瘤性息肉,即腺瘤性息肉,又称腺瘤。非肿瘤性息肉分为增生性息肉、炎性息肉、错构瘤性息肉等[1]。错构瘤性息肉是在发育中出现错误而形成的肿瘤,可以是正常组织的异构现象,也可是非肿瘤性局限性肿瘤样增生,包括以异常和紊乱方式排列的正常组织。病理上息肉由黏膜肌层的平滑肌纤维为基质和分化良好的腺体及潘氏、杯状、嗜铬细胞异常混合构成,形成树枝样结构,黏膜与平滑肌核心保持正常的黏膜和黏膜肌层关系。胃肠道1~10个息肉称孤立性息肉病变,多于10个息肉病变者为息肉病。以错构瘤息肉为主的息肉病有PJS、CCS等。
1. 临床特点及检查方法
PJS为伴有黏膜、皮肤色素沉着的全胃肠道多发性息肉性疾病,主要是错构瘤性息肉,属常染色体显性遗传病。黑色素斑是本病的主要特征之一,多见于口唇、口腔黏膜和手足掌侧等处。本组11例PJS均出现色素斑沉着,多位于口唇,少数位于指/趾端皮肤。3例(3/11)存在PJS家族史。PJS发生全身其他部位肿瘤的风险高,可能与抑癌基因丝氨酸/苏氨酸蛋白激酶(STKll/LKBl)基因突变有关[2]。CCS也称之为胃肠道息肉-色素沉着-秃发-指(趾)甲萎缩综合征。罕见,多见于30岁以上成年人,为非遗传性,可能为自身免疫性炎症性疾病[3],以皮肤和胃肠道上皮病变为特征。包括脱发、指(趾)甲萎缩、色素沉着外胚层三联征。胃肠道改变一般以错构瘤息肉为主,消化腺体分泌异常,吸收障碍,表现为慢性腹泻、腹部不适。孤立性错构瘤性息肉主要症状为血便、黑便、腹痛等,无特异性。
由于一些错构瘤性息肉的黏膜下层、固有层、肌层或浆膜层可能有异位的上皮组织,可导致腺癌或癌变的发生。对多发性息肉、有家族病史的,需定期随访复查。内镜可直观地观察肠腔内息肉,并取得组织进行病理学检查,但无法观察到肠腔外病变。CT小肠造影使胃、小肠、结肠充盈阴性对比剂并充分扩张后CT增强扫描,可很好地观察肠腔内外病变,了解病变部位、数量、息肉大小、形态、肠周病变及腹腔其他脏器的情况,并具有无创性,患者依从性高等优点,是发现疗效评价、随访的很有价值的检查手段[4]。
2. CT小肠造影表现
2.1 小息肉表现:小息肉直径为数毫米至2~3cm,多为圆形、椭圆形,无分叶。小息肉多数无蒂,表面光整,密度均匀,强化明显。息肉质地较软,一般不影响肠道的蠕动及形态,很少发生肠套叠。CCS多为数毫米的小息肉,呈弥漫分布,部分节段的胃肠道黏膜皱襞增粗、肥厚,CT上可清晰显示增大的黏膜皱襞,但结节状息肉显示不明显,此种表现有别于其他类型的息肉病变,有一定特异性。
2.2 大息肉表现:大息肉直径往往大于2~3cm,本组最大息肉约6.6cm。形态呈分叶状、乳头状,有蒂或无蒂。密度往往不均匀,强化明显。部分息肉内可出现沙砾状、点状低密度区,病理基础为:增生的黏膜层富含杯状细胞,分泌大量黏液,含有黏液的腺泡在CT增强后显示为点状低密度影。较大息肉内可出现“树枝状轴心”,表现为息肉中央条状低密度影,并向主干两侧延伸,呈树枝状改变,CT增强显示更加清晰。其病理基础是肠壁的黏膜肌层伸入息肉内形成圣诞树样结构,中央为平滑肌束轴心,表面为增生的黏膜腺体[5],增强后息肉强化明显,相对低密度的平滑肌束即形成“树枝状轴心”。此征象本组出现7例,多为较大息肉,直径为(3.6±1.4)cm。此征象国内外文献仅见一篇报道[6],其作者指出平滑肌轴心平扫为高密度,增强亦为高密度,与本研究结论不一致。由于此种征象报道极少,是否存在普遍性和特异性还需进一步研究。息肉强化明显,血供丰富,可见供血动脉充血,并进入息肉内,此征象本组出现5例。有文献报道息肉周围的肠管可因缺血而致肠壁水肿强化减低[7],本组未出现此征象,分析原因可能为病变发展缓慢致周围肠管血供得到代偿而“盗血现象”不明显。
2.3 肠套叠:肠套叠的解剖学基础有3层肠壁组成,外壁为鞘部,套入部由最内壁和返折壁组成。当套叠的肠管与CT扫描垂直时,表现为“同心圆征”,套叠的肠管中可见肿块。如肠系膜血管进入套叠肠管中,当CT扫描平面与肠套叠平行时,呈现“血管卷入征”。套叠肠管内常可见不规则条状脂肪影,为卷入的肠系膜脂肪。成人肠套叠多继发于肠道占位性病变,有学者研究显示,肠息肉约占肠套叠病因的16.2%[8]。本组研究显示引起肠套叠的息肉直径多较大,息肉直径(3.1±1.4)cm。其中,PJS组10例(10/11)出现肠套叠,其发生率高于CCS和孤立性息肉(P<0.05)。分析原因:PJS肠道息肉数量多,在多发息肉的肠段,肠蠕动功能受限,当远端出现较大息肉时易发生肠套叠。而孤立性息肉组息肉数量少,且质地软,相对不宜发生套叠,CCS组肠道息肉虽多发,但体积较小,发生肠套叠概率低。本组1例CCS回肠末端及盲肠部多发息肉,几乎填塞肠腔,但未引起肠套叠或肠梗阻。当套叠时间较长不能回纳可发生肠梗阻。
2.4 息肉癌变:错构瘤性息肉发生癌变的概率较低,癌变与息肉大小、数量、外形及分布的部位有关。体积越大,息肉数目越多、越密,癌变机会越大,广基息肉癌变率高于带蒂息肉,直肠息肉恶变率最高,之后依次为乙状结肠、降结肠、横结肠、升结肠和回盲部。如随访过程中息肉明显增大、增宽,息肉表面出现溃疡,基底部浸润生长,肠壁分层消失,肠周淋巴结、远处转移等提示息肉恶变。本组由于随访时间较短未出现息肉癌变,但2例合并结肠腺癌。
3. 鉴别诊断
3.1 孤立性错构瘤性息肉与其他类型息肉的鉴别:
息肉不同病理类型的影像学鉴别较为困难,但一些特点可有助于诊断:如炎性息肉为溃疡性结肠炎、Crohn病、肠结核等炎性病变引起的炎性肉芽肿伴腺体增生,为良性病变,一般体积较小,发生息肉区域的肠壁有炎症性改变,可有助于鉴别。腺瘤性息肉尤其是绒毛状腺瘤,易发生恶变,息肉表面呈分叶状,宽基底,多数不带蒂,可侵犯肠壁周径一半以上,甚至环形受累,与正常肠管分界不清。
3.2 PJS、CCS与几种息肉病综合征之间的鉴别:
多种疾病都可出现胃肠道多发息肉。幼年性息肉也为错构瘤性质,30%为多发,好发于2~7岁儿童,多见于结肠,为一种良性自限性病变。息肉直径多0.5~1cm,多有蒂,表面光滑,不分叶。与PJS的息肉不同,后者多只有大的息肉才有蒂,且常呈分叶状,常伴发肠套叠。另外,一些息肉病综合征以腺瘤性息肉为主,主要有以下几种:①家族型腺瘤性息肉病。为常染色体显性遗传,常在大肠呈多发性地毯式分布,息肉最多可达3000个以上,具有高度恶变倾向。②Gardner综合征。除结肠多发息肉外,会出现头面部骨瘤及软组织肿瘤,包括牙齿异常、皮脂腺囊肿、硬纤维瘤、脂肪瘤、结肠外恶性肿瘤等。③Turcot综合征。患者肠道多发息肉合并中枢神经系统肿瘤,可出现牛奶咖啡斑。胃肠道多发息肉只是息肉病综合征的一部分表现,仅从这方面入手,鉴别诊断困难,故诊断时,需结合临床表现、家族史、其他合并病变等,方可做出正确诊断。
综上所述,CT小肠造影能很好的显示胃肠道息肉性病变,特别对多发性小肠息肉、息肉供血动脉及肠套叠的显示。息肉中央出现“树枝状轴心”和息肉内沙砾样低强化影,可能为错构瘤性息肉较特异的征象,仍需进一步研究证实。此外,息肉病综合症需密切结合临床相关病史,方可提高诊断的准确性。
