pH梯度结合逆相蒸发法制备黑米麸皮花青素脂质体的研究
2015-11-08牛文慧冯所兰周淅赟张薇娜孔令艳
牛文慧,冯所兰,周淅赟,张薇娜,刘 琴,孔令艳
(南京财经大学食品科学与工程学院,江苏高校粮油质量安全控制及深加工重点实验室,江苏省现代粮食流通与安全协同创新中心,江苏南京210023)
pH梯度结合逆相蒸发法制备黑米麸皮花青素脂质体的研究
牛文慧,冯所兰,周淅赟,张薇娜,刘琴*,孔令艳
(南京财经大学食品科学与工程学院,江苏高校粮油质量安全控制及深加工重点实验室,江苏省现代粮食流通与安全协同创新中心,江苏南京210023)
以大豆卵磷脂和胆固醇混合物为壁材,采用pH梯度结合逆相蒸发法制备黑米麸皮花青素脂质体,利用单因素实验,得到影响花青素脂质体包封率的三个显著性因素:大豆卵磷脂与胆固醇摩尔比(nSPC/nCH)、有机相与水相体积比(VOP/VAP)和磷酸缓冲液浓度(mmol/L)。根据中心组合(Box-Behnken)实验设计原理,采用响应面分析法对花青素脂质体的制备工艺进行了优化,结果得到花青素脂质体最佳制备工艺参数为:nSPC/nCH=3.29/1,VOP/VAP=3.16/1,磷酸缓冲液浓度为5.21 mmol/L。在最优条件下进行验证实验,得到花青素脂质体包封率达54.97%,所制备的花青素脂质体平均粒径为234 nm,Zeta电位为-25.0 mV。
花青素,脂质体制备,包封率,响应面
花青素(anthocyanidin)是一类广泛存在于植物中的水溶性天然色素,具有较强的抗氧化性和抗肿瘤[1-2]、抗心血管疾病[3]、保护视力[4]、减轻肝损伤[5],预防糖尿病等生理活性[6-7]。然而,相比较其他的黄酮类化合物如原花色素等,花青素的稳定性较差,容易受温度、pH、光照、金属离子等外在因素的影响而发生降解或氧化[8],加之脂溶性较差,分子量较大,花青素在体内的生物可利用率不容乐观[9-10],如何增加花青素的稳定性、提高花青素的生物可利用率成为近年来对花青素的研究热点。
脂质体作为一种以磷脂为壁材形成稳定的双分子层结构,与细胞的磷脂双分子膜具有良好的生物相容性,可以与胃肠粘膜细胞发生融合、胞饮和吞噬作用,从而提高芯材的稳定性及体内吸收率[11-13]。随着近年来对黄酮类化合物的生物可利用度的关注,利用脂质体包封技术提高黄酮类化合物的稳定性及活性也成为人们感兴趣的研究,相关报道也逐渐增多[14-17]。王海刚等[18]研究表明,脂质体包埋葛根素可提高葛根素脂质体的口服生物利用度。有关研究表明利用脂质体包埋技术也可提高花青素的生物活性,如Amir等[19]在研究中发现,氯化矢车菊素脂质体比游离的氯化矢车菊素能够更好地治疗铜绿假单胞菌感染,而且它的生物利用率达到100%。Hwang等[20]报道了花青素脂质体对黑色素细胞的抑制作用,结果表明脂质体包封花青素增强了花青素的稳定性和抑制黑色素的形成。但在他们的研究中花青素脂质体的制备均采用普通的薄膜分散法,这种方法首先要将花青素溶解在pH7.4的缓冲溶液,而在这一pH条件下花青素本身的稳定性就很差。赵圣书等[21]报道了黑加仑花色苷脂质体的制备,但同样他们采用的也是普通的薄膜分散法。考虑到花青素在pH小于2的条件下比较稳定,本研究采用pH梯度结合逆相蒸发法进行脂质体的制备,即在制备过程中控制脂质体内水相的pH为2,外水相的pH为中性,这样既保证了包埋在内水相的芯材的稳定性,又能保证外水相的中性pH条件有利于脂质体本身的稳定。而逆相蒸发法可包裹较大的水容积,适用于包埋水溶性大分子生物活性物质。本文以大豆卵磷脂(SPC)和胆固醇(CH)为壁材,以包封率为考察指标,首先对黑米麸皮花青素脂质体的制备进行了单因素条件优化,在此基础上根据Box-Behnken实验设计原理,采用三因素三水平的响应面分析法对各个因素的显著性和交互作用进行研究,最终确定了制备花青素脂质体的最佳工艺条件。
1 材料与方法
1.1材料与仪器
黑米原料2013年8月购于南京苏果超市,产地江苏;胆固醇国药集团化学试剂有限公司;大豆卵磷脂德国Lipoid公司;AB-8大孔树脂天津市海光化工有限公司;其他分析纯试剂均购于中国国药集团化学试剂有限公司。
Allegra 64R高速冷冻离心机美国Beckman公司;FD-STD冷冻干燥机美国Labconco公司;Milli-Q Academic超纯水系统美国Millipore公司;Nano-ZS90粒度仪英国马尔文公司;N-1100D-WD旋转蒸发仪日本东京理化;UV-3900紫外可见分光光度计日本日立公司;SHA-B水浴恒温振荡器金坛市荣华仪器公司;JNMJ3型检验碾米机浙江台州市粮仪厂;SB25-12超声波清洗机宁波新芝生物科技股份有限公司;FW-100高速万能粉碎机天津市华鑫仪器厂。
1.2黑米麸皮花青素的提取纯化
黑米麸皮花青素的提取采用本实验室建立的方法[22]:用碾米机将黑米的麸皮分离出来,并用高速万能粉碎机粉碎后过80目筛,再用索氏抽提法除油,然后用甲醇/1 mol/L盐酸溶液(70/30,V/V)在水浴恒温振荡器中25℃振荡萃取2 h,用布氏漏斗抽滤后所得滤液再经冷冻离心机于18000 r/min条件下离心20 min,上层清液在40℃下真空旋转蒸发浓缩至10~20 mL,然后用AB-8大孔树脂柱分离纯化。纯化方法为:先用pH2的水洗掉糖类等水溶性杂质,然后依次用20%和40%乙醇洗脱花青素,直至色谱柱的颜色褪去,合并20%及40%乙醇的洗脱液,用旋转蒸发仪在40℃下将洗脱液浓缩至干,再用pH为2的去离子水复溶,然后进行冷冻干燥,得到黑米麸皮的花青素冻干粉。该花青素冻干粉经液相色谱测定含矢车菊素3-O-葡萄糖苷达90%以上。
1.3花青素脂质体的制备
由于花青素在pH2的酸性条件下较稳定,故本研究采用pH梯度结合逆向蒸发法制备脂质体[23-24],具体如下:分别称取适量大豆卵磷脂、胆固醇,置于茄型瓶中,加入氯仿溶解,再在25℃下旋转蒸发去除氯仿,直至瓶内壁上形成一层均匀的浅黄色膜脂,用乙醚将膜脂溶解。称取黑米麸皮花青素溶于pH为2的盐酸溶液,并将其加入茄形瓶中,将此两相体系在超声仪上短时间歇(每30 s间歇10 s)超声,直至形成稳定的W/O型乳剂。继而于25℃旋转蒸发去除有机溶剂,直至瓶壁上的凝胶脱落,然后再继续蒸发5 min,得到均匀的脂质体混悬液。再用pH为7的磷酸盐缓冲液将其水合,并调至合适浓度后,用0.45 μm滤膜过滤,得到花青素脂质体混悬液。
1.4脂质体包封率及粒径分布测定
1.4.1花青素标准曲线的建立精确称取一定量黑米麸皮花青素冻干粉,用甲醇/1 mol/L盐酸溶液(70/30,V/V)溶解,配制浓度为0.05 mg/mL的贮备液。将储备液用甲醇/1 mol/L盐酸溶液(70/30,V/V)稀释至不同浓度的系列标准溶液,在525 nm处用紫外可见分光光度计测定吸光度A值。以花青素(mg/mL)浓度为横坐标,吸光度为纵坐标,建立标准曲线,并进行回归分析,在浓度为0.001~0.05 mg/mL的范围内得标准曲线回归方程为y=28.405x+0.005,R2=0.9996。
1.4.2包封率的测定由于花青素在pH7.0的条件下不稳定,因此采用甲醇/1 mol/L盐酸溶液(70/30,V/V)破乳对花青素脂质体进行包封率的测定。具体如下:取适量花青素脂质体混悬液置于冷冻离心机中在转速为18000 r/min下冷冻离心30 min,移除上清液,并用pH7.0的磷酸缓冲液清洗两次,加入一定体积的甲醇/酸溶液将底部的脂质体溶解,并超声波振荡5 min,将脂质体破乳,测定溶液在525 nm处的吸光度值,根据标准曲线回归方程得出包入脂质体花青素的浓度Ce。按下式计算包封率:
包封率(EE,%)=(脂质体中花青素的质量/起始加入花青素的质量)×100=(Ce×V/m)×100
式中:V为花青素稀释到合适浓度时的体积;m为花青素制备过程中起始加入的黑米花青素的质量。
1.4.3粒径及分布范围测定用浓度为5 mmol/L pH为7.0的磷酸缓冲液稀释花青素脂质体混悬液,直至其可被光透过,取适量混悬液于样品池中,用Malvern粒度仪Nano-ZS90对其粒径及分布范围进行测定,每个样品测定3次取平均值。测定条件如下:测试温度为25℃,黏度为0.8872Cp。
1.5花青素脂质体制备工艺优化
1.5.1单因素实验设计按照1.4中的脂质体制备方法,以包封率为指标,分别对大豆卵磷脂与胆固醇摩尔比(nSPC/nCH)、有机相(溶解大豆卵磷脂和胆固醇的乙醚)与水相(溶解花青素的溶液)体积比(VOP/VAP)、大豆卵磷脂与花青素质量比(WSPC/WAC)及水合用pH7.0的磷酸缓冲液浓度进行单因素考察。在进行单因素实验时,固定有机相与水相体积比3∶1、大豆卵磷脂与花青素质量比30∶1、磷酸缓冲液浓度5 mmol/L、大豆卵磷脂与胆固醇摩尔比3∶1四个因素中的三个,考察另外的一个因素对脂质体包封率的影响。对每个单因素进行三次平行实验。
1.5.2响应面分析根据单因素显著性分析结果,确定影响花青素脂质体包封率的主要因素是nSPC/nCH、VOP/VAP和磷酸缓冲液浓度(mmol/L),根据Box-Behnken的中心组合实验设计原理,分别以X1、X2和X3来表示,每一个因素的低、中、高实验水平分别以-1、0和1进行编码。以花青素脂质体的包封率(Y)为响应值,实验因素水平编码如表1所示。

表1 实验设计因素水平及编码Table 1 Independent variables levels and codings in design
1.6数据分析
响应曲面的回归方程计算和显著性检验通过Design Export V.8.0.6软件进行分析,系数的显著性检验采用t检验和p值进行分析。
2 结果与分析
2.1单因素考察结果
2.1.1nSPC/nCH对花青素脂质体包封率的影响因为黑米麸皮中花青素的成分比较简单,主要为矢车菊素-3-葡萄糖苷[25],因此本研究选用了黑米麸皮花青素提取物为花青素原料。大豆卵磷脂和胆固醇是脂质体形成不可缺少的膜材,二者比例是影响脂质体包封率和粒径的主要因素。按照1.5.1中的实验设计,分别在大豆卵磷脂与胆固醇摩尔比为1∶1、2∶1、3∶1、4∶1、5∶1的条件下制备得到花青素脂质体,对应的包封率结果见图1。
在大豆卵磷脂加入胆固醇不仅可以改变其相变温度,对脂质膜的流动性产生双向调节功能,而且可以增加磷脂的刚性,使包封率提高。但是由于胆固醇本身并不形成双层膜结构,只能够镶嵌在双层膜中,如果胆固醇的比例过大,组成脂质体的卵磷脂添加量太少,胆固醇在双层膜中占据的空间过大,脂质体膜的形成就会困难,而且不牢固,形成的脂质体膜亲水性也会过强,造成膜容易破坏。由图1可知,在其他条件相同的条件下,随着大豆卵磷脂比例的增加,花青素脂质体的包封率先增加后减小。当大豆卵磷脂与胆固醇摩尔比为3∶1时,花青素脂质体包封率显著高于其他比例,为54.06%,说明制备花青素脂质体适宜的卵磷脂和胆固醇摩尔比为3∶1。
2.1.2VOP/VAP对花青素脂质体的包封率的影响制备脂质体过程中,若脂质体的有机相比例过低,则很难形成稳定的W/O体系,若有机相比例过高,则需较长时间的超声才可形成稳定的W/O体系,而过长时间的超声势必会导致脂质体被破坏,影响脂质体的包封率和粒径。不同VOP/VAP制备得到的花青素脂质体的包封率结果见图2。

图1 大豆卵磷脂与胆固醇摩尔比(nSPC/nCH)对包封率的影响Fig.1 Effect of nSPC/nCHon encapsulation efficiency
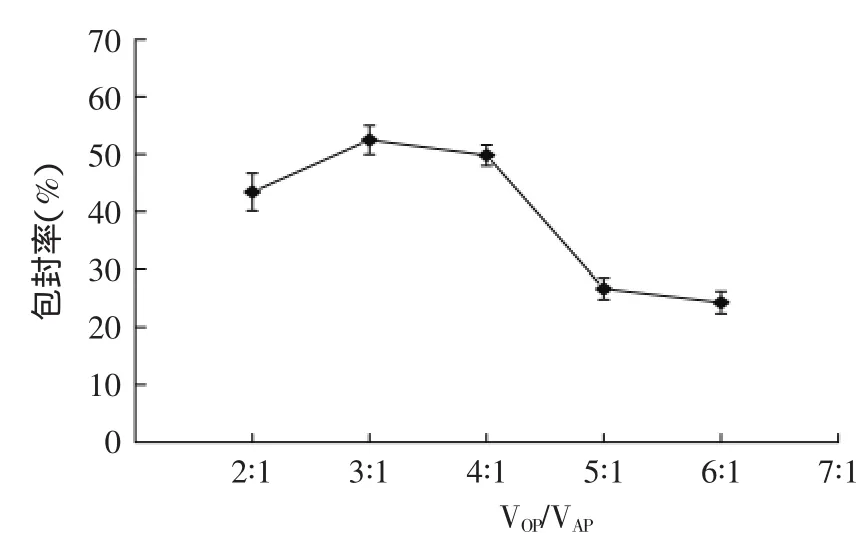
图2 有机相与水相体积比(VOP/VAP)对包封率的影响Fig.2 Effect of VOP/VAPon encapsulation efficiency
由图2可知,在其他条件相同的条件下,随着有机相比例的增加,花青素脂质体的包封率先增加后减小。当有机相和水相体积比为3∶1时,花青素脂质体包封率最高。
2.1.3WSPC/WAC对花青素脂质体的包封率的影响脂质体的囊泡有限,包埋时具有饱和性,因此并非药物浓度越高,包封率越大。而且水溶性药物被包埋于内核水相中,经常在脂质体水相和油相间重新分配,容易引起药物的泄露,所以黑米麸皮花青素的添加量直接影响脂质体的包封率。在其他条件不变的情况下,不同大豆卵磷脂与花青素质量比(WSPC/WAC)对花青素脂质体的包封率影响见图3。
由图3可以看出,当WSPC/WAC为40∶1时,花青素脂质体包封率最高,为57.03%,但当WSPC/WAC为30∶1时制备得到的脂质体平均粒径最小,而包封率为56.78%,与WSPC/WAC为40∶1时包封率接近,因此选取30∶1为适宜的大豆卵磷脂与花青素质量比。
2.1.4磷酸缓冲液浓度对花青素脂质体的包封率及粒径的影响水合时pH7.0的磷酸缓冲液浓度对花青素脂质体的包封率和粒径的影响见图4。由图4可知,磷酸缓冲液浓度5.0 mmol/L时,花青素脂质体包封率最高,为56.98%,故而选取5 mmol/L为适宜的磷酸缓冲液浓度。

图3 大豆卵磷脂与花青素质量比(WSPC/WAC)对包封率和粒径的影响Fig.3 Effect of wSPC/wACon encapsulation efficiency and size

图4 磷酸缓冲液浓度对包封率的影响Fig.4 Effect of phosphate buffer concentration on encapsulation efficiency
由以上单因素优化实验结果得到制备花青素脂质体的最优条件为:大豆卵磷脂与胆固醇摩尔比为3∶1,有机相与水相体积比为3∶1,大豆卵磷脂与花青素质量比为30∶1,磷酸缓冲液浓度为5.0 mmol/L。
2.1.5单因素实验中各因素的显著性分析单因素实验中各因素的显著性分析见表2。由表2可知,大豆卵磷脂与胆固醇的摩尔比(nSPC/nCH)和有机相与水相的体积比(VOP/VAP)对于包封率的p值均小于0.01,即这两个因素对花青素脂质体的包封率是有极显著影响的,而WSPC/WAC的影响最不显著。因此,选择大豆卵磷脂与胆固醇的摩尔比(nSPC/nCH)、有机相与水相的体积比(VOP/VAP)和磷酸缓冲液浓度进行下一步实验。
2.2响应面法优化黑米麸皮花青素脂质体制备工艺
2.2.1响应面实验设计及结果响应面实验结果见表3。

表2 各影响因素的显著性分析表Table 2 Significance analysis of various factors
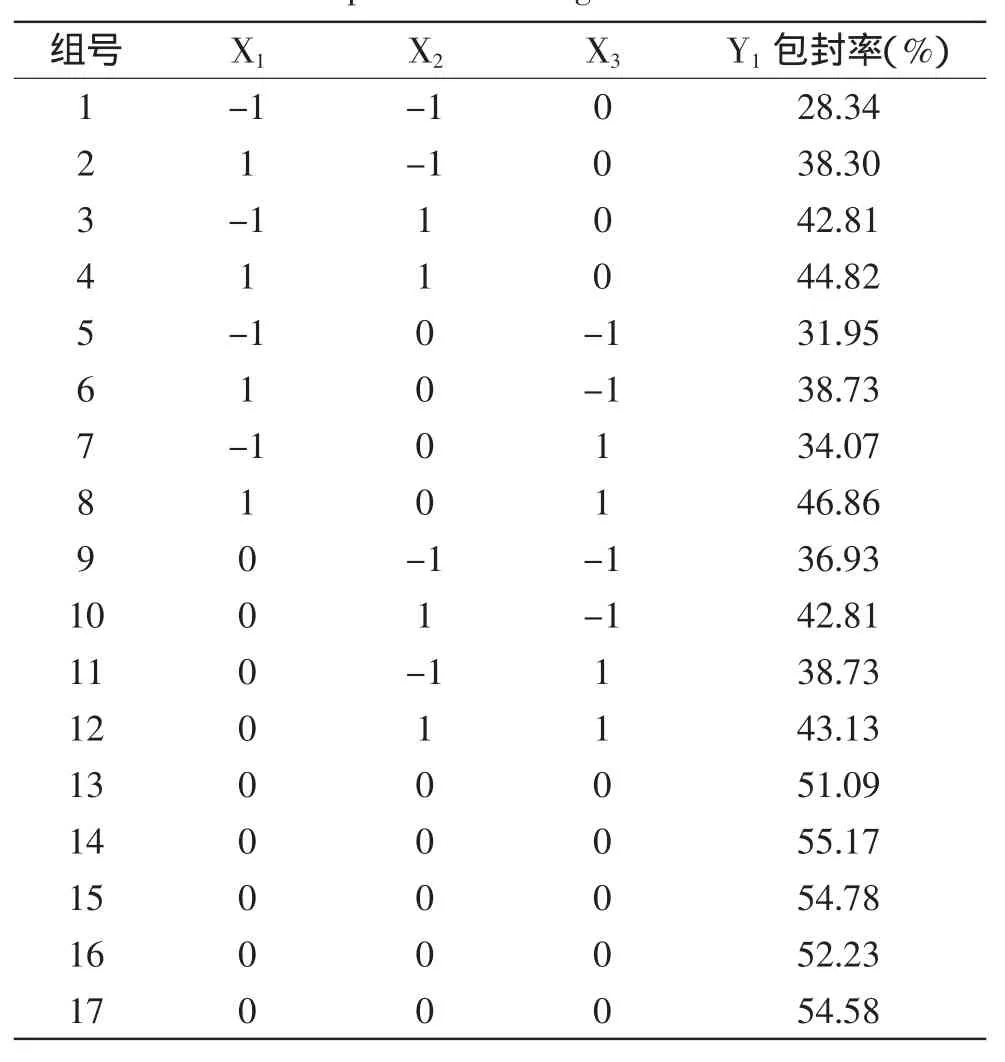
表3 响应面分析方案及结果Table 3 Experimental design and the results
2.2.2回归模型方差分析结果采用Design Export V8.0.6统计软件对表3实验数据进行多元回归拟合分析,得到自变量对响应值影响的回归方程为:Y1=53.68+ 3.94X1+3.91X2+1.55X3-1.99X1X2+1.50X1X3-0.37X2X3-8.80X12-6.31X22-6.97X32。
从表4方差分析结果可知,该回归模型的显著水平p=0.00076<0.01,表明用上述回归方程描述各因素与响应值之间的关系时,因变量和全体自变量之间的线性关系极其显著。同时,从回归方程各项的方差分析结果可以看出方程的失拟项F=1.96,在α=0.05水平上不显著,说明该模型能很好地描述实验结果,可以用此模型来分析和预测花青素脂质体的包封率。影响花青素包封率的因素按主次顺序为大豆卵磷脂/胆固醇摩尔比(X1)、有机相/水相体积比(X2)和磷酸缓冲液浓度(X3)。在各作用因素中,X1、X2、X12、X22、X32项(p<0.05)对包封率的影响是显著的,其他项p>0.05,对包封率的影响不显著。
2.2.3响应面曲面分析花青素脂质体制备工艺中大豆卵磷脂与胆固醇摩尔比(X1)、有机相与水相体积比(X2)和磷酸缓冲液浓度(X3)三个因素之间交互作用对花青素脂质体包封率的影响如图5所示。图5的A、B、C直观反映了三个因素对黑米花青素脂质体包封率的影响,极值条件出现在等高线的圆心处。比较3个图可知:大豆卵磷脂与胆固醇摩尔比(X1)对花青素脂质体包封率的影响最为显著,表现为曲线较陡。其他因素影响较小,表现为曲线较为平滑。
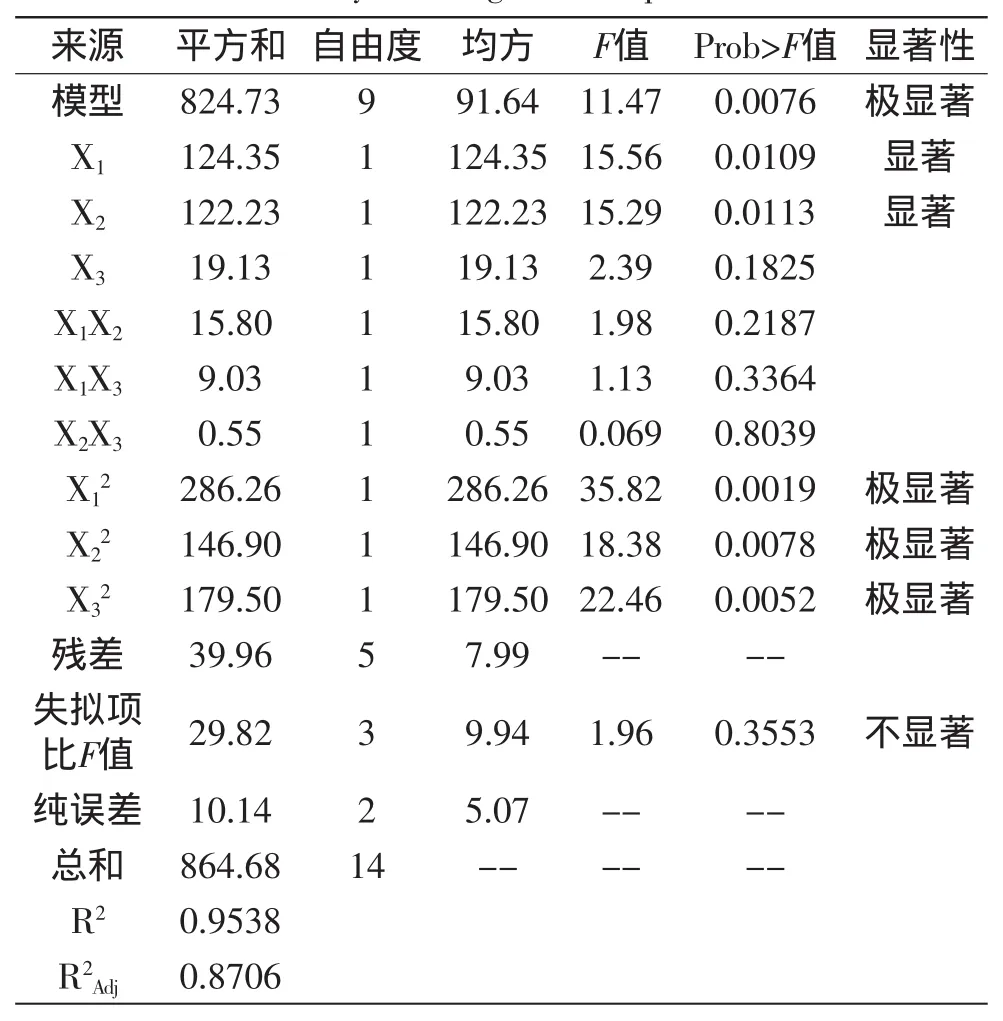
表4 回归方程系数显著性分析及回归方程模型方差分析Table 4 Significance analysis of each regression coefficient and variance analysis of regression equation matrix
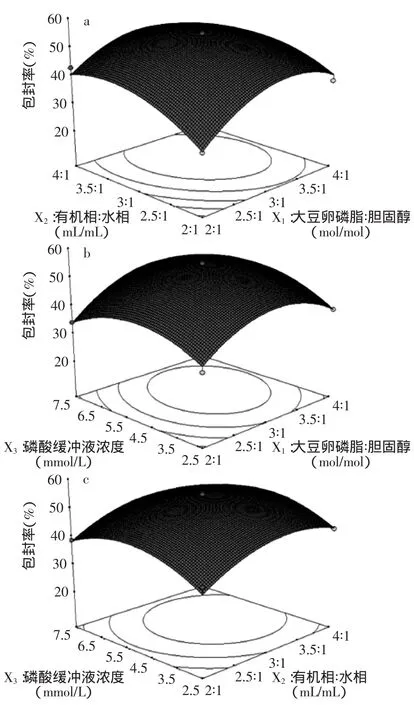
图5 各因素交互影响花青素脂质体包封率的响应曲面图Fig.5 Response surfaces of the pairwise interactive effects of three parameters on the entrapment efficiency of anthocynin liposome
2.4花青素脂质体最优条件的求证及验证
通过Design Expert 8.0.6软件求解方程,确定优化的黑米花青素纳米脂质体制备条件为:大豆卵磷脂与胆固醇摩尔比为3.29∶1、有机相与水相体积比为3.16∶1;磷酸缓冲液浓度为5.21 mmol/L,在此条件下,黑米花青素脂质体的理论包封率为56.65%。在此条件下重复3次,得到花青素脂质体的平均包封率为54.97%± 0.34%,重复性良好,实测值与理论值之间的绝对误差是-1.68%,相对误差为-2.97%,说明优化结果可靠。
2.5粒径及Zeta电位的测定
用Marwen粒径仪对最优条件下获得的脂质体的粒径和Zeta电位进行测定。结果表明,脂质体的平均粒径为234 nm,其中200~300 nm间的粒子占98.9%,多分散性指数(polydispersity index)为0.176,Zeta电位为-25.0 mV,说明通过逆相蒸发结合pH梯度法制备出的花青素脂质体混悬液是粒径较小、为具有一定稳定性的体系。
3 结论
本研究中用pH梯度结合逆相蒸发法制备花青素脂质体,通过单因素优化找出了影响脂质体包封率的三个显著因素,并根据Box-Behnken的中心组合实验设计原理通过响应面分析最终获得了黑米麸皮花青素脂质体的最佳工艺条件为nSPC/nCH=3.29∶1;VOP/VAP= 3.16∶1;磷酸缓冲液浓度5.21 mmol/L。在此条件下重复3次下进行实验得到的脂质体的包封率平均值为54.97%,脂质体的平均粒径为234 nm,Zeta电位为-25.0 mV,具有一定的稳定性。应用该方法制备得到的脂质体,既保证了被包封花青素能以稳定的2-苯基苯并吡喃型阳离子结构存在,又能使脂质体分散系具有一定的稳定性,该脂质体体系可为进一步研究花青素的生物可利用率提供模型参考。
[1]Lamy S,Lafleur R,Bedard V,et al.Anthocyanidins inhibit migration of glioblastoma cells:structure-activity relationship and involvement of the plasminolytic system[J].Journal of Cellular Biochemistry,2007,100(1):100-111.
[2]Sehitoglu M H,Farooqi A A,Qureshi M Z,et al.Anthocyanins:targeting of signaling networks in cancer cells[J].Asian Pacific Journal of Cancer Prevention,2014,15(5):2379-81.
[3]Wallace T C.Anthocyanins in cardiovascular disease[J]. Advances in Nutrition,2011,2(1):1-7.
[4]刘春民,王抗美,邹玲.花青素对近视青少年视疲劳症状及视力的影响[J].中国实用眼科杂志,2005,23(6):607-609.
[5]Hou F,Zhang R,Zhang M,et al.Hepatoprotective and antioxidant activity of anthocyanins in black rice bran on carbon tetrachloride-induced liver injury in mice[J].Journal of Functional Foods,2013(5):1705-1713.
[6]Wedick N M,Pana A,Cassidy A,et al.Dietary flavonoid intakes and risk of type 2 diabetes in US men and women[J]. American Journal Clinical Nutrition,2012,95(4):925-933.
[7]He J,Giusti M M.Anthocyanins:natural colorants with health-promoting properties[J].Annual Review of Food Science and Technology,2010(1):163-187.
[8]Wei D W,Shi Y X.Degradation kinetics ofanthocyanins in blackberry juice and concentrate[J].Food Engineering,2007(82):271-275.
[9]Fernandes I,Faria A,Calhau C,et al.Bioavailability of anthocyanins and derivatives[J].Journal of Functional Foods,2014(7):54-66.
[10]Yang M,Koo S I,Song W O,et al.Food matrix affecting anthocyaninbioavailability:review[J].CurrentMedicinal Chemistry,2011,18(2):291-300.
[11]Gao H,Zhang Q,Yu Z,et al.Cell-penetrating peptidebased intelligent liposomal systems for enhanced drug delivery[J].Current Pharmaceutical Biotechnology,2014,Jun 16:[Epub ahead of print].
[12]Park J,Wrzesinski S H,Stern E,et al.Combination delivery of TGF-β inhibitor and IL-2 by nanoscale liposomal polymeric gels enhances tumour immunotherapy[J].Nature Materials,2012,11(10):895-905.
[13]Ghosh D,Ghosh S,Sarkar S,et al.Quercetin in vesicular delivery systems:evaluation in combating arsenic-induced acute liver toxicity associated gene expression in rat model[J].See comment in Pub Med Commons below Chemco-biological Interactions,2010,186(1):61-71.
[14]Mandal A K,Sinha J,Mandal S,et al.Targeting of liposomal flavonoid to liver in combating hepatocellular oxidative damage[J].Drug Delivery,2002,9(3):181-185.
[15]方建军.儿茶素纳米脂质体的制备及其对酱鸭保鲜效果的研究[D].杭州:中国计量学院,2013.
[16]范一文,鲁群,李地才,等.茶多酚脂质体的制备和物化性质研究[J].现代食品科技,2011,27(10):1187-1191.
[17]马宁,濮少杰,李锋,等.茶多酚脂质体的制备[J].食品科学,2012,33(20):16-20.
[18]王海刚,翟光喜,吕青志,等.壳聚糖包覆葛根素脂质体的制备及理化性质考察[J].中药材,2007,30(1):89-92.
[19]Gharib A,Faezizadeh Z,Mesbah-Namin S A.In vitro and in vivo antibacterial activities of cyanidinum chloride-loaded liposomes against a resistant strain of pseudomonas aeruginosa[J].Planta Medica,2013,79:15-19.
[20]Hwang J M,Kuo H C,Lin C T,et al.Inhibitory effect of liposome-encapsulated anthocyanin on melanogenesis in human melanocytes[J].Pharmaceutical Biology,2013,51(8):941-947.
[21]赵圣书,王振宇.响应面法优化黑加仑花色苷脂质体制备工艺的研究[J].食品工业科技,2012(23):258-262.
[22]刘琴,李敏,胡秋辉.黑米麸皮与紫包菜花青素提取物的组成、抗氧化性与稳定性比较研究[J].食品科学,2012,33(19):113-118.
[23]叶鹏,宋金春,郭咸希.pH梯度法结合逆向蒸发法制备氟尿嘧啶脂质体[J].中国药师,2009,12(3):308-311.
[24]任文霞,李建科.逆相蒸发法制备茶多酚脂质体及质量评价[J].生物加工过程,2009,7(2):68-72.
[25]张芳轩,张名位,张瑞芬,等.黑米种皮中花色苷组成及含量的HPLC分析[J].中国粮油学报,2010,25(12):122-125.
Preparation of black rice bran anthocyanin liposomes by reverse-phase evaporation combing with pH gradient
NIU Wen-hui,FENG Suo-lan,ZHOU Xi-yun,ZHANG Wei-na,LIU Qin*,KONG Ling-yan
(College of Food Science and Engineering,Key Laboratory of Grains and Oils Quality Control and Processing,Collaborative Innovation Center for Modern Grain Circulation and Safety,Nanjing University of Finance and Economics,Nanjing 210023,China)
Black rice bran anthocyanin liposomes were prepared by reverse phase evaporation combining with pH-gradient technique using the mixture of soybean lecithin and cholesterol as membrane material.On the basis of the single-factor test,the molar ratio between phosphatidylcholine and cholesterol(nSPC/nCH,mol/mol),volume ratio of organic to aqueous phase(VOP/VAP)and the concentration of phosphate buffer were identified as three major factors which affected the encapsulation efficiency.The optimized conditions of anthocyanin liposomes preparation were then obtained by using three factors and three levels of response surface analysis according to central composite(Box-Behnken)experimental design principles.The results showed that the optimum parameters for the preparation of anthocyanin liposomes were found to be nSPC/nCH=3.29/1,VOP/VAP= 3.16/1,and the concentration of phosphate buffer was 5.21 mmol/L.The anthocyanin liposome prepared under this optimized condition had the encapsulation efficiency of 54.97%,the average particle size of 234 nm and the Zeta potential of-25.0 mV,which showed that the liposome was stable and suitable for further bio-available study.
anthocyanins;liposomes preparation;encapsulation efficiency;response surface methodology(RSM)
TS201.2
A
1002-0306(2015)16-0238-06
10.13386/j.issn1002-0306.2015.16.040
2014-10-29
牛文慧(1989-),女,硕士研究生,研究方向:食品科学与工程,E-mail:cherryyaoxi@163.com。
刘琴(1968-),女,博士,教授,研究方向:食品化学,E-mail:qinlin@njue.edu.cn。
江苏省高校自然科学研究重大项目(11KJA550001);江苏省高校自然科学研究面上项目(13KJB550008)。
