应用PCR-DGGE对巴氏消毒乳中腐败细菌的污染溯源研究
2015-11-08周国君王晓静朱建荣
周国君,唐 玲,胡 萍,王晓静,朱建荣,陈 韵
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵阳三联乳业有限公司,贵州贵阳550004;3.遵义医学院,贵州遵义563003)
应用PCR-DGGE对巴氏消毒乳中腐败细菌的污染溯源研究
周国君1,2,唐玲3,胡萍1,*,王晓静2,朱建荣2,陈韵1,2
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵阳三联乳业有限公司,贵州贵阳550004;3.遵义医学院,贵州遵义563003)
运用PCR-DGGE技术分析了巴氏杀菌乳从原料乳到杀菌、灌装这两个加工关键控制点的微生物动态变化和差异性,容易发生污染的环节是挤乳环节、杀菌后的加工管道和包装环节。原料乳中易携带的细菌是乳酸链球菌(Lactococcus lactis subsp.)和乳酸杆菌(Lactobacillus sp.);挤乳环节中易受无乳链球菌(Streptococcus agalactiae)污染;杀菌后的加工管道易受热杀环丝菌(Brochothrix thermosphacta)、钻黄肠球菌(Enterococcus casseliflavus)、瑞士乳杆菌(Lactobacillus helveticus)和2株非培养的假单胞菌属(Uncultured Pseudomonas sp.)污染;肉杆菌属(Carnobacterium sp.)和产乳酸菌素的肉杆菌(Carnobacterium maltaromaticum)则在挤乳环节、杀菌后的加工管道或包装环节都可能被污染。
PCR-DGGE,巴氏杀菌乳,腐败微生物,污染溯源
牛乳营养丰富,含有人体所需的全部营养素,鲜乳中有上百种营养成分,主要包括丰富的蛋白质、维生素、脂肪、乳糖、钙、镁等矿物质[1],但同时也是腐败菌的良好培养基,属高危险性的食品原料[2]。微生物会破坏牛乳的营养成分、引起牛乳变味、可能还会使巴氏杀菌失败,这些都可能危害人体健康[3]。引起乳品腐败变质的主要原因是在生产过程中污染繁殖和原料乳本身携带的微生物。原料乳中的微生物主要包括细菌、霉菌和酵母等,以细菌和真菌为主[4-5]。常见的有脂肪分解菌、乳酸菌、产气菌、胨化细菌、产碱菌等[6]。PCR-DGGE技术在分析各类食品加工过程中的微生物群落组成及动态变化方面得到了广泛的应用。
目前,关于原料乳及乳品中腐败菌的报道大多仅限于腐败菌的危害、计数检测、分离及特性等方面,而对其菌相组成和多样性的研究很少。国内尚未有关于原料乳及乳品中腐败微生物系统分析的报道,国外也很少。本研究首次采用DNA指纹技术PCR-DGGE,对巴氏消毒乳生产中的腐败微生物进行快速鉴定,揭示原料乳及乳品中的主要污染细菌种群以及群落的变化规律,为进一步确定乳品生产中的关键质量控制措施提供依据。溯源,追本溯源,探寻事物的根本、源头,本文着重对乳品中的腐败微生物进行溯源研究,对保证乳品质量和提高安全性有十分重要的实践意义。
1 材料与方法
1.1材料与仪器
乳品贵阳三联乳业有限公司,共3个样品,具体见表1;溴化乙锭(EB)、TE缓冲液、溶菌酶、尿素、丙烯酰胺、去离子甲酰胺、甲叉双丙烯酰胺北京Solarbio公司提供;上下游引物由上海生工生物工程有限公司提供;Go Taq Green Master Mix美国Promega公司提供;6×loading buffer、2000 bp DNA Marker大连Takara有限公司提供;琼脂糖上海晶泰生物技术有限公司提供;细菌基因组DNA提取试剂盒北京天根生化科技有限公司提供。

表1 乳品样品Table 1 Samples of dairy products
S1000TMThermal Cycler型PCR仪、Gel DocXR型凝胶成像仪、DcodeTMUniversal Mutation Detection System型DGGE电泳仪美国Bio-rad公司;Micro 17R微量高速冷冻离心机美国Thermo Electron公司;Gilson P型移液器法国吉尔森公司。
1.2实验方法
1.2.1样品的前处理用移液枪分别吸取200 μL无水乙醇、200 μL乙醚和200 μL丙酮加入1 mL样品中,充分混匀后进行高速冷冻离心,去上清液,将剩余的沉淀用TE缓冲液(pH=8.0)溶解,再加入10 μL浓度为50 mg/mL的溶菌酶溶液充分混匀,于37℃在水浴锅中温育1 h以上。
1.2.2细菌总DNA的提取参照DP302-02细菌基因组DNA提取试剂盒中说明书所示,对原料乳和乳房炎乳样品中的细菌基因组DNA进行提取(其中,部分步骤进行了改进),将所提DNA于-20℃下贮藏。
1.2.3PCR扩增(巢式PCR) 细菌通用引物见表2。
参照文献[9]对所提DNA进行三轮PCR扩增。
16S rDNA全长扩增:用引物27F和1492R进行扩增。25 μL PCR反应体系:1 μL模板DNA,浓度为1 μM的上下引物各2.5 μL,Go Taq Green Master Mix(2×)12.5 μL,补去离子水6.5 μL。PCR反应程序:95℃2 min;再进行25个循环,包括94℃1 min,58℃1 min,72℃2 min;最终72℃2 min。
16S rDNA V3区扩增:用引物GC-338F和518R进行扩增,在引物338F的5’加入GC夹,序列为CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG G。25 μL PCR反应体系:1 μL模板DNA,其他体系同上。PCR反应程序(touchdown PCR):94℃5 min;先进行20个循环,94℃1 min,退火温度于65℃降至55℃,每个循环降0.5℃,退火时间3 s,72℃1 min;再进行10个循环,包括94℃1 min,55℃30 s,72℃1 min。
Reconditioning PCR:用引物GC-338F和518R进行扩增。25 μL PCR反应体系:1 μL模板DNA,其他体系同上。PCR反应程序:共5个循环,包括94℃5 min;94℃1 min,55℃45 s,72℃1 min;最终72℃5 min。
1.2.4变性梯度凝胶电泳(DGGE) DcodeTMDGGE电泳仪对上述样品细菌总DNA的PCR扩增产物进行电泳。电泳条件[10]:DGGE变性梯度凝胶是浓度为8%聚丙烯酰胺凝胶,变性剂梯度为35%~55%(100%变性含有7 mol/L尿素和40%甲酰胺),在0.5×TAE缓冲液中,200 V预电泳5 min,再进行85 V、16 h的恒压电泳。凝胶经EB染色后于凝胶成像系统内拍照并记录。
1.2.5条带回收及DNA测序无菌条件下切下凝胶上不同位置的条带,加入20 μL无菌去离子水4℃放置过夜。进行DGGE验证实验。若验证条带与所割条带位于相同的迁移位置,再切胶回收,用引物338F和518R进行16S rDNA V3区的扩增,送上海生工公司纯化并测序。
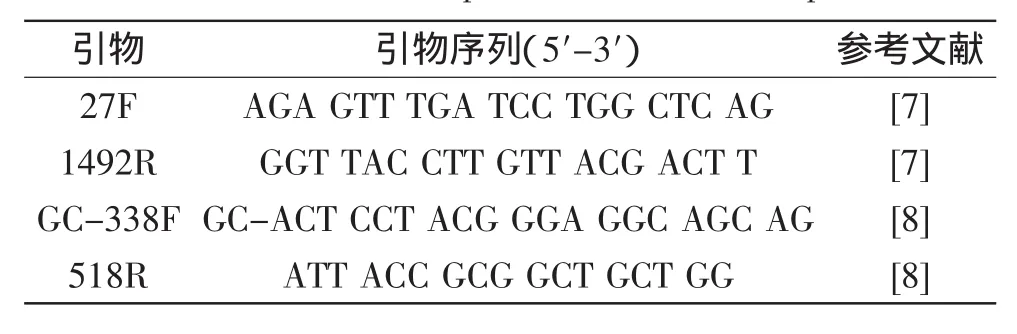
表2 16S rDNA扩增的通用引物Table 2 16S rDNA amplification of universal primers
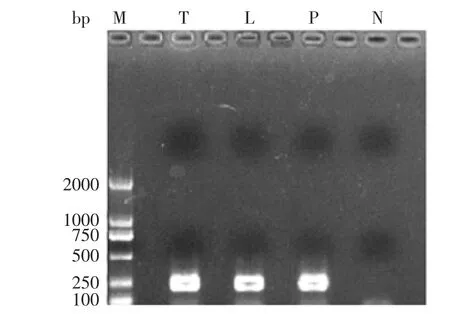
图1 样品细菌16S rDNA V3区的扩增产物电泳图Fig.1 Representative electrophoresis photo of PCR amplification products of V3 variable region of meat
2 结果与分析
2.1细菌16S rDNA V3可变区PCR扩增
细菌16S rDNA V3区PCR的扩增结果经1.2%琼脂糖凝胶电泳后,结果如图1所示。由图1可以看出,样品T、L和P均扩增出大小约为230 bp左右的特异性扩增片断,且阴性对照无条带,DNA质量能满足后续DGGE的实验要求。
2.2DGGE分析
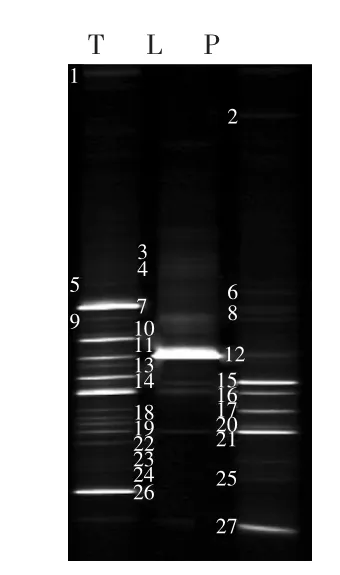
图2 样品细菌16S rDNA V3可变区的DGGE图谱Fig.2 DGGE profiles of bacterial 16S rDNA V3 variable region of samples
样品细菌基因组DNA的DGGE图谱如图2所示。由图2可知,样品共分离到27条不同的条带,原料乳T分离到20个条带,条带7、11、12、14、16和26的亮度最高;杀菌乳L分离到8个条带,条带12、15、16和21的亮度最高;成品乳分离到14个条带,条带15、16、17、21和27的亮度最高。
2.3主要条带测序分析
DGGE图谱主要条带(1~27)的测序结果见表3。

表3 主要条带测序分析Table 3 DNA sequencing of bands
由表3可知,条带1~27所代表的细菌相似性均达到97%以上,它们分别是:马肠链球菌(Streptococcus equinus)、热杀环丝菌(Brochothrix thermosphacta)、2株非培养的细菌(Uncultured bacterium)、非培养的乳杆菌目细菌(Uncultured Lactobacillales bacterium)、2株非培养的假单胞菌属(Uncultured Pseudomonas sp.)、棉子糖肠球菌(Enterococcus raffinosus)、非培养的链球菌属(Uncultured Streptococcus sp.)、海豚链球菌(Streptococcus iniae)、无乳链球菌(Streptococcus agalactiae)、嗜热链球菌(Streptococcus thermophilus)、乳酸链球菌(Lactococcus lactis subsp.)、棉子糖乳球菌(Lactococcus raffinolactis)、钻黄肠球菌(Enterococcus casseliflavus)、乳酸杆菌(Lactobacillus sp.)、解糖肠球菌(Enterococcussaccharolyticus)、鱼乳球菌(Lactococcus piscium)、乳球菌属(Lactococcus sp.)、肉杆菌属(Carnobacteriumsp.)、瑞士乳杆菌(Lactobacillushelveticus)、非培养的乳球菌属(Uncultured Lactococcus sp.)、嗜酸菌属(Acidovorax sp.)、格氏乳球菌(Lactococcus garvieae)、产乳酸菌素的肉杆菌(Carnobacterium maltaromaticum)、猪链球菌(Streptococcus suis)和解没食子酸链球菌(Streptococcus gallolyticus)。
2.4腐败菌的溯源研究
DGGE图片及测序结果表明:在巴氏奶的生产过程中,样品中的微生物具有显著差异性和动态演替过程。样品T(贮奶罐中原料乳)中,条带7、11、12、14、16和26的亮度最高,代表了其中的优势菌群:棉子糖肠球菌(Enterococcus raffinosus)、无乳链球菌(Streptococcus agalactiae)、嗜热链球菌(Streptococcus thermophilus)、棉 子 糖 乳 球 菌(Lactococcus raffinolactis)、乳酸杆菌(Lactobacillus sp.)和猪链球菌(Streptococcus suis)。这表明链球菌属是该原料乳样品中的优势污染菌。据张红研究发现,乳酸菌是牛乳中的主要细菌之一,在样品T中也检测到了乳酸链球菌(Lactococcus lactis subsp.)、乳酸杆菌(Lactobacillussp.)和瑞士乳杆菌(Lactobacillus helveticus)的存在,其中,乳酸链球菌(Lactococcus lactis subsp.)普遍存在于牛乳中,几乎在所有的生鲜乳中均能检出这种细菌[11],这也与本实验得到的结果一致。瑞士乳杆菌(Lactobacillus helveticus)则是发酵食品和乳制品中普遍存在的一种乳酸菌。棉子糖乳球菌(Lactococcus raffinolactis)发现于乳制品和植物产品,是一种常见的细菌。而无乳链球菌(Streptococcus agalactiae)则是乳房炎的病原体,在奶牛的体表、乳头和乳房内都存在,可通过挤乳人员的手、挤乳机器以及蝇类的携带而传播的。这说明除了原料乳本身携带的一些微生物外,挤乳机械、挤乳人员和挤乳环境等存在卫生问题,挤乳环节是造成乳品污染的一个源头。
经过巴氏杀菌后,乳品中的微生物发生了变化,在样品L(巴氏杀菌后的牛乳)中,条带1、5、10、11、13、14、18、19、22、23、24和26消失,条带7、9、15、16、17、21和27有所减弱。新出现了条带3、4和6,而条带12亮度增强,变得十分明亮,它们分别代表了2株非培养的细菌(Uncultured bacterium)、1株非培养的假单胞菌属(Uncultured Pseudomonas sp.)以及嗜热链球菌(Streptococcus thermophilus)。表明在巴氏杀菌过程中有部分细菌被完全杀死,另外一部分细菌则在数量上大大降低。但又新出现了3株菌,这3株菌的条带都很弱,在数量上并不占主导地位,可能是杀菌后样品温度变化为原料乳中原本就存在但数量极少导致之前未能检测到的菌提供了良好的生长繁殖环境,因为有研究表明,占整个群落细菌数量1%以下的菌群在DGGE图谱中不容易被观察到[12]。而条带12在样品L中呈现出极高的浓度,说明嗜热链球菌(Streptococcus thermophilus)是巴氏杀菌后牛乳中的主要微生物,占据主导地位。嗜热链球菌(Streptococcus thermophilus)来源于乳制品,能在45℃以上的温度生长繁殖,这可能就是巴氏杀菌后它在样品中成为绝对优势菌的原因。
在样品P(包装消毒牛奶)中,微生物的多样性又发生了变化,条带3、4消失,条带12减弱,出现了条带8、20、23和25,而条带6、7、9、15、16、17、21和27的亮度增强。其中,条带15、16、17、21和27在数量上是优势菌群,是样品中的主要腐败菌,且都不是新出现的菌,它们分别代表了钻黄肠球菌(Enterococcus casseliflavus)、乳酸杆菌(Lactobacillus sp.)、解糖肠球菌(Enterococcussaccharolyticus)、瑞士乳杆菌(Lactobacillus helveticus)和解没食子酸链球菌(Streptococcus gallolyticus),尤其是钻黄肠球菌(Enterococcus casseliflavus) 和 瑞 士 乳 杆 菌(Lactobacillus helveticus)在样品P中的浓度最高。这几种菌在包装后的成品中成为优势菌,可能有两个原因:一是因为杀菌后的乳品在灌装之前有一个迅速冷却的过程,如果加工管道的清洁和卫生程度不够,这一环节也可能会有污染发生;二是有些微生物经过高温杀菌后能很快恢复并快速生长起来。而新出现的4个条带:1株非培养的假单胞菌属(Uncultured Pseudomonas sp.)、肉杆菌属(Carnobacterium sp.)、嗜酸菌属(Acidovorax sp.)和产乳酸菌素的肉杆菌(Carnobacterium maltaromaticum)在样品中有比较微弱的存在,说明这4株菌也是腐败菌的一部分,但在数量上并不占主导。其中,产乳酸菌素的肉杆菌(Carnobacterium maltaromaticum)来源于蟑螂的肠道微生物群落以及它们在受河流污染的影响下产生变化的细菌,说明包装环境、包装机器和包装人员等可能存在卫生问题。表明产品是在进入包装环节后被污染的,包装环节也是乳品的一个污染源。
通过分析,贮奶罐原料乳中的优势菌是棉子糖肠球菌(Enterococcusraffinosus)、无乳链球菌(Streptococcus agalactiae)、嗜热链球菌(Streptococcus thermophilus)、棉 子 糖 乳 球 菌(Lactococcus raffinolactis)、乳酸杆菌(Lactobacillus sp.)和猪链球菌(Streptococcus suis),巴氏杀菌后的牛乳样品中嗜热链球菌(Streptococcus thermophilus)成为其绝对优势菌,而包装后的消毒牛奶中有以下优势菌群:钻黄肠球菌(Enterococcuscasseliflavus)、乳酸杆菌(Lactobacillussp.)、解糖肠球菌(Enterococcus saccharolyticus)、瑞士乳杆菌(Lactobacillus helveticus)和解没食子酸链球菌(Streptococcus gallolyticus)。挤乳环节、加工管道和包装环节是该产品的微生物污染源。
3 结论
运用PCR-DGGE技术分析了巴氏杀菌乳从原料乳到杀菌、灌装这两个加工关键控制点的微生物群落结构的差异性,得出了主要腐败细菌的污染来源和容易发生污染的关键环节。
3.1乳品中腐败微生物的两个主要来源分别是原料乳本身含有的微生物以及在生产加工过程中被污染的微生物,包括:挤乳环节、杀菌后的加工管道和包装环节。
3.2原料乳中易携带的细菌是乳酸链球菌(Lactococcus lactis subsp.)和乳酸杆菌(Lactobacillus sp.);挤乳环节中易受无乳链球菌(Streptococcus agalactiae)污染;杀菌后的加工管道易受热杀环丝菌(Brochothrix thermosphacta)、钻黄肠球菌(Enterococcus casseliflavus)、瑞士乳杆菌(Lactobacillus helveticus)和2株非培养的假单胞菌属(Uncultured Pseudomonas sp.)污染;肉杆菌属(Carnobacterium sp.)和产乳酸菌素的肉杆菌(Carnobacterium maltaromaticum)则在挤乳环节、杀菌后的加工管道或包装环节都可能被污染。
[1]赵志华.浅析乳业现状、潜在发展瓶颈及对策[J].中国乳品工业,2004,32(1):55-58.
[2]吕元,尹源明,唐佳妮,等.原料奶嗜冷菌快速检测方法研究进展[J].食品科学,2009,30(3):274-280.
[3]蒙明燕,阮征,李卞生.不同贮存条件对生牛奶品质影响的研究[J].中国乳品工业,2005,33(12):49-51.
[4]李小丽,蔡纯,陈胤瑜.原料乳危害及控制措施研究[J].中国乳品工业,2007,35(9):58-62.
[5]ELIE A K,MEDHAT K,THARWAT H,et al.Estimation of Shelf-lifeofConcentraedYogurtbymonitoringSelected Microbiologocal and Physicochemical Changes during Storage[J]. Food Science and Technology,2003,36(4):407-414.
[6]李小丽,王雄英,蔡纯,等.供港生牛奶微生物控制浅析[J].中国乳品工业,2003,31(4):41-43.
[7]Karita S,Nakayama K,Goto M,et al.A novel cellulolytic,anaerobic,and thermophilic bacterium,moorella sp strain F21[J]. Bioscience,BiotechnologyandBiochemistry,2003,67(1):183-185.
[8]Ampe F,Ben Omar N,Moizan C,et al.Polyphasic study of the spatial distribution of microorgan-isms in mexican pozol,afermented maize dough,demonstrates the need for cultivationindependent methods to investigate traditional fermentations[J]. Applied and Environmental Microbiology,1999(65):5464-5473.
[9]胡萍,周光宏,徐幸莲,等.应用PCR-DGGE指纹技术研究真空包装火腿切片贮藏过程中的生物动态变化[J].南京农业大学学报,2009,32(2):137-140.
[10]唐玲,王晓静,周国君,等.运用PCR-DGGE技术分析原料乳中腐败细菌的多样性[J].贵州农业科学,2013,41(5):151-154.
[11]张红.乳酸菌的发酵性质和生理功能[J].生物学通报,1999(12):32-36.
[12]Muyzer G,Ellen C D W,Andre G U.Profiling of complex microbial populations by denaturing g-radient gel electrophoresis analysis of polymerase chain reaction genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993(59):695-700.
Research on pollution sources of spoilage bacteria in pasteurized milk by PCR-DGGE
ZHOU Guo-jun1,2,TANG Ling3,HU Ping1,*,WANG Xiao-jing2,ZHU Jian-rong2,CHEN Yun1,2
(1.College of Liquor Making and Food Engineering,Guizhou University,Guiyang 550025,China;2.Guiyang Trigeminy Dairy Industry Limited Company,Guiyang 550004,China;3.Zunyi Medical University,Zunyi 563003,China)
PCR-DGGE technology was applied to analyze the differences and dynamic changes of microbial community of pasteurized milk from key control points of raw milk to pasteurization and filling process.The results showed that the points proned to be contaminated were milk making,processing pipeline after pasteurization and packaging.Lactococcus lactis subsp.and Lactobacillus sp.were easy carried by raw milk. Streptococcus agalactiae was polluted at milk making.Brochothrix thermosphacta,Enterococcus casseliflavus,Lactobacillus helveticus and 2 strains of uncultured Pseudomonas sp.might be polluted at processing pipeline after pasteurization.Carnobacterium sp.and Carnobacterium maltaromaticum may be polluted at milk making,processing pipeline after pasteurization and packaging.
PCR-DGGE;pasteurized milk;spoilage bacteria;pollution tracing
TS201.1
A
1002-0306(2015)16-0049-05
10.13386/j.issn1002-0306.2015.16.001
2015-01-06
周国君(1964-),男,大学本科,高级工程师,研究方向:乳品加工与质量控制,E-mail:pinghu2008806@163.com。
胡萍(1970-),女,博士,教授,研究方向:畜产品加工与安全,E-mail:ls.phu@gzu.edu.cn。
贵州省科技农业攻关项目[黔科合NY字(2009)3076];贵阳市乳业重大专项[(2009)筑科农合同字2-017-5]。
