抗克百威单链抗体的可溶性表达载体的构建及鉴定
2015-11-08冼燕萍郭新东
邓 龙,王 弘,周 思,冼燕萍,郭新东
(1.广东食品药品职业学院,广东广州510520;2.广东省食品质量与安全重点实验室/华南农业大学食品质量安全研究所,广东广州510642;3.广州质量监督检测研究院,广东广州510110)
抗克百威单链抗体的可溶性表达载体的构建及鉴定
邓龙1,2,王弘2,*,周思1,3,冼燕萍3,郭新东3
(1.广东食品药品职业学院,广东广州510520;2.广东省食品质量与安全重点实验室/华南农业大学食品质量安全研究所,广东广州510642;3.广州质量监督检测研究院,广东广州510110)
为构建克百威(carbofuran,CBF)单链抗体(scFv)可溶性表达载体,实现其在大肠杆菌中的表达。以pCANTAB5E-scFv质粒为模板扩增CBF的重链(VH)及轻链(VL)片段,通过引物设计引入由15个氨基酸组成的连接肽(Gly4Ser)3,经重叠延伸拼接重链及轻链片段,并通过PCR扩增得到scFv基因,再与载体pLIP6/GN连接,转化大肠杆菌BL21,阳性克隆质粒经PCR鉴定并测序。重组菌经0.6 μmol/L异丙基硫代半乳糖苷(IPTG)及低温诱导表达重组单链抗体,并通过SDS-PAGE和Western blotting对其鉴定。采用ELISA法检测重组单链抗体的抗原结合活性。结果表明重组质粒pLIP6/GN-scFv含有插入片段,scFv与碱性磷酸酶(AP)相连得到重组蛋白的分子量接近78 ku,可被游离的CBF竞争性抑制,IC50值为26.80 ng/mL。这说明成功构建了重组质粒pLIP6/GN-scFv并实现了其在大肠杆菌中的可溶性表达,为研究其在免疫分析方法中的应用奠定了基础。
克百威,重组单链抗体,可溶性表达
克百威(carbofuran,CBF)是一种高效广谱的氨基甲酸酯类杀虫剂,同时,因其高制毒性及不易降解[1],容易造成环境污染[2],国家农药残留标准中已规定其在粮食和蔬菜中不得检出[3]。目前,克百威违法使用的现象依然存在,因而有必要对其进行持续的检测和监管。
克百威残留常规的检测方法包括仪器检测法[4-6]、免疫分析法[7-12]、电化学免疫传感器方法[13-16]等。由于仪器分析方法前处理复杂,分析过程繁琐,同时又需要昂贵的仪器和熟练的操作人员,满足不了大批量样品的检测和监测分析工作。电化学免疫传感器的方法作为一种新的检测方法,具有选择性和灵敏度高,响应时间短等特点,但是现今的检测方法仍不能满足大批量样品的检测。免疫分析方法作为一种高通量的初筛方法,具有快速、灵敏度高、特异性强等特点,对于CBF大批量样品快速检测,免疫分析方法仍然是首选。作为第三代抗体—基因工程抗体,其具有快速、容易获得的特点,将所获得的抗体基因转入到工程菌中进行发酵大量表达,可实现其产业化的生产,更加方便其用于实践之中。此外,基因工程抗体可对基因序列进行分析、修饰、修改以改进抗体特性或赋予抗体新的特性,突破以往仅局限于半抗原分子设计的限制,具有更多的灵活性[17-18]。
pLIP6/GN载体中含有信号肽序列,可将载入蛋白引导至周质腔中,进而分泌到胞外,实现可溶性表达,同时pLIP6/GN载体还融合了碱性磷酸酶序列,使所表达的抗体可以进行直接竞争ELISA反应,因而使检测变得非常方便、快捷[19-21]。本研究基于前期筛选获得的抗CBF的重链及轻链序列,进一步开展抗CBF的单链抗体(scFv)可溶性表达研究,并对scFv进行抗原结合活性分析,为建立基于单链抗体的CBF免疫分析方法奠定基础。
1 材料与方法
1.1材料与仪器
pCANTAB5E-scFv质粒[22](含抗CBF scFv序列)本实验室构建;大肠杆菌BL21(DE3)playsS本实验室保存;pLIP6/GN载体Dr.Frédéric Ducancel(Pharmacology and Immunoanalysis Department,CEA/ Saclay,Gif-sur-Yvette,France)惠赠;内切酶SfiⅠ、NotⅠ、BglⅠ和T4 DNA连接酶及DNA胶回收纯化试剂盒TaKaRa公司产品;酵母提取物和蛋白胨Oxoid公司产品;克百威原药、氨苄青霉素(ampicillin,Amp)、异丙基-β-d-硫代半乳糖苷(isopropyl-β-dthiogalactoside,IPTG)、对硝基苯基磷酸二钠盐(pNPP)广州威佳生物科技公司;质粒提取试剂盒广州英伟创津生物科技有限公司;一抗为鼠抗大肠杆菌AP单抗Sigma公司;培养基2×YT的配方参照分子克隆操作指南[23]。
TH-A-403型双人水平净化工作台A无锡一净净化设备厂;HZ100型恒温培养摇床、HP400S型生化培养箱A武汉瑞华仪器设备有限责任公司;凝胶成像系统、半干转印系统美国Bio-Rad公司;Wellwash MK2洗板机美国Thermo公司;6K-15高速冷冻离心机德国Sartorius公司;Wallac VITOR 1420多标记分析仪美国PE公司;微量移液器美国Eppendorf公司;PCR引物上海英俊生物技术有限公司合成,序列见表1。

表1 PCR引物表Table 1 PCR primers
1.2实验方法
1.2.1pLIP6/GN-scFv的构建以质粒pCANTAB5E-scFv为模板,分别以VH′B-SfiⅠ和VH′linker,VL′linker和VL′F-NotⅠ为两组引物,PCR扩增VH和VL片段,反应体系为50 μL,反应条件为:94℃变性5 min;94℃30 s,56℃ 30 s,72℃ 1 min,29个循环;72℃延伸10 min。所得产物经琼脂糖凝胶电泳及凝胶回收纯化。将获得的VH和VL两个片段进行重叠延伸反应,反应体系为20 μL,反应条件为94℃变性5 min;94℃30 s,56℃ 30 s,72℃ 1 min,10个循环;72℃延伸10 min。之后再以所得的拼接产物为模板,以VH′BSfiⅠ,VL′F-NotⅠ为引物,PCR扩增全长scFv片段,反应体系为50 μL,反应条件为:94℃变性5 min;94℃30 s,54℃ 30 s,72℃ 1 min,29个循环;72℃延伸10 min。所得产物经琼脂糖凝胶电泳及凝胶回收纯化。获得的scFv片段和载体pLIP6/GN经SfiⅠ和NotⅠ分步双酶切后连接转化大肠杆菌BL21,抗性(100 μg/mL Amp)筛选重组克隆,提取质粒DNA,PCR鉴定后再测序验证。
1.2.2抗CBF scFv的诱导条件优化及鉴定
1.2.2.1IPTG浓度的影响挑取scFv的阳性克隆接种于4 mL含Amp的2×YT培养基中,37℃、250 r/min培养过夜,之后按2%的接种量转接至50 mL 2×YT培养基中,37℃、250 r/min,培养至A600为0.7~0.8时,加入1 mol/L的IPTG至其终浓度分别为1、0.8、0.6、0.4、0.2 mmol/L,28℃、200 r/min,培养6 h,取培养基上清液10 μL,再加入100 μL pNPP底物显色液,37℃显色10 min,测定A405nm光吸收值,检测碱性磷酸酶活性。
1.2.2.2诱导温度的影响挑取scFv的阳性克隆接种于4 mL含Amp的2×YT培养基中,37℃、250 r/min培养过夜,之后按2%的接种量转接至50 mL 2×YT培养基中,37℃、250 r/min,培养至A600为0.7~0.8时,加入1 mol/L的IPTG至其终浓度为1 mmol/L,分别用28、26、24、22、20℃,200 r/min,培养6 h,取培养基上清液10 μL,再加入100 μL pNPP底物显色液,37℃显色10 min,测定A405nm光吸收值,检测碱性磷酸酶活性。
1.2.2.3诱导时间的影响挑取scFv的阳性克隆接种于4 mL含Amp的2×YT培养基中,37℃、250 r/min培养过夜,之后按2%的接种量转接至50 mL 2×YT培养基中,37℃、250 r/min,培养至A600为0.7~0.8时,加入1 mol/L的IPTG至其终浓度为1 mmol/L,24℃、200 r/min,诱导培养6、8、10、12、14 h时,取各诱导时间下的培养基上清液10 μL,再加入100 μL pNPP底物显色液,37℃显色10 min,测定A405nm光吸收值,检测碱性磷酸酶酶活性。
1.2.2.4抗CBF scFv的表达按照确定的优化条件,挑取scFv的阳性克隆,接种于4 mL含Amp的2×YT培养基中,37℃、250 r/min培养过夜,之后按2%的接种量转接至50 mL 2×YT培养基中,37℃、250 r/min,培养至A600为0.7~0.8时,加入0.6 mmol/L IPTG,24℃诱导表达10 h,离心后取培养基上清用12%SDS-PAGE蛋白电泳分析,按照分子克隆操作指南[10],采用Western blotting对表达的scFv进行鉴定。
1.2.2.5抗CBF scFv的抗原结合活性测定以CBFOVA为包被抗原,采用直接竞争ELISA法,对融合碱性磷酸酶的scFv(AP-scFv)的抗原结合活性进行鉴定,CBF标准品系列浓度为0、1.56、3.13、6.25、12.5、25、50、100 ng/mL。取50 μL CBF标准溶液加到包被好的酶标板上,加入等体积用PBS适当稀释的培养基上清液,混匀。37℃温育2 h,弃去孔中液体,用PBST洗涤6次,加入100 μL pNPP溶液显色,测定A405值。
2 结果与分析
2.1pLIP6/GN-scFv的构建
2.1.1CBF-scFv基因的扩增以pCANTAB5E-scFv为模板质粒,VH′B-SfiⅠ和VH′linker为引物PCR扩增得到360 bp的重链目的片段,VL′F-NotⅠ和VL′linker为引物PCR扩增得到324 bp的轻链目的片段(图1),其大小与预期相符。将该片段经SfiⅠ和NotⅠ双酶切后连入表达载体pLIP6/GN,得到重组载体pLIP6/GN-scFv。

图1 PCR扩增VL和VH片段Fig.1 Amplification of the heavy and light chains gene
2.1.2pLIP6/GN-scFv的PCR鉴定以pLIP6/GN-scFv为模板进行PCR鉴定,扩增得到了约750 bp的全长的scFv目的片段(图2)。对插入片段进行序列测定,结果表明该片段确为scFv目的片段。
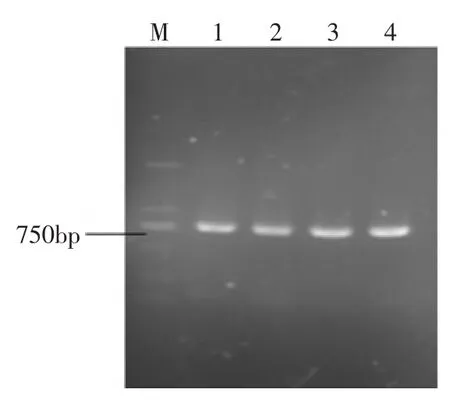
图2 重组质粒pLIP6/GN-scFv的PCR鉴定Fig.2 Identification of recombinant vector pLIP6/GN-evoscFv
2.2抗CBF scFv的表达与鉴定
2.2.1SDS-PAGE和Western blotting鉴定SDSPAGE电泳结果显示,以BL21空载体菌体作为对照,表达产物中(4~6泳道)有一条相对分子质量为78 ku的新蛋白条带(图3)。Western blotting分析表明,该条带可与鼠抗碱性磷酸酶单抗发生特异性的结合反应(图4)。

图3 抗CBFscFv的SDS-PAGE分析鉴定Fig.3 SDS-PAGE analysis of scFv expression
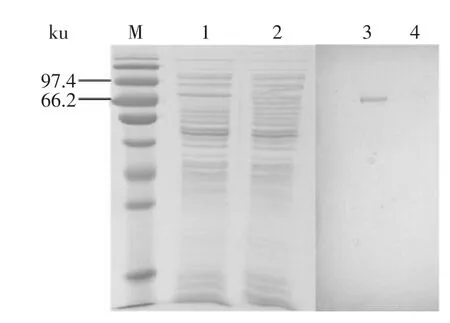
图4 抗CBFscFv的Western blotting鉴定Fig.4 Western blotting analysis of scFv expression
scFv在原核系统中表达有两种方式,一是包涵体表达,即抗体累积在菌体中,二是分泌表达,即滞留在周质腔中或者穿过外膜直接分泌到胞外。本研究中,通过SDS-PAGE蛋白电泳分析表明,抗CBF scFv-AP的表达大部分积累于菌体中,即是一种包涵体表达。因而在表达条件的选择上,应该有更优的组合。据研究表明,为实现原核系统的可溶性表达,随着IPTG诱导浓度,表达温度的降低和诱导时间的延长都会促使可溶性表达量增加[24],但是也有条件的限制。IPTG浓度若低过临界值,则起不到诱导作用。表达温度若太低则不利于菌体的生长,而导致分泌表达量下降,一般认为8~10℃为菌体生长的临界值,因而诱导表达的温度不能低于8~10℃[25]。因此,本文通过控制诱导表达中IPTG诱导浓度、表达温度和诱导时间,获得了IPTG浓度为0.6 mmol/L,诱导温度为24℃,诱导时间为12 h的较优表达条件(图5~图7)。

图5 IPTG浓度对CBF scFv表达的影响Fig.5 Effect of IPTG concentration on CBF scFv expression
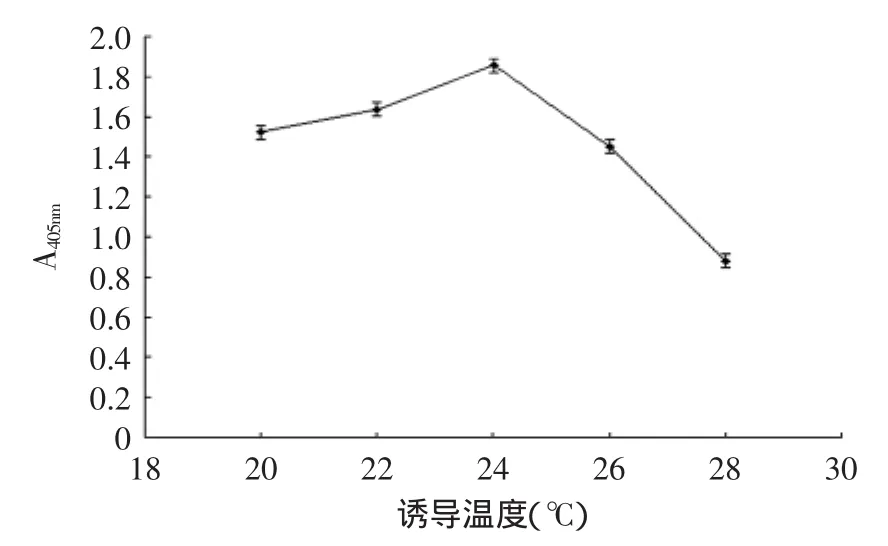
图6 诱导温度对CBF scFv表达的影响Fig.6 Effect of induction temperature on CBF scFv expression
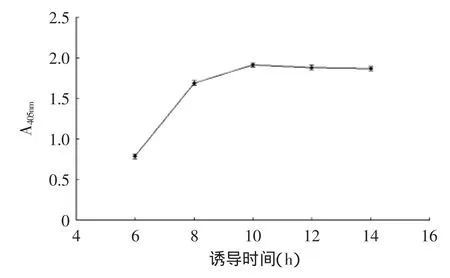
图7 诱导时间对CBF scFv表达的影响Fig.7 Effect of induction time on CBF scFv expression
2.2.2ELISA鉴定以CBF-OVA为包被抗原,采用直接竞争ELISA法对scFv的抗原结合活性进行鉴定。以CBF浓度值为横坐标,以B/B0为纵坐标(B为加入不同浓度CBF所测定的A405值,B0为未加CBF的A405值),采用Origin软件对测得数据进行曲线拟合,拟合模型为四参数罗彻斯特模型[26](4 parameter-logisitic model)。并计算IC50(B/B0=50%时CBF的浓度值)。结果表明,表达的单链抗体可被游离的CBF竞争性抑制,IC50值为26.80 ng/mL(图8),这说明scFv具有较好的抗原结合活性,可用于CBF的检测。
从理论上讲,单链抗体和单克隆抗体的特异性应该相差不大,据杨金易等报导[27],抗克百威单克隆抗体的克百威抑制中浓度IC50为1.18 ng/mL,但本研究中,抗CBF scFv的克百威抑制中浓度IC50为26.80 ng/mL,要高于抗克百威单克隆抗体的IC50值。这可能是因为直接用抗体表达的培养基上清液做ELISA反应,培养基上清液中杂蛋白较多,影响了IC50值。

图8 抗CBF scFv的抑制曲线Fig.8 Inhibition curve of anti-CBF scFv
3 结论
本研究通过构建融合碱性磷酸酶可溶性表达载体,以大肠杆菌BL21(DE3)playsS为宿主菌,采用IPTG及低温诱导,成功实现了抗CBF单链抗体的可溶性表达。这省去了以往在包涵体表达载体中的抗体变性及复性等繁琐操作,同时也保证了抗体的活性[28]。与此同时,由于抗体与碱性磷酸酶融合,使所表达的抗体可以进行直接竞争ELISA反应,因而使检测变得非常方便、快捷。
[1]Tom lin C D S.The Pesticide Manual:A World Compendium,11th ed[M].U K:Crop Protection Publications,1997:458-462.
[2]Campbell S,David M D,Woodward L A,et al.Persistence of carbofuran in marine sand and water[J].Chemosphere,2004,54(8):1155-1161.
[3]叶纪明,何艺兵,陶传江.中国农药残留量国家标准情况介绍[J].农药科学与管理,2000,21(4):20-23.
[4]Chen JB,Zhao WJ,Liu W,et al.Cloud point extraction coupled with derivative of carbofuran as a preconcentration step prior to HPLC[J].Food Chemistry,2009,115:1038-1041.
[5]Luz E,Vera-Avila,Bani P,et al.Determination of carbofuran in surface water and biological tissue by sol-gel immunoaffinity extraction and on-line preconcentration/HPLC/UV analysis[J]. Talanta,2012,88(15):553-560.
[6]M Alamgir Zaman Chowdhury,ANM Fakhruddin,Md Nazrul Islam,et al.Detection of the residues of nineteen pesticides infreshvegetablesamplesusinggaschromatographye-mass spectrometry[J].Food Control,2013,34:457-465.
[7]Guo YR,Liu SY,Gui WJ,et al.Gold immunochromatographic assay for simultaneous detection of carbofuran and triazophos in water samples[J].Analytical Biochemistry,2009,389(1):32-39.
[8]Gui WJ,Jin MJ,Sun LF,et al.Residues determination of carbofuran in vegetables based on sensitive time-resolved fluorescence immunoassay[J].Food and Agricultural Immunology,2009,20(1):49-56.
[9]Zhu G,Jim M,Gui w,et al.Development of a direct competitive enzyme-linked immunoassay for carbofuran in vegetables[J]. Food Chemistry,2008,107(4):1737-1742.
[10]Yang JY,Wang H,Jang YM,et al.Development of an enzyme-linked immuno-sorbent assay(ELISA)method for carbofuran residues[J].Molecules,2008,13(4):871-881.
[11]Liang CZ,Gui WJ,Zhao L,et al.Optimization of a direct competitive enzyme-linked immunoassay for carbofuran and application to water samples[J].Analytical Letters,2008,41(8):1304-1317.
[12]Sun X,Zhu Y,Wang XY.Amperometric immunosensor based on deposited gold nanocrystals/4,4’-thiobisbenzenethiol for determination of carbofuran[J].Food Control,2012,28(1):184-191.
[13]Xia Sun,Ying Zhu,Xiangyou Wang,et al.Amperometric immunosensor based on deposited gold nanocrystals/4,4’-thiobisbenzenethiol for determination of carbofuran[J].Food Control,2010,28:184-191.
[14]Tharini Jeyapragasam,Ramiah Saraswathi.Electrochemical biosensingofcarbofuranbasedonacetylcholinesterase immobilized onto iron oxide-chitosan nanocomposite[J].Sensors and Actuators B,2014,191:681-687.
[15]Ademar Wong,Elsa Maria Materon,Maria Del Pilar Taboada Sotomayor.Development of a biomimetic sensor modified with hemin and grapheme oxide for monitoring of carbofuran in food[J].Electrochimica Acta,2014,146(10):830-837.
[16]Ademar Wong,MariaDelPilarTaboadaSotomayor. Determination of carbofuran and diuron in FIA system using electrochemical sensor modified with organometallic complexes andgraphene oxide[J].Journal of Electroanalytical Chemistry, 2014,731(1):163-171.
[17]邓龙,肖治理,董洁娴,等.基于定点突变的抗克百威单链抗体的亲和力成熟[J].高等学校化学学报,2012(11):2486-2491.
[18]Rongzhi Wanga,Ailing Huangb,Licai Liua,et al.Construction of a single chain variable fragment antibody(scFv)against tetrodotoxin(TTX)and its interaction with TTX[J].Toxicon,2014,83(1):22-34.
[19]Diego B,Karen S,Mary AM,et al.Cloning,expression,and characterization of a bi-functional disintegrin/alkaline phosphatase hybrid protein[J].Protein Expression and Purification,2003,31:286-291.
[20]Fabiana HM de Melo,Diego Butera,Raphael S Medeiros,et al.Biological Applications of a Chimeric Probe for the Assessment ofGalectin-3Ligands[J].JournalofHistochemistry& Cytochemistry,2007,55(10):1015-1026.
[21]Dong JX,Li ZF,Lei HT,et al.Development of a singlechain variable fragment-alkaline phosphatase fusion protein and a sensitive direct competitive chemiluminescent enzyme immunoassay for detection of ractopamine in pork[J].Analytica Chimica Acta,2012,736(29):85-91.
[22]Wang H,Yang JY,Liu XX,et al.Cloning,expression,and identification of anti-carbofuran single chain Fv gene[J]. Biotechnol Prog,2009,25(4):1018-1024.
[23]Sambrook J,Fritsch EF,Maniatis T.Molecular Cloning:A Laboratory Manual,2nd[M].New York:Cold Spring Harbor Laboratory Press,1989:1597,1713-1726.
[24]Ki JJ,Sang YL.Constitutive production of humanleptin by fed-batch culture of recombinantrpoS-Escherichia coli[J]. Protein Expr Purif,2004,5(1):150-156.
[25]朱红裕,李强.外源蛋白在大肠杆菌中的可溶性表达策略[J].过程工程学报,2006,6(1):150-155.
[26]MACIEL R J.Standard curve fitting in immunodiagnostics:A primer[J].Journal of Clinical Immunoassay,1985(8):98-106.
[27]杨金易,吴青,王弘,等.高亲和力的农药克百威单克隆抗体的制备及鉴定[J].中国农业科学,2007,40(3):518-523.
[28]王弘,潘科,杨金易,等.抗克伦特罗单链抗体可溶性表达及特性鉴定[J].食品科学,2007,28(12):332-335.
Soluble expression and charaterization of anti-carbofuran single chain Fv
DENG Long1,2,WANG Hong2,*,ZHOU Si1,3,XIAN Yan-ping3,GUO Xin-dong3
(1.Guangdong Food and Drug Vocational College,Guangzhou 510520,China;2.Guangdong Provincial Key Laboratory of Food Quality and Safety,College of Food Science,South China Agricultural University,Guangzhou 510642,China;3.Guangzhou Quality Supervision and Testing Institute,Guangzhou 510110,China)
To express and characterize the soluble anti-carbofuran(CBF)single chain Fv(scFv).The gene of CBF scFv using plasmid pCANTAB5E-scFv as template,by means of designing the primers which consists of 15 amino acids as the linker peptide(Gly4Ser)3,splicing by overlap extension heavy chain and light chain fragments,was cloned into pLIP6/GN vector to construct the recombinant plasmid pLIP6/GN-scFv.Recombinant plasmid was identified the recombinant plasmid by restrictive enzyme digestion,PCR amplification and sequence analysis.Finally,the recombinant protein was expressed in E.coli BL21,determined by SDS-PAGE and Western blot.ELISA was used to determine the antigenicity of the recombinant protein.The results showed that recombinant plasmid pLIP6/GN-scFv contained the inserted fragment.The expression of scFv linked with alkaline phosphatase showed 78 ku and could competitively combine with CBF,the IC50was 26.80 ng/mL.The scFv of CBF was successful cloned and expressed,which could be useful for corresponding immunoassay methods.
carbofuran;recombinant single-chain antibody;soluble expression.
TS201.1
A
1002-0306(2015)16-0178-05
10.13386/j.issn1002-0306.2015.16.028
2014-09-12
邓龙(1985-),男,硕士,助教,研究方向:生物工程与食品质量安全,E-mail:gdjldl@163.com。
王弘(1973-),女,博士,教授,研究方向:食品质量安全,E-mail:gzwhongd@163.com。
