支原体污染经p38 MAPK途径降低人类细胞株28S和18S RNC-rRNA*
2015-11-08罗彦彰林修贤荣冬秀崔毅峙
王 青, 罗彦彰, 林修贤, 荣冬秀, 张 涛, 王 通, 崔毅峙
细胞体外培养模型是病理生理研究中不可或缺的工具,然而,实验室支原体污染在世界范围内广泛流行,其在体外组织培养的污染率高达5% ~35%[1-2]。支原体是已知最小的原核生物,直径多为0.1 ~0.3 μm,能够通过除菌滤膜(0.22 μm),其唯一可见的细胞器是核糖体。受非致病性支原体污染的细胞株往往没有明显的形态或培养基变化[3],因而常被忽视。但是,科研界公认的标准是,以有支原体污染的组织培养模型得到的科学结论被认为是假象。
我们在以往的工作中成功建立了真核细胞翻译组学和蛋白质组学的研究平台,并利用该策略阐明了在稳态肿瘤细胞中存在长度依赖的翻译偏好现象,以及阐述了这种偏好与肿瘤细胞的表型密切相关[4]。该策略的技术内核是人细胞的核糖体新生肽链复合物(ribosome nascent-chain complex,RNC)的分离和提取,从而研究RNC结合的翻译中mRNA(RNC-mRNA)的组学规律。RNC中包含的是已装配完毕的成熟核糖体。
Levine等[5]曾报道支原体感染会引起总RNA组分中的核糖体RNA(ribosomal RNA,rRNA)相对含量的改变。我们实践中发现支原体污染的细胞总RNA组分改变并不显著,然而成熟核糖体中RNC-rRNA的变化尚未见报道。由于支原体富含核糖体且具改变细胞表型能力,我们假设支原体污染会引起宿主细胞的RNC-rRNA组成发生改变。回答该问题不但可在翻译层面阐述支原体输入对人细胞的影响,同时可探索RNC-rRNA作为支原体污染检测的可行性;进而,也有望为评价支原体污染临床治疗的疗效提供一条新途径。因此,本研究利用RNC分离技术从人类细胞株中分离得到成熟的核糖体,并研究实验室支原体污染对RNC-rRNA组成的改变,并初步探索了丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径在该过程中的可能作用。
材料和方法
1 材料
1.1 主要材料 HBE、H1299和 A549细胞购自ATCC;Hep3B、HCCLM3、HCCLM6 细胞来自复旦大学中山医院;超速离心机及SW60 Ti转子购自Beckman;琼脂糖凝胶电泳系统购自北京市六一仪器厂;SDS-PAGE及转膜系统购自Bio-Rad,PVDF膜购自Millipore。
1.2 主要试剂 DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自Gibco,琼脂糖购自 Invitrogen;KCl、MgCl2、HEPES、KOH 和蔗糖购自天津市大茂化学试剂厂;放线菌酮(cycloheximide,CHX)和SDS裂解液购自上海碧云天生物技术有限公司;DTT购自广州捷倍斯生物科技有限公司;Triton X-100购自Sigma;支原体检测试剂盒购自上海依科赛生物制品有限公司;ERK1/2、p-ERK1/2、p38、p-p38、JNK 和p-JNK抗体购自CST,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体和Ⅱ抗购自Bioworld。
2 方法
2.1 细胞培养 HBE、A549、H1299、Hep3B、HCCLM3和HCCLM6细胞按照我们已发表的方法进行培养[4,6]。
2.2 支原体污染的治疗 根据文献[7]方法,在被支原体污染的细胞培养基中加入环丙沙星,终浓度为10 mg/L,连续传代培养7代后进行再次检验。
2.3 支原体的PCR检测 依照支原体检测试剂盒说明书进行PCR检测。用无抗生素的培养基培养细胞,待细胞生长至80%以上。取1 mL细胞培养上清,放入离心管中。13 000 r/min离心5 min,弃上清,用PBS洗沉淀1次。加入100 μL裂解液裂解细胞,上下颠倒混匀后,室温放置5 min。细胞裂解液95℃处理5 min。13 000 r/min离心5 min,上清转入新离心管。取2 μL上清作为模板进行PCR反应:95℃ 30 s;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,40 个循环;72℃ 5 min。
2.4 真核细胞RNC提取 依照我们发表的方法提取真核细胞RNC[4]。细胞在T25培养瓶中培养2 d后,在培养基中加入CHX,至终浓度100 mg/L,放入培养箱中孵育15 min。将培养瓶转移至冰上,弃去上清,用4℃预冷的PBS洗涤2次。在瓶中加入500 μL裂解液(20 mmol/L HEPES-KOH,15 mmol/L MgCl2,200 mmol/L KCl,100 mg/L CHX,2 mmol/L DTT和1%Triton X-100,置于冰上裂解30 min。刮下细胞,收集裂解液,16 200 ×g,4℃离心10 min。在超速离心管中加入30%蔗糖溶液2 mL,沿管壁缓慢加入细胞裂解液500 μL(蔗糖与裂解液比例不得小于3∶1)。185 000 ×g,4 °C 离心3 h,弃上清,用100 μL Buffer RB(20 mmol/L HEPES-KOH,15 mmol/L MgCl2,200 mmol/L KCl,100 mg/L CHX,2 mmol/L DTT)重悬沉淀,并转移至预冷的EP管中。2.5 RNC-RNA提取 用TRIzol Reagent提取RNCRNA。在2.4中得到的RNC中加入1 mL TRIzol Reagent,充分混匀后室温静置3 min。加入200 μL氯仿,涡旋混匀15 s,室温静置5 min。12 000×g,4℃离心15 min,溶液分为3层,小心吸取水相层,转移至新的EP管中,加入1倍体积的异丙醇,混匀后-20℃静置过夜。12 000 ×g,4℃离心30 min,用-20℃预冷的75%乙醇洗涤沉淀物2次,风干乙醇后加入 30 μL RNase-free H2O。
2.6 琼脂糖凝胶电泳 以标准琼脂糖凝胶电泳法检测RNC-RNA,凝胶浓度为2%,每孔上样量为1 μg,90 V电泳约1 h。用 SYBR-Green II染色后用290 nm紫外光激发照相获取RNC-RNA条带图谱。2.7 Western blot 细胞样品用SDS裂解液裂解提取总蛋白,10%SDS-PAGE分离蛋白,浓缩胶中60 V电泳30 min,分离胶中80 V电泳2 h。取出凝胶,以230 mA恒流转膜1.5 h。5% 脱脂牛奶封闭1 h,Ⅰ抗以1∶1 000稀释,4℃过夜,Ⅱ抗(1∶2 000稀释)室温孵育1 h,显影。
3 统计学处理
琼脂糖凝胶电泳图在ImageJ软件中测定各泳道内各截面的总灰度值[8];数据以Matlab R2013a软件分析并作图。Western blot实验中,用ImageJ软件测量蛋白条带灰度值。以GAPDH条带灰度值对目的条带灰度值归一化,使用GraphPad Prism 6.01软件进行统计检验。我们采用双尾配对t检验以排除不同胶片曝光参数不同带来的误差。以P<0.05为差异有统计学意义。
结 果
1 支原体污染对H1299和A549细胞的RNC-rRNA组成影响
我们以PCR方法分别对本实验室培养的2株肺来源癌细胞株H1299和A549进行检测,结果显示该H1299细胞呈支原体阴性(表现为280 bp条带阴性,150 bp条带阳性),而A549细胞受支原体污染(280 bp和150 bp条带双阳性)。我们分别提取了这2株细胞的RNC并从中分离出RNC-RNA,琼脂糖凝胶电泳图显示,支原体阴性细胞株H1299具有清晰的28S(~4 700 nt)和18S(~1 900 nt)条带,为典型真核生物rRNA带型;相反,A549细胞RNC-rRNA带型发生明显改变,28S条带灰度值明显下降,同时在约1 540 nt处出现典型的原核生物16S rRNA特征性条带,此外在约700 bp处出现1条来源不明的条带,以下称Unknown条带。灰度分析表明,支原体阳性细胞RNC-RNA中28S和18S rRNA条带所占比例大幅减少,相反16S rRNA和Unknown条带所占比例明显上升,见图1。
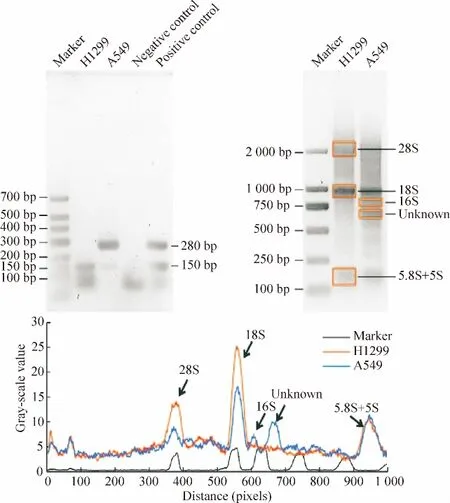
Figure 1.Decreases in 28S and 18S rRNA in the RNC-RNA fraction of mycoplasma-contaminated human H1299 and A549 cells.图1 支原体污染降低人肺癌H1299和A549细胞株RNC-RNA中的28S和18S rRNA
2 RNC-rRNA组成变化的获得性实验
我们进而利用本实验室专用于培养已知有支原体污染的培养箱模拟细胞的获得性支原体感染,并研究RNC-rRNA在此模型中的改变,从而探索RNC-rRNA组成改变的特异性,以及用于检测支原体污染的实用性。我们复苏了支原体阴性的HBE细胞,其初始阶段提取的RNC-RNA结果表现为正常的rRNA带型以及正常的rRNA条带的灰度值。在存在支原体污染的培养环境中,未进行抗支原体处理经4次细胞传代后,再次收集该 HBE细胞提取的RNCRNA,电泳图显示细胞内成熟核糖体rRNA组成发生与图1相似的变化,其灰度值分析出现了16S和Unknown条带,见图2。这表明我们可有效利用RNC-rRNA带型发现支原体的获得性污染。

Figure 2.Acquired mycoplasma contamination of HBE cells.MP-:mycoplasma negativa;MP+:mycoplasma positive.图2 HBE细胞的获得性支原体污染
3 抗支原体治疗可逆转RNC-rRNA组成的变化
随后,我们试图回答,抗支原体治疗是否可逆转RNC-rRNA的异常组成,以进一步辅助证明支原体对翻译影响的特异性。因此,我们对本实验室内多个不同组织来源的细胞株进行了测试。在肺癌A549中,支原体阳性细胞的RNC-RNA提取结果均显示出异常的成熟核糖体rRNA组分;然而,经治疗RNC-rRNA的带型逆转为正常,表现为16S和Unknown条带的消失,以及真核28S和18S条带的灰度值恢复。在支原体阳性的肝癌Hep3B、HCCLM3和HCCLM6细胞中,我们也观察到了异常的RNC-rRNA条带和灰度值改变;经抗支原体治疗,这些异常RNC-rRNA恢复为正常状态,见图3。

Figure 3.Anti-mycoplasma treatment reversed the mycoplasma-mediated aberrant RNC-rRNA compositions.图3 抗支原体治疗后恢复人细胞株RNC-rRNA的组成
4 支原体污染影响宿主细胞MAPK通路
支原体感染可通过活化多种真核宿主细胞的MAPK途径[9],并可介导 28S rRNA的合成和降解[10]。为此,我们选择了2株经过检测分别确证为支原体阴性与阳性的肺癌A549细胞,提取其全蛋白,并以Western blot检测其中MAPK通路激活状态改变。3次重复实验结果表明,与支原体阴性的细胞相比,受支原体污染的A549细胞中,总p38和磷酸化p38比率(p38/p-p38)显著升高(P<0.01),而(ERK1/2)/(p-ERK1/2)比率无显著变化(P>0.05)。这表明p38 MAPK途径在支原体感染下受到抑制,而ERK途径不受影响。同时,Western blot结果显示A549细胞的JNK蛋白表达量在检测精度以下,见图4。

Figure 4.Mycoplasma infection altered the MAPK signaling pathway in A549 cells.Mean±SEM.n=3.*P<0.05 vs MP-.图4 支原体污染对A549细胞MAPK通路的影响
讨 论
支原体对宿主细胞核糖体rRNA的影响曾被多次报道[11],这些研究主要利用高灵敏度的放射自显影方法证明宿主细胞内存在低丰度的原核生物特征性16S和23S rRNA[12]。鉴于支原体污染具普遍性[13],且目前常规细胞总RNA提取和凝胶检测结果中上述原核生物特征性条带并不常见,原因是在细胞水平上支原体所产生的原核核糖体在数量上并无优势。相反,本研究通过蔗糖缓冲离心分离出成熟的核糖体[4],发现在支原体污染样品中,原核特征性rRNA条带所占比例明显增加,该现象表明宿主细胞内原核核糖体在成熟核糖体组分中所占比例明显上升。
细胞内核糖体的装配与蛋白质翻译这一过程受严格调控,目前已知真核细胞内参与核糖体装配的因子有170种以上[14]。同样,支原体诱导宿主细胞发生广泛而深刻的改变[3],因此,我们认为支原体完全可能具干扰宿主细胞的核糖体装配的潜力,但目前尚无直接证据支持这一假说。作为该假说的支持证据,本研究观测到不同细胞株中各rRNA条带所占比例差异较大,部分支原体阳性样品中真核生物rRNA特征性条带灰度值与背景值相近。由于在核酸总量上支原体阳性样本与阴性样本一致,可排除分离能力饱和的可能性。此外,在部分样品中出现高丰度的Unknown条带,胶图上指示该条带长度(约700 bp,相当于1 400 nt)与目前已知的真核或原核生物rRNA长度均不一致,提示其中可能存在新的核糖体组装方式。
上述现象在常规的总RNA提取中难以发现,因此,本研究结果首次报道了支原体污染中,人类细胞的28S和18S RNC-rRNA下降的现象。MAPK通路是细胞中多种生物进程的重要调控因素[15-16],且MAPK通路改变被认为与rRNA的合成和降解有机制联系[10]。我们在本研究中所有细胞株均发现了相同的RNC-rRNA变化,并进而以A549细胞为例证展开了研究。我们的结果验证了支原体污染介导的p38 MAPK途径抑制与28S和18S RNC-rRNA降低的关系。其实,真核细胞rRNA合成高度依赖细胞外成纤维细胞生长因子-1(fibroblast growth factor 1,FGF1)和FGF-2的入胞和细胞核转位[17]。其中,核内FGF-2更可与上游结合因子(upstream binding factor,UBF)形成复合体,直接发挥转录因子功能以介导rRNA转录[18]。FGF-1和FGF-2的细胞核转位已知高度依赖p38 MAPK途径的活化[17]。因此,本研究机制部分可归纳为,支原体感染可抑制p38磷酸化,进而阻断FGF-1和FGF-2入核,从而降低rRNA的合成,最终影响RNC-rRNA的组成。
由于支原体感染的隐蔽性与感染清除的复杂性,目前对受感染细胞株的首选处理方式是进行库存替换[19],实际科研工作中对支原体感染以预防为主,故需要简单有效的检测手段对培养中的细胞污染情况进行定期检查。目前常用的支原体检测方法有 PCR 法[20]、ELISA 法[21]和核酸染色法[22],其中PCR法以其较高的准确率与相对较低的成本和耗时被广泛应用于实验室的日常检测中[23]。然而PCR法与ELISA法均依赖于已知的病原体信息,因而在理论上存在检测盲区。本研究所用的方法在原理上不存在上述检测盲区,同时成本低廉、操作简便,能够成为支原体检测的辅助手段。
综上,本研究首次报道了支原体污染对人细胞株成熟核糖体rRNA组成的影响,并在A549细胞中验证了p38 MAPK在其中扮演重要角色。因此,本研究为支原体感染状态下真核细胞的病理生理研究提供了一定的方向指引。同时本研究所用的方法与已有支原体检测手段相比具有一定优势,可开发为新的支原体检测手段。
[1] Young L,Sung J,Stacey G,et al.Detection of Mycoplasma in cell cultures[J].Nat Protoc,2010,5(5):929-934.
[2] Drexler HG,Uphoff CC.Mycoplasma contamination of cell cultures:incidence, sources, effects, detection,elimination,prevention[J].Cytotechnology,2002,39(2):75-90.
[3] Rottem S.Interaction of mycoplasmas with host cells[J].Physiol Rev,2003,83(2):417-432.
[4] Wang T,Cui Y,Jin J,et al.Translating mRNAs strongly correlate to proteins in a multivariate manner and their translation ratios are phenotype specific[J].Nucleic Acids Res,2013,41(9):4743-4754.
[5] Levine EM,Thomas L,Mcgregor D,et al.Altered nucleic acid metabolism in human cell cultures infected with mycoplasma[J].Proc Natl Acad Sci U S A,1968,60(2):583-589.
[6] Chang C,Li L,Zhang C,et al.Systematic analyses of the transcriptome,translatome,and proteome provide a global view and potential strategy for the C-HPP[J].J Proteome Res,2014,13(1):38-49.
[7] Schmitt K,Daubener W,Bitter-Suermann D,et al.A safe and efficient method for elimination of cell culture mycoplasmas using ciprofloxacin[J].J Immunol Methods,1988,109(1):17-25.
[8] Schneider CA,Rasband WS,Eliceiri KW.NIH Image to ImageJ:25 years of image analysis[J].Nat Methods,2012,9(7):671-675.
[9] Rawadi G,Ramez V,Lemercier B,et al.Activation of mitogen-activated protein kinase pathways by Mycoplasma fermentans membrane lipoproteins in murine macrophages:involvement in cytokine synthesis[J].J Immunol,1998,160(3):1330-1339.
[10]Laskin JD,Heck DE,Laskin DL.The ribotoxic stress response as a potential mechanism for MAP kinase activation in xenobiotic toxicity[J].Toxicol Sci,2002,69(2):289-291.
[11] Stanbridge E.Mycoplasmas and cell cultures[J].Bacteriol Rev,1971,35(2):206-227.
[12] Markov GG,Bradvarova I,Mintcheva A,et al.Mycoplasma contamination of cell cultures:interference with32P-labelling pattern of RNA[J].Exp Cell Res,1969,57(2-3):374-384.
[13]Hwang JM,Lee JH,Yeh JY.A multi-laboratory profile of Mycoplasma contamination in Lawsonia intracellularis cultures[J].BMC Res Notes,2012,5:78.
[14] Fromont-Racine M,Senger B,Saveanu C,et al.Ribosome assembly in eukaryotes[J].Gene,2003,313:17-42.
[15]来丽娜,宋丽华,张晓京,等.ROS/PKC/p38 MAPK途径在山茱萸多糖抑制心肌细胞缺氧/复氧损伤的作用[J].中国病理生理杂志,2014,30(12):2201-2205.
[16]潘霄羽,王 燕,黄高翔,等.TGF-β1激活的 p38 MAPK在TGF-β1上调人卵巢癌细胞PAI-1表达中的作用[J].中国病理生理杂志,2015,31(2):284-288.
[17]Sorensen V,Zhen Y,Zakrzewska M,et al.Phosphorylation of fibroblast growth factor(FGF)receptor 1 at Ser777 by p38 mitogen-activated protein kinase regulates translocation of exogenous FGF1 to the cytosol and nucleus[J].Mol Cell Biol,2008,28(12):4129-4141.
[18] Sheng Z,Liang Y,Lin CY,et al.Direct regulation of rRNA transcription by fibroblast growth factor 2[J].Mol Cell Biol,2005,25(21):9419-9426.
[19]Uphoff CC,Denkmann SA,Drexler HG.Treatment of mycoplasma contamination in cell cultures with Plasmocin[J].J Biomed Biotechnol,2012,2012:267678.
[20]Uphoff CC,Drexler HG.Detection of mycoplasma in leukemia-lymphoma cell lines using polymerase chain reaction[J].Leukemia,2002,16(2):289-293.
[21] Feld NC,Qvist P,Ahrens P,et al.A monoclonal blocking ELISA detecting serum antibodies to Mycoplasma hyopneumoniae[J].Vet Microbiol,1992,30(1):35-46.
[22] Battaglia M,Pozzi D,Grimaldi S,et al.Hoechst 33258 staining for detecting mycoplasma contamination in cell cultures:a method for reducing fluorescence photobleaching[J].Biotech Histochem,1994,69(3):152-156.
[23] Uphoff CC,Drexler HG.Comparative PCR analysis for detection of mycoplasma infections in continuous cell lines[J].In Vitro Cell Dev Biol Anim,2002,38(2):79-85.
