英夫利西单抗治疗克罗恩病黏膜愈合的血清差异蛋白质表达研究*
2015-11-08廖诗乐陈白莉胡坤华饶佩斯黎明涛陈旻湖曾志荣
廖诗乐, 陈白莉, 胡坤华, 饶佩斯, 何 瑶, 黎明涛, 陈旻湖, 曾志荣△
克罗恩病(Crohn’s disease,CD)在我国日益多见[1]。英夫利西单抗(infliximab,IFX)是目前唯一能改变CD自然病程的药物,其主要作用是可以诱导获得黏膜愈合(mucosal healing,MH),MH的CD患者住院率及手术率降低[2]。然而,IFX价格昂贵,如何能在治疗前明确哪些患者经IFX治疗能达到MH,将具有明显的经济效益比。基于此,本研究采用蛋白质组学技术分析IFX获得MH和未获得MH患者血清蛋白表达的差异,为将来筛选预测的生物标志物奠定基础。
材料和方法
1 研究对象
2012年9月~2013年9月中山大学附属第一医院炎症性肠病(inflammatory bowel diseases,IBD)中心确诊的CD患者共14例。诊断标准采取我国的共识意见[3]。患者给予 IFX 5 mg/kg,第 0、2 、6、14 周静脉滴注给药。于第10周复查肠镜,根据克罗恩病内镜严重程度指数(Crohn’s disease endoscopic index of severity,CDEIS)情况,将病人分为MH和黏膜未愈(non-MH)。MH定义为内镜下未见溃疡和(或)CDEIS评分<3分,non-MH定义为内镜下无应答,即CDEIS评分较前下降<5分,溃疡仍然存在[4]。采集7例MH患者治疗前0周(A组)和治疗后14周(B组)的静脉血以及7例non-MH的CD患者0周(C组)和14周(D组)的静脉血3 mL,4℃冰箱放置4 h,以3 000×g离心10 min,取上清样本冻存于-80℃备用。
2 主要方法
2.1 血清样本处理 去除大部分高丰度清蛋白、IgG和纯化、定量蛋白。然后按说明书,每400 pmol的Dye荧光染料标记50 μg的蛋白质,Cy2标记内参照。采取混合样本策略以消除个体差异,Cy3和Cy5交叉标记样本,以消除不同荧光染料染色效力的误差。A、B、C、D各组血清均在相同条件下重复4次。2.2 双向差异凝胶电泳 (2D-DIGE) 上样至固相pH值干胶条(IPGstrip pH 4~7,24 cm),对血清样品进行第1向等电聚焦(isoelectric focusing,IEF)电泳。IEF后,将完成平衡的IPG胶条放置于12.5%十二烷基硫酸钠-聚丙稀酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gel,SDS-PAG)上缘,进行第 2向SDS-PAG电泳至溴酚蓝达凝胶下缘。
2.3 2D-DIGE图像分析 使用 Typhoon Scanner Control 5.0扫描仪软件采集胶内蛋白差异图像,采用DeCyder 6.0软件对图像进行自动分析,选取表达差异大于1.5倍、t检验P<0.05的斑点作为差异表达蛋白质斑点行进一步质谱鉴定。
2.4 差异蛋白的MALDI-TOF/TOF-MS鉴定 Ettan全自动凝胶斑点处理工作站进行蛋白质斑点的切取、脱色、干燥、酶解。使用 Ultraflex III质谱仪(Bruker)对酶解液进行MALDI-TOF/TOF-MS分析,得到各斑点的肽质量指纹图谱(peptide mass fingerprinting,PMF)和串联质谱(tandem mass spectrometry,MS/MS)。使用Biotools软件,以MASCOT(Matrix Science)为搜索引擎,在Swiss-Prot数据库中检索所获的图谱。
3 绘制STRING网络功能图
在 STRING 数据库(http://www.string-db.org)提交蛋白质登记名,将所有差异表达的蛋白质都纳入功能网络分析,研究差异表达蛋白质所参与的路径。
4 统计学处理
应用SPSS 13.0统计软件分析患者资料,正态分布的变量用均数±标准差(mean±SD)表示,非正态分布的资料用中位数,极差(median,range)表示。两组间比较采用独立样本t检验或Mann-Whitney U检验,治疗前后比较采用配对t检验或Wilcoxon检验。分类变量比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
1 一般情况
MH患者男性5例,女性2例,年龄(21.86±8.40)岁;non-MH患者男性4例,女性3例,年龄(19.14±5.90)岁。2组患者性别构成比、年龄、病程、疾病部位、疾病行为、用药史、肠外表现等临床特征均无统计学差异。2组超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)和红细胞沉降率(erythrocyte sedimentation rate,ESR)在0周时均无显著差异,治疗后MH组上述指标显著低于non-MH组,也显著低于MH组治疗前0周的水平。CD活动指数(Crohn’s disease activity index,CDAI)在0 周时呈轻中度活动,2组无显著差异;在14周时MH组达临床缓解,与0周相比有显著差异,且non-MH组与MH组相比有显著差异。2组CDEIS评分在0周时无显著差异,治疗后存在显著差异,见图1、表1。
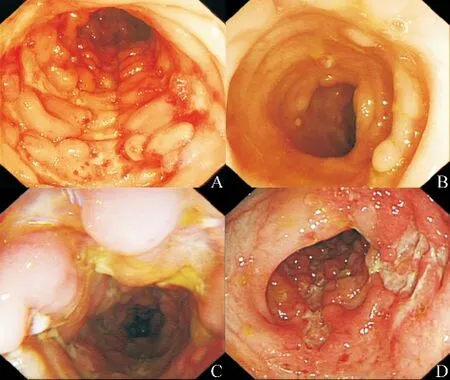
Figure 1. Typical colonoscopic images.A:MH(0 week),CDEIS 22.4;B:MH(10 weeks),CDEIS 1.4;C:non-MH(0 week),CDEIS 18.6;D:non-MH(10 weeks),CDEIS 15.2.图1 典型肠镜图像
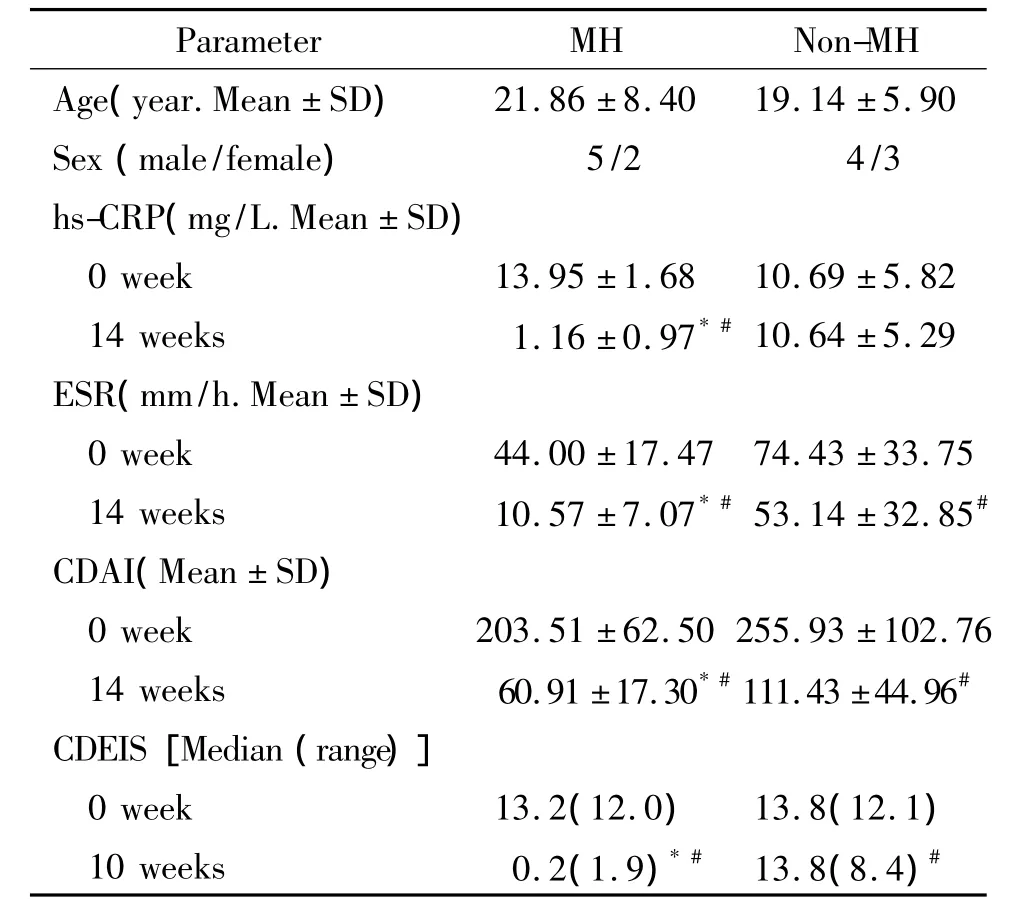
表1 患者的临床资料Table 1.Clinical characteristics of CD patients with IFX therapy(n=7)
2 凝胶图像差异分析
经DeCyder 6.0软件处理后Cy2、Cy3和Cy5染色在图像中分别为蓝色、绿色和红色。经DeCyder 6.0软件分析检测到1 505±177个蛋白质斑点,获得的凝胶间匹配率为72.0%±0.2%。以斑点平均体积差异大于1.5倍(表达差异上调或下调1.5倍),t检验P<0.05的蛋白质点为有显著差异的蛋白质点,经软件统计分析,A组与B组之间、C组与D组之间、A组与C组之间以及B组与D组之间比较分别存在36、3、10和31个差异表达的蛋白质斑点,共计发现44个显著差异表达的蛋白质斑点。显著差异的蛋白斑点在2DDIGE凝胶上的具体位置见图2。

Figure 2.Merged image of 2D-DIGE.图2 融合的2D-DIGE凝胶图像
3 质谱分析结果
差异表达的44个蛋白质点进行MALDI-TOF/TOF-MS质谱分析,以Mascot得分≥56分认为是可信结果,共鉴定出与27个差异点对应的19种蛋白质,见表2。
A组和B组比较鉴定出与25个差异点相对应的17种差异蛋白质,其中在B组上调表达的蛋白有6种,包括中心体蛋白57 kD样1(centrosomal protein 57kD-like 1,CEP57L1)、角蛋白 2e(keratin,type II cytoskeletal 2 epidermal,CK-2e)、白蛋白(albumin,ALB)、载脂蛋白 E(apolipoprotein E,APOE)、载脂蛋白A-I(apolipoprotein A-I,APOA1)和甲基化CpG结合域蛋白 4(methyl-CpG-binding domain protein 4,MBD4),在B组下调表达的蛋白有11种,包括补体因子H(complement factor H,CFH)、铜蓝蛋白(ceruloplasmin,CP)、α1-抗胰蛋白酶(alpha-1-antitrypsin,SERPINA1)等。
C组和D组比较鉴定出与3个差异点对应的2种差异蛋白质,CEP57L1和ALB均在D组上调表达;A组和C组比较鉴定出与2个差异点相对应的2种差异蛋白,Mago-Nashi同源蛋白(Mago-Nashi homolog protein,MAGOH)在A组上调表达,触珠蛋白(haptoglobin,HP)在A组下调表达;B组和D组比较鉴定出与21个差异点对应的15种差异蛋白质,其中在B组上调表达的蛋白有6种,包括血清中α2-巨球蛋白(alpha-2-macroglobulin,A2M)、CK-2e、ALB、APOE、APOA1和MBD4,在B组的下调蛋白有9种,包括CFH、CP、原肌球蛋白α4链(tropomyosin alpha-4 chain,TPM4)等。

表2 经IFX治疗的CD患者血清中的差异表达蛋白质Table 2.Differentially expressed proteins in the serum of CD patients with IFX treatment
4 蛋白质功能网络分析
分别绘制得A-B之间和B-D之间差异表达蛋白相互作用的功能网络图,其中涉及APOA1以及周边共12种蛋白的相互关系。不同颜色的线段表示不同类型的证据,见图3。
讨 论
CD的发病与遗传、环境及肠道菌群有关[5],系肠黏膜的慢性全层性炎症。既往采用5-氨基水杨酸(5-ASA)、激素及免疫抑制剂治疗,尽管临床症状好转,但肠道炎症仍然持续,住院率及手术率高。1998年开始采用IFX治疗CD。IFX促肠道黏膜的愈合,MH的获得可以减少手术率和住院率,从而改变CD的自然病程。然而,IFX治疗仅使约30%的患者获得MH[6],而且价格十分昂贵。因此,治疗前如果能预测其MH,就有望解决目前临床的需求。
本研究在国内首次运用蛋白质组学探究与IFX治疗CD获得MH可能相关的蛋白质。2D-DIGE图像提示IFX的应用改变了CD患者的血清蛋白质表达图谱,MALDI-TOF/TOF-MS鉴定得19种差异表达的蛋白质。
CFH、CP、TPM4、补体因子 B(complement factor B,CFB)、α1-抗胰糜蛋白酶(alpha-1-antichymotrypsin,ACT)、HP、MAGUK p55 亚家族成员 3(MAGUK p55 subfamily member 3,MPP3)和锌指蛋白268(zinc finger protein 268,ZNF268)这8种蛋白质在A-B比较及B-D比较中均为B组下调表达,这些蛋白质可能与黏膜炎症相关,下调表达提示 MH。CK-2e、ALB、APOE、APOA1和 MBD4这5种蛋白质在 A-B比较及B-D比较中均为在B组上调表达,可能与炎症抑制和黏膜修复相关,上调表达提示MH。此外,SERPINA1和补体C4A在A-B比较中表现为B组下调表达,A2M仅表现为B组较D组上调表达,血清淀粉样 P成分(serum amyloid P-component,SAP)仅表现为D组较B组上调表达,MAGOH蛋白在A-B比较及A-C比较中均为在A组上调表达,CEP57L1蛋白则不论MH与否均呈现在治疗后上调表达。

Figure 3.The networks of proteins differentially expressed between A-B(left)and B-D(right).C4A:complement C4-A;CFB:complement factor B;HP:haptoglobin;CP:ceruloplasmin;HPX:hemopexin;APOA1:apolipoprotein A-I;APOE:apolipoprotein E;ALB:albumin;CFH:complement factor H;SERPINA1:α-1-antitrypsin;APCS:serum amyloid P-component;A2M:α-2-macroglobulin.图3 A-B、B-D组间差异表达蛋白质的网状功能图
从功能网络图中可以看到APOA1与周边蛋白的相互作用,2D-DIGE显示其表达水平在IFX治疗获得MH组上调;同家族APOE的表达水平也呈现相同趋势的变化。既往研究报道过儿童CD患者脂蛋白的组成发生变化[7]。Takeuchi等[8]曾对接受IFX治疗的类风湿性关节炎(rheumatoid arthritis,RA)患者的研究中发现血清APOA1在治疗后上调。近年Serada等[9]运用iTRAQ定量蛋白质组学技术,对自身免疫性疾病患者接受IFX治疗前后血清分析发现IFX治疗前载脂蛋白家族水平明显低于治疗后12 周,包括 APOE、APOA1、APOA2、APOM 等。Haber man等[10]通过对共359例未接受治疗的儿童 CD、UC患者以及健康人的核心基因表达谱及微生物群落比较,发现CD患者2个基因(DUOX2和APOA1)的表达发生了改变。DUOX2上调表达和APOA1下调表达促进氧化应激和Th1细胞极化,肠道黏膜病变更严重的患者中变化更显著。本研究与以上研究结果相符,载脂蛋白表达水平上调可能提示经IFX治疗后较轻的疾病状态。然而,希腊Gazouli等[11]的研究却显示原发性无应答或部分应答的CD患者中,APOA1和APOE所对应的蛋白质斑点表达上调,而缓解组中APOA1和APOE无明显变化。不一致的研究结果可能与纳入研究对象的年龄、病程、判断疗效时间点的不同有关。APOE在其它炎症性疾病的血清中表达亦发生变化[12],脂类代谢与炎症反应以及IFX治疗效果的关系值得进一步研究。
综上所述,这项研究采用蛋白质组学技术,发现获得MH者与未获得MH者血清蛋白质存在19种蛋白质表达差异,为下一步筛选预测MH的生物标志物奠定了基础。
[1] Zeng Z,Zhu Z,Yang Y,et al.Incidence and clinical characteristics of inflammatory bowel disease in a developed region of Guangdong Province,China:a prospective population-based study[J]. J Gastroenterol Hepatol,2013,28(7):1148-1153.
[2] Schnitzler F,Fidder H,Ferrante M,et al.Mucosal healing predicts long-term outcome of maintenance therapy with infliximab in Crohn’s disease[J].Inflamm Bowel Dis,2009,15(9):1295-1301.
[3] 中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].中华内科杂志,2012,51(10):818-831.
[4] Hebuterne X,Lemann M,Bouhnik Y,et al.Endoscopic improvement of mucosal lesions in patients with moderate to severe ileocolonic Crohn’s disease following treatment with certolizumab pegol[J].Gut,2013,62(2):201-208.
[5] Renz H,von Mutius E,Brandtzaeg P,et al.Gene-environment interactions in chronic inflammatory disease[J].Nat Immunol,2011,12(4):273-277.
[6] Colombel JF,Sandborn WJ,Reinisch W,et al.Infliximab,azathioprine,or combination therapy for Crohn’s disease[J].N Engl J Med,2010,362(15):1383-1395.
[7] Levy E,Rizwan Y,Thibault L,et al.Altered lipid profile,lipoprotein composition,and oxidant and antioxidant status in pediatric Crohn disease[J].Am J Clin Nutr,2000,71(3):807-815.
[8] Takeuchi T,Nakanishi T,Tabushi Y,et al.Serum protein profile of rheumatoid arthritis treated with anti-TNF therapy(infliximab)[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,855(1):66-70.
[9] Serada S,Fujimoto M,Ogata A,et al.iTRAQ-based proteomic identification of leucine-rich alpha-2 glycoprotein as a novel inflammatory biomarker in autoimmune diseases[J].Ann Rheum Dis,2010,69(4):770-774.
[10] Haberman Y,Tickle TL,Dexheimer PJ,et al.Pediatric Crohn disease patients exhibit specific ileal transcriptome and microbiome signature[J].J Clin Invest,2014,124(8):3617-3633.
[11] Gazouli M,Anagnostopoulos AK,Papadopoulou A,et al.Serum protein profile of Crohn’s disease treated with infliximab[J].J Crohns Colitis,2013,7(10):e461-e470.
[12]曾 花,蔡道章,陈郁鲜,等.人膝骨关节炎血清生物学标志物的筛选[J].中国病理生理杂志,2012,28(5):884-888.
