供体年龄影响融合生长内皮祖细胞对平滑肌细胞表型转换及增殖迁移的作用*
2015-11-08朱光旭阮光萍宋明宝杨建勇康华莉潘兴华
朱光旭, 周 芳, 阮光萍, 宋明宝, 杨建勇, 黄 岚, 康华莉, 潘兴华
动脉粥样硬化等损伤性血管疾病病理变化主要表现为内皮再生延迟以及血管伤处平滑肌细胞(smooth muscle cells,SMCs)过度增生,导致新生内膜形成。大量研究证实内皮祖细胞(endothelial progenitor cells,EPCs)参与血管损伤修复[1-2],可以有效抑制新生内膜增生[2-4]。细胞间相互作用是细胞生命活动重要调节方式之一。EPCs归巢到血管损伤部位后,细胞间的影响主要来自血管损伤边缘的内皮细胞(endothelial cells,ECs)、再生内皮或 SMCs,因此推测EPCs与SMCs间相互作用可能在EPCs修复损伤血管内膜过程中起重要调节作用。我们前期研究表明,EPCs生物学活性具有年龄相关性特点,年轻大鼠来源EPCs较老龄大鼠来源者具有更好的增殖、迁移和分化能力[5-6]。本研究通过建立细胞共培养体系,观察老龄和年轻个体来源EPCs对SMCs表型和增殖迁移活性的影响,旨在揭示不同年龄个体来源EPCs移植修复损伤血管过程中对SMCs可能的调节作用。
材料和方法
1 主要材料
1~2月龄、19~26月龄的SD大鼠,雌雄不限,无既往病史,环境湿度、温度适中,饮食良好,由第三军医大学新桥医院实验动物中心提供。所有动物实验经第三军医大学及成都军区昆明总医院伦理委员会批准。DMEM/F12干粉培养基(HyClone);内皮细胞生长添加剂(endothelial cell growth supplements,ECGs)购于BD;优质胎牛血清(PAA);DiI标记乙酰化低密度脂蛋白(DiI-labeled acetylated low-density lipoprotein,DiI-Ac-LDL)购于 Molecular Probe;FITC标记荆豆凝集素I(FITC-labeled Ulex europaeus agglutinin I,FITC-UEA-I)购于 Vector;Ficoll液(Amersham);大鼠血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)购于 Sigma;小鼠抗大鼠血管内皮细胞生长因子受体2(Flk-1/VEGFR2/KDR)、兔抗大鼠 CD133(BioSource);山羊抗大鼠CD34(Novus);山羊抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、抗大鼠steopontin抗体(Santa Cruz);小鼠抗大鼠 α-SM-actin抗体 (Sigma);[3H]-胸腺嘧啶脱氧核苷([3H]-TdR)(上海原子核研究所);Transwell培养板(Corning);倒置荧光相差显微镜 (Leica);液体闪烁计数器(Beckmen)。
2 方法
2.1 EPCs的培养及鉴定 脱臼处死SD大鼠,无菌取出股骨和胫骨,PBS冲洗骨髓,Ficoll液密度梯度离心 (2 000 r/min,30 min)分离单个核细胞(mononuclear cells,MNCs),PBS洗涤后,差速贴壁法进行培养[6]。2次贴壁细胞培养14 d后,DiI-Ac-LDL(10 mg/L)及FITC-UEA-I(10 mg/L)避光孵育,置荧光显微镜下观察。在贴壁细胞长至约50%融合时收集培养细胞进行流式分析,步骤如下:收集细胞加入2 mL圆底离心管中,PBS洗3次,每次1 min,4℃、1 500 r/min离心5 min,弃上清;用 PBA(含1%牛血清白蛋白及0.1%叠氮钠)稀释 I抗,与细胞混匀,4℃或置冰上孵育1.5 h,离心弃上清;冷PBS 1 mL离心洗涤1次,以去除多余的未结合的特异性抗体;加入PBA稀释的FITC标记山羊抗小鼠IgG抗体、PE标记驴抗山羊IgG或TRITC标记鸡抗兔IgG II抗(1∶200)200 μL,吹打混匀,4 ℃或置冰上避光孵育45 min,再用冷PBS 1 mL离心洗涤2次,每次1 min;将细胞重新悬浮于500 μL PBS中,避光混匀,以同型抗体作为对照置流式管上机检测。
2.2 SMCs培养及鉴定 参照文献采用组织块法培养SMCs[7],具体操作过程如下:颈椎脱臼处死大鼠,无菌取大鼠胸腹主动脉,仔细清除血管外膜及脂肪组织,将血管纵向剖开,用0.01 mol/L PBS漂洗干净,用眼科镊刮去血管内膜,放入50 mL培养瓶中,在瓶口用眼科剪剪成约1.5 mm ×1.5 mm×1.5 mm大小的组织块,用吸管将组织块随机铺于瓶底,于37℃、5%CO2的培养箱中,将贴有贴块的培养瓶反转放置使贴块位于顶侧,培养4 h后,加入含20%FBS和双抗的DMEM/F12培养基,恢复正常放置继续培养,每3天换液1次,培养细胞用α-SM-actin进行平滑肌表型鉴定。
2.3 贴壁细胞数目与增殖能力检测 细胞首次贴壁培养24 h,弃早期贴壁细胞,离心收集悬浮细胞,以15%FBS的DMEM/F12培养基(含内皮细胞生长添加剂100 mg/L,肝素100 mg/L,青、链霉素各1×105U/L)、同等体积培养基以及相同细胞数接种于纤维连接蛋白包被24孔板,4 d后弃悬浮细胞,显微镜(×400)下计数每个视野下贴壁细胞数。首次贴壁后收集悬浮细胞,离心弃上清,以新鲜培养基分别配成浓度梯度细胞悬液,接种于纤维连接蛋白包被96孔板,4 d后弃悬浮细胞,镜下观察每孔贴壁细胞密度,在老年和年轻组分别选择贴壁细胞密度大致相等的6孔,加入新培养液继续培养,待生长速度最快的孔内EPCs铺满孔底约90%后,用MTT法检测细胞增殖,每孔加入 MTT(5 g/L)20 μL,37 °C 继续孵育4 h,弃上清,各孔加入150 μL二甲基亚砜(DMSO),室温振荡 10 min,HT-7000 Plus多孔读数仪492 nm读取吸光度值,以培养液孔作为空白调零。
2.4 实验分组 实验分为 (1)P3组:第3代(P3)SMCs;(2)P4组:将 P3 SMCs以低浓度(2×106cells/L,3 mL/well接种)传代(P4)培养于6孔板内,但是上室不接种 EPCs,仅加入等量培养基;(3)P4YE组:上室为融合生长的年轻(young,Y)大鼠来源EPCs,下室为P4 SMCs;(4)P4AE组:上室为融合生长的老龄(aged,A)大鼠来源 EPCs,下室为 P4 SMCs。
2.5 细胞共培养体系建立 将骨髓单个核细胞直接接种于Transwell insert膜(膜孔径0.4 μm)上,按照我们前期方法进行EPCs培养[6],EPCs生长至融合后换无血清培养基,取P3 SMCs,将其以2×106cells/L,3 mL/well接种于6孔板内,细胞贴壁后换无血清培养基继续培养24 h,然后将Transwell insert插入种有SMCs的6孔板中,使下室为SMCs,上室为EPCs,换含5%FBS的DMEM/F12(含内皮细胞生长添加剂100 mg/L,肝素100 mg/L,青、链霉素各1×105U/L)进行培养,两室培养基通过Transwell insert膜交通,从而建立Transwell共培养体系,每3 d换液1次,共培养4 d后进行表型标志蛋白检测。
2.6 Western blotting检测 α-SM-actin及 osteopontin的表达 用4℃预冷的PBS洗细胞3次,加入预制的含PMSF的裂解液,冰上裂解30 min,裂解后,将细胞碎片和裂解液移至离心管。4℃、16 000 r/min离心20 min,收集上清,取其中少量测蛋白浓度(BCA法)。取等量预处理的蛋白样品上样,恒压81 V进行SDS-PAGE,电转至PVDF膜,5%脱脂奶粉-PBST室温封闭 1 h后,加入抗大鼠 α-SM-actin抗体(1∶800)、GAPDH 或 osteopontin(1∶600),4 ℃孵育过夜,再与HRP标记的兔抗羊IgG、抗鼠IgG 37℃孵育1 h,化学发光显色后用凝胶成像系统扫描,半定量分析显影带,目的蛋白量以GAPDH相对量表示。
2.7 [3H]-TdR掺入法检测SMCs增殖 将 P4 SMCs以3×107cells/L、3 mL/well接种于6孔板内,细胞贴壁后换无血清培养基培养24 h,然后将种有EPCs的Transwell insert插入6孔板中,共培养48 h后终止培养。参照文献[8],终止培养前于共培养体系(膜孔径0.4 μm)中加入[3H]-TdR,使其终浓度为3.7×104kBq/L,继续共同培养24 h后用多头细胞收集器收集细胞于玻璃纤维滤膜上,用10% 三氯醋酸处理、洗净,滤膜经红外线烤箱烘烤后置入闪烁瓶,加脂溶性闪烁液,在Beckmen β液体闪烁记数器上测定,结果以每分钟计数(counts per mimute,CPM)/well表示,掺入量反映SMCs DNA合成速率。2.8 细胞划痕实验 参照文献[9],将 SMCs接种到6孔板内,以含20%FBS的DMEM/F12培养待培养SMCs达到完全融合生长后,用200 μL移液管经过板孔中心、比着直尺垂直于板底无菌低速划痕,用PBS洗细胞3次,去除划下的细胞,插入培养有融合生长状态 EPCs的 Transwell insert膜,使上室为EPCs,下室为划痕 SMCs,换含20%FBS的 DMEM/F12(含内皮细胞生长添加剂100 mg/L,肝素100 mg/L,青、链霉素各 1 ×105U/L)进行培养,于 0、6、12、24 h观察拍照,使用Image-Pro Plus 6.0图像分析软件(Media Cybernetics)进行图像分析。
3 统计学处理
数据以均数±标准差(mean±SD)表示,以SPSS 10.0统计软件进行单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 培养细胞的生长特征及鉴定
1.1 EPCs的培养及鉴定 2次贴壁培养的骨髓EPCs大多呈梭形或卵圆形,在贴壁细胞数量上,2次贴壁培养4 d,年轻组来源的骨髓MNCs贴壁细胞数量显著高于老龄组;同等培养条件下年轻个体来源细胞的增殖活性也显著高于老年组(P<0.05)。细胞贴壁后第3天可见明显索状生长结构;EPCs培养到第14天,老年和年轻组细胞均逐渐趋于呈融合生长状态;培养12 d后,年轻和老龄组DiI-Ac-LDL及FITC-UEA-I双染,随机挑选6个视野计数双染阳性细胞百分率,分别为(92.70±3.45)%与(81.40±7.82)%,表明培养骨髓MNCs具有成熟内皮细胞特征。流式细胞分析表明培养细胞表达CD34、CD133以及Flk-1,年轻组表达显著高于老龄组(P<0.01),见图1。
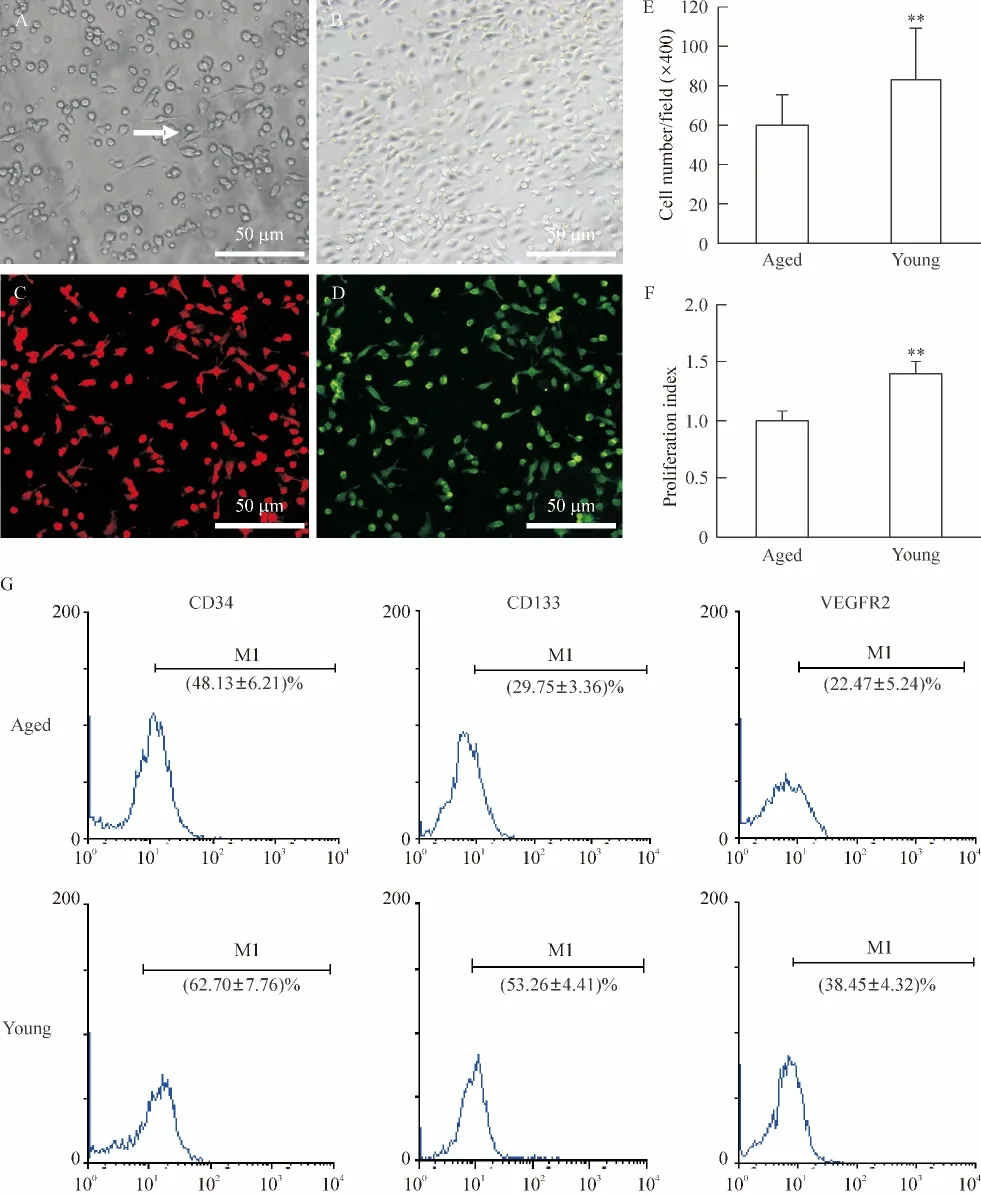
Figure 1.Characteristics of bone marrow derived endothelial progenitor cells(EPCs).A:secondary attached cells,the arrow shows the net-work of EPCs;B:EPCs cultured after 14 d AC:DiI-Ac-LDL positive cells;D:FITC-UEA-I positive cells;E:cell number of secondary attached cells;F:histogram analysis of EPCs proliferation;G:FACS analysis of CD34,CD133 and VEGFR2 expression in cultured MNCs after 14 d of culture.Mean±SD.n=4.**P <0.01 vs aged group.图1 培养骨髓EPCs的生长特征
1.2 SMCs培养及鉴定 培养5 d左右可见长梭型细胞自组织块边缘长出(图2A),14 d左右可见培养细胞呈“谷峰”样生长(图2B),取传代培养细胞进行α-SM-actin染色呈阳性,对照为阴性,证实所培养的细胞为SMCs(图2C)。

Figure 2.SMCs culture and identification.A:5 d later,several cells were found around the cultured tissue blocks;B:after 14 d cultured,the cell showed a valley like growth state;C:immunostaining suggested that the cultured cells were expressed α-SM-actin.图2 培养SMCs的生长特征
2 共培养 EPCs及 SMCs后 SMCs α-SM-actin及osteopontin的表达
α-SM-actin是收缩型 SMCs主要标志之一[10]。与P3组相比,传代培养(P4)可使SMCs的α-SM-actin表达减少,但是与P4YE SMCs的α-SM-actin表达无显著差别,表明年轻大鼠来源的EPCs可以延迟SMCs表型转换。与P4YE组比较,共培养老年个体来源EPCs延迟效应显著减弱,但是该组SMCs的α-SM-actin表达与P3组比较仍显著高于 P4组,见图3。
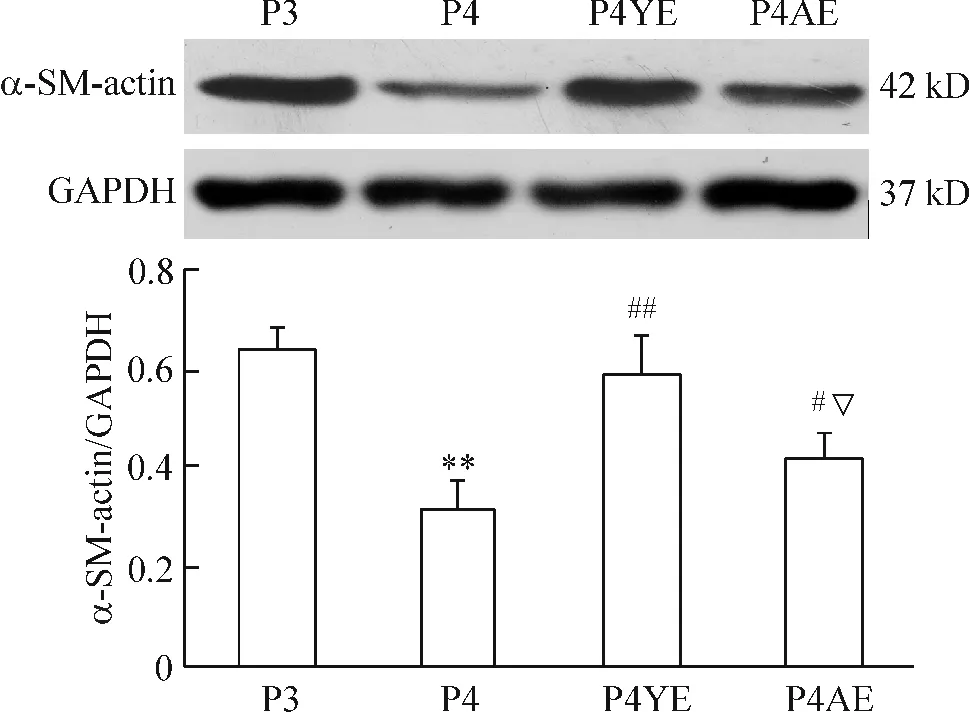
Figure 3.The effect of co-culture EPCs and donor age on theprotein expression of α-SM-actin in the SMCs.Mean±SD.n=4.**P <0.01 vs P3 group;#P <0.05,##P<0.01 vs P4 group;▽P<0.05 vs P4YE group.图3 共培养EPCs与SMCs后SMCs α-SM-actin蛋白的表达
Osteopontin是合成型 SMCs的主要标志[9]。与P3组相比,SMCs传代培养可使SMCs(P4)内的osteopontin增强(P<0.01);而共培养年轻大鼠来源EPCs组(P4YE)SMCs的osteopontin表达与P3组比较未见有显著差别;与P4YE组比较,老龄个体来源的EPCs抑制osteopontin的表达能力显著减弱,但是其表达仍显著低于P4组(P<0.05),见图4。

Figure 4.The effect of co-culture EPCs and donor age on theprotein expression of osteopontin in the SMCs.Mean±SD.n=4.**P <0.01 vs P3 group;#P <0.05,#P<0.01 vs P4 group;▽P<0.05 vs P4YE group.图4 共培养EPCs与SMCs后SMCs osteopontin蛋白的表达
3 共培养EPCs对SMCs的增殖的影响
共培养EPCs显著抑制SMCs的增殖。与P4组相比,P4YE组与P4AE组[3H]-TdR掺入量均显著降低(P<0.05),P4YE组与P4AE组的掺入量也有显著差别(P<0.05),见图5。
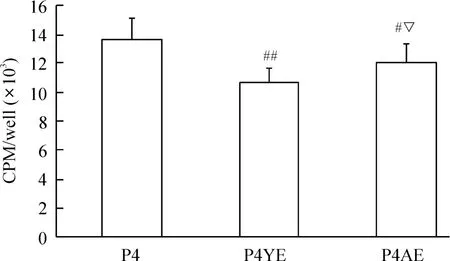
Figure 5.The effect of donor age and co-culture EPCs on the proliferation of SMCs.Mean±SD.n=6.#P<0.05,##P<0.01 vs P4 group;▽P<0.05 vs P4YE group.图5 共培养EPCs对SMCs的增殖能力的影响
4 共培养EPCs对SMCs的迁移的影响
供体年龄对共培养融合生长EPCs条件下SMCs迁移能力的影响见图6。细胞培养12 h后,与P4组相比,P4YE余留面积显著增加(P<0.01),P4AE组也比P4组显著增加(P<0.05),但显著低于P4YE组(P<0.05),表明年轻大鼠来源的融合生长EPCs可以显著抑制SMCs迁移,EPCs供体衰老削弱融合生长EPCs对SMCs迁移的抑制能力。
讨 论
EPCs也称内皮前体细胞,可分化为成熟的ECs,参与损伤血管再内皮化及血管重建,且抑制新生内膜增生[2-3]。骨髓是EPCs主要来源之一,在缺血组织血管新生及血管内膜损伤时可动员入血,归巢到血管损伤部位,参与损伤血管内膜修复。尽管已有大量关于EPCs表型特征以及临床应用的研究,但是迄今尚未有公认的标准培养方法以及统一的定义,比较明确的是,EPCs既具有干细胞特性,又具有ECs的部分特征,可以诱导分化为成熟ECs。ECs具有吞噬Ac-LDL功能,同时有具有结合UEA-I特性,目前已有较多文献研究以DiI-Ac-LDL以及FITC-UEA-I双染阳性作为鉴定EPCs的重要指标之一[11-12];在干细胞标志方面EPCs主要表达CD34、CD133等[13-14]。本次实验选择2次贴壁培养法培养EPCs,文献报道该方法可有效减少包括成熟ECs在内的其它类别单个核细胞影响[11]。实验结果显示培养的骨髓MNCs DiI-Ac-LDL与FITC-UEA-I双染阳性,流式细胞分析也表明培养细胞表达VEGFR2、CD34和CD133,证实此次实验培养的骨髓MNCs具有EPCs生物学特征。此外,在EPCs增殖速度以及表面标志表达方面,实验结果也进一步证实不同年龄个体来源EPCs活性具有年龄相关性特点。

Figure 6.The effect of donor age and co-culture EPCs on the migration ability of SMCs.The cell migration ability was examined by scratch wound healing assay under a microscope.Mean ± SD.n=5.Scale bar=100 μm.#P<0.05,##P<0.01 vs P4 group;▽P<0.05 vs P4YE group.图6 共培养EPC对SMCs的迁移能力的影响
EPCs归巢到血管损伤部位修复损伤血管过程中,主要受到来自血管损伤边缘的ECs、再生内皮或损伤处暴露的SMCs的调节作用。EPCs与SMCs自身均可以表达多种蛋白或者分泌细胞因子,相互影响这两种细胞的生物学行为,可能极大地影响其修复损伤血管进程,已有研究发现ECs调节了SMCs的增生和迁移[15]。尽管有大量文献报道EPCs促进损伤血管内皮再生[1-2]以及抑制新生内膜增生[2-4],然而迄今未见有关于EPCs与SMCs间相互影响的文献报道。文献研究以及本次实验均表明EPCs生物学活性具有年龄相关性特点,年轻大鼠来源EPCs较老龄大鼠来源者具有更好的增殖、迁移和分化能力[5-6,12],因此 EPCs 供体年龄也可能调节 EPCs 与SMCs间相互作用,进而影响EPCs修复损伤血管内膜进程。
血管在胚胎发生期来自中胚层,在以后的发育过程中,逐渐分化为不同的细胞群,并获得具有成年特征的分化表型。根据结构和功能的不同,VSMCs可分为收缩型(分化型)和合成型(未分化型或去分化型)2种表型,SMCs由收缩型向合成型转换是其开始增生的先决条件[16]。正常时血管SMCs为收缩型,各种因素导致血管损伤后,暴露的血管SMCs由收缩型向合成型转变,随即开始增生、迁移形成新生内膜。α-SM-actin是收缩型血管SMCs主要标志之一[10],在合成型中表达甚微[16],而 osteopontin 是合成型SMCs的重要标志,在收缩型中几乎不表达[9]。在离体培养SMCs过程中,随着细胞传代,SMCs表型也迅速由主要是收缩型向合成型转变[17]。本次实验结果表明,在P3与P4 SMCs中,α-SM-actin表达显著下调,而osteopontin表达则显著上调。共培养研究结果显示融合生长状态的EPCs可以显著抑制传代培养SMCs的α-SM-actin表达下调,同时也阻抑osteopontin表达上调,表明融合生长状态的EPCs可以延缓SMCs由收缩型向合成型转变,提示在损伤血管过程中EPCs抑制损伤血管SMCs表型转换可能是重要调节机制之一。实验也观察到老龄个体来源EPCs延缓SMCs表型转换的能力较年轻个体来源EPCs显著减弱,进一步说明年轻个体来源EPCs较老龄个体来源者有更好的修复损伤血管能力。有关EPCs延迟SMCs表型转换文献研究极其少见,机制尚不明确。新近研究报道内皮Jagged1表达在血管损伤后新生内膜SMCs增生调控中有重要作用,Jagged1在老龄个体血管ECs较年轻个体来源ECs表达显著减弱,ECs过表达Jagged1可显著抑制SMCs过度增生,下调ECs Jagged1表达促进血小板源性生长因子诱导的SMCs增殖和迁移[18]。我们在前期实验中也观察到Jagged1也表达于EPCs,并且发现Jagged1在年轻个体来源EPCs表达较老龄个体显著增强,EPCs抑制SMCs表型转换过程中是否通过Jagged1相关信号转导系统发挥作用尚需深入研究。由于血管SMCs由收缩型向合成型转换是其开始增生和迁移的先决条件,SMCs表型转变从一侧面反映了其增殖和迁移能力的变化,共培养EPCs显著抑制SMCs增殖和迁移能力,老龄个体来源 EPCs抑制SMCs增殖和迁移能力较年轻个体来源EPCs显著减弱,提示供体年龄在融合生长状态EPCs抑制血管SMCs表型转换及增殖和迁移中有重要调节作用。
细胞间相互调节是一极复杂的病理生理活动[19-20],细胞生长状态与其本身具有的调节功能密切相关。文献报道ECs不同生长状态对SMCs具有不同的调节作用,融合生长状态ECs促进SMCs表达α-SM-actin,而对数生长期 ECs 则抑制其表达[21]。此外ECs和SMCs间相互作用不仅调节了SMCs生物学特性,而且对ECs本身也具有调节作用。新近研究报道ECs与SMCs之间通过连接蛋白Cx43和Cx47进行相互调节,并且证实ECs与SMCs之间相互作用调节了ECs的表型[22]。本次研究结果揭示EPCs调节SMCs表型转换和增殖迁移具有年龄相关性,为EPCs临床应用提供了部分实验依据,然而本次实验共培养体系中使用融合生长状态EPCs,对于其它生长状态、细胞数量、接触方式等对SMCs有何不同调节作用尚未明确,EPCs本身具有干、祖细胞特性,SMCs表型变化、生长状态也极可能影响EPCs分化及功能,反过来又可能影响EPCs对SMCs的调节,因此对于阐明EPCs与SMCs间相互调节作用及详细机制,尚需大量深入的研究。
[1] Ma X,Hibbert B,McNulty M,et al.Heat shock protein 27 attenuates neointima formation and accelerates reendothelialization after arterial injury and stent implantation:importance of vascular endothelial growth factor up-regulation[J].FASEB J,2014,28(2):594-602.
[2] Yamauchi A,Kawabe J,Kabara M,et al.Apurinic/apyrimidinic endonucelase 1 maintains adhesion of endothelial progenitor cells and reduces neointima formation[J].Am J Physiol Heart Circ Physiol,2013,305(8):H1158-H1167.
[3] Werner N,Junk S,Laufs U,et al.Intravenous transfusion of endothelial progenitor cells reduces neointima formation after vascular injury [J].Circ Res,2003,93(2):e17-e24.
[4] Zhu S,Malhotra A,Zhang L,et al.Human umbilical cord blood endothelial progenitor cells decrease vein graft neointimal hyperplasia in SCID mice[J].Atherosclerosis,2010,212(1):63-69.
[5] Zhu G,Song M,Wang H,et al.Young environment reverses the declined activity of aged rat-derived endothelial progenitor cells:involvement of the phosphatidylinositol 3-kinase/Akt signaling pathway[J].Ann Vasc Surg,2009,23(4):519-534.
[6] 朱光旭,潘兴华,宋明宝,等.Jagged1过表达促进老龄大鼠来源内皮祖细胞向成熟内皮分化[J].中国病理生理杂志,2013,29(6):969-974.
[7] 宋明宝,黄 岚,于学军,等.缝隙连接阻断剂对体外培养的大鼠血管平滑肌细胞表型转化的影响[J].中国动脉硬化杂志,2008,16(2):85-88.
[8] Wu X,Huang L,Zhou Q,et al.Effect of paclitaxel and mesenchymal stem cells seeding on ex vivo vascular endothelial repair and smooth muscle cell growth[J].J Cardiovasc Pharmacol,2005,46(6):779-786.
[9] Shen YQ,Guo W,Wang ZJ,et al.Protective effects of hydrogen sulfide in hypoxic human umbilical vein endothelial cells:a possible mitochondria-dependent pathway[J].Int J Mol Sci,2013,14(7):13093-13108.
[10] Salabei JK,Cummins TD,Singh M,et al.PDGF-mediated autophagy regulates vascular smooth muscle cell phenotype and resistance to oxidative stress[J].Biochem J,2013,451(3):375-388.
[11] Thum T,Fraccarollo D,Galuppo P,et al.Bone marrow molecular alterations after myocardial infarction:Impact on endothelial progenitor cells[J].Cardiovasc Res,2006,70(1):50-60.
[12] Thum T,Hoeber S,Froese S,et al.Age-dependent impairment of endothelial progenitor cells is corrected by growth-hormone-mediated increase of insulin-like growthfactor-1[J].Circ Res,2007,100(3):434-443.
[13] Di Marco GS,Rustemeyer P,Brand M,et al.Circulating endothelial progenitor cells in kidney transplant patients[J].PLoS One,2011,6(9):e24046.
[14] Chen JY,Feng L,Zhang HL,et al.Differential regulation of bone marrow-derived endothelial progenitor cells and endothelial outgrowth cells by the Notch signaling pathway[J].PLoS One,2012,7(10):e43643.
[15]Wu X,Zou Y,Zhou Q,et al.Role of Jagged1 in arterial lesions after vascular injury[J].Arterioscler Thromb Vasc Biol,2011,31(9):2000-2006.
[16]Walsh K,Takahashi A.Transcriptional regulation of vascular smooth muscle cell phenotype[J].Z Kardiol,2001,90(Suppl 3):12-16.
[17]王生兰,苏 娟,徐一洲,等.大鼠血管平滑肌细胞体外培养的表型转换及其鉴定[J].中国动脉硬化杂志,2008,16(4):268-272.
[18] Wu X,Zhou Q,Huang L,et al.Ageing-exaggerated proliferation of vascular smooth muscle cells is related to attenuation of Jagged1 expression in endothelial cells[J].Cardiovasc Res,2008,77(4):800-808.
[19] Deb A.Cell-cell interaction in the heart via Wnt/β-catenin pathway after cardiac injury[J].Cardiovasc Res,2014,102(2):214-223.
[20] Lilly B.We have contact:endothelial cell-smooth muscle cell interactions[J].Physiology(Bethesda),2014,29(4):234-241.
[21]武晓静,黄 岚,赵 刚,等.内皮细胞表型改变对平滑肌细胞表型转换及迁移的作用[J].高血压杂志,2003,11(5):473-475.
[22]Shav D,Gotlieb R,Zaretsky U,et al.Wall shear stress effects on endothelial-endothelial and endothelial-smooth muscle cell interactions in tissue engineered models of the vascular wall[J].PLoS One,2014,9(2):e88304.
