响应面优化水提取燕麦抗真菌蛋白的研究
2015-11-07苏日娜张美莉
苏日娜,张美莉
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
响应面优化水提取燕麦抗真菌蛋白的研究
苏日娜,张美莉*
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
以裸燕麦籽粒为原料,利用水提取燕麦蛋白中的抗真菌蛋白(antifungal protein),用打孔法观察并测量抑菌圈直径,在单因素实验的基础上,应用响应面分析法,探讨提取时间、提取温度、pH以及液料比对燕麦抗真菌蛋白抑菌性的影响,确定燕麦抗真菌蛋白的最佳水提工艺。实验结果:当提取时间12h,提取温度30℃,pH7.5,液料比12∶1mL/g时,抑菌圈直径达到最大为18.10mm。
燕麦,抗真菌蛋白,水提取法,响应面分析法
植物病害是病原真菌侵染所引致的[1]。真菌病害会导致粮食作物减产,经济作物品质降低。然而,在长期生长进化的过程中,高等植物其自身常产生一些物质来与外源侵袭物对抗,抗真菌蛋白就是其中的一类,他们可以抑制真菌生长或杀死真菌。一些学者发现抗真菌蛋白还具有抑制HIV病毒反转录的功能[2-3]。抗真菌蛋白可以作为天然食品防腐剂,凭借其抗菌性强、安全、无毒等特点受到广泛关注[4]。因此从食源性材料中提取抗真菌蛋白是未来研制天然食品防腐剂的一个趋势。目前,已经从多种食源性材料中提取到抗真菌蛋白,如苦荞、黑麦、豌豆、萝卜、香蕉等[5-9],但是关于燕麦中提取抗真菌蛋白从未报道。
燕麦,又被称为莜麦、玉麦、雀麦、铃铛麦,其蛋白质含量在所有谷物中最高[10]。燕麦蛋白质含有18种氨基酸,其必需氨基酸组成合理、全面,特别含有谷物类普遍缺乏的氨基酸,含量高达约0.68g/100g,是大米和小麦的2倍以上,是其他粮食作物所不及的。相关研究表明燕麦同时具有降血脂、降血糖、免疫增强、抗氧化、益生等多种保健功能[11-13]。本实验以裸燕麦为原料,利用水提取法,研究在水提取过程中抑真菌活性的变化,确定水提取燕麦抗真菌蛋白的最佳工艺条件,以期为深入加工、开发燕麦蛋白资源提供参考。
1 材料与方法
1.1材料与仪器
裸燕麦籽粒吉林白城农科院提供;链格孢菌内蒙古农业大学农学院植物病害与保护实验室保藏;无水乙醚国药集团化学试剂有限公司,分析纯;G-250考马斯亮蓝北京金锐林有限公司;牛血清白蛋白北京金锐林有限公司。
HH-6型电子恒温水浴锅常州国华电器有限公司;PB-10型酸度计美国赛多利斯公司;真空冷冻干燥机北京博医康实验仪器有限公司;粉碎机浙江高鑫工贸有限公司;SIGMA 3-18k型高速冷冻离心机德国SIGMA公司;超净台北京东联哈尔仪器制造有限公司;SPX-80BSH-Ⅱ型生化培养箱上海新苗医疗器械制造有限公司。
1.2实验方法
1.2.1燕麦抗真菌蛋白样品制备工艺流程裸燕麦籽粒→粉碎→过80目筛→索式抽提脱脂→自然干燥(12h)→加入超纯水→搅拌浸提→4℃、10000r/min离心10min→取上清液→冷冻干燥→燕麦水提取蛋白冻干粉。
1.2.2燕麦抗真菌蛋白水提取法单因素实验设计
1.2.2.1提取时间对燕麦抗真菌蛋白抑菌性的影响准确称取5g脱脂燕麦粉,加入50mL超纯水,调节pH到7.0,在30℃水浴分别搅拌浸提8、10、12、14、16h,测量样品的抑菌圈直径。
1.2.2.2提取温度对燕麦抗真菌蛋白抑菌性的影响准确称取5g脱脂燕麦粉,加入50mL超纯水,调节pH到7.0,分别在20、25、30、35、40℃的水浴中搅拌浸提12h,测量样品的抑菌圈直径。
1.2.2.3pH对燕麦抗真菌蛋白抑菌性的影响准确称取5g脱脂燕麦粉,加入50mL超纯水,调节pH到6.5、7.0、7.5、8.0、8.5,在30℃水浴中搅拌浸提12h,测量样品的抑菌圈直径。
1.2.2.4液料比对燕麦抗真菌蛋白抑菌性的影响准确称取5g脱脂燕麦粉,调节pH到7.0,分别以液料比5∶1、10∶1、15∶1、20∶1、25∶1mL/g,在30℃水浴中搅拌浸提12h,测量样品的抑菌圈直径。
1.2.3水提工艺响应面设计根据单因素实验结果,采用统计软件Design Expert中的Box—Behnken设计,确定对抑菌圈大小有影响的四个因素。以提取时间、提取温度、pH、液料比为自变量,选取抑菌圈直径作为响应变量,进行四因素三水平的响应面优化实验(表1)。

表1 响应面实验设计表Table 1 Coded values and corresponding actual values of the optimization parameters used in responses surface analysis
1.2.4提取液蛋白得率的测定采用考马斯亮蓝法[14],以标准蛋白质溶液的吸光度A为纵坐标,以标准蛋白质溶液的浓度C为横坐标,绘制标准曲线。取0.05mL燕麦提取蛋白液,准确加入蒸馏水至1mL,再加入5mL考马斯亮蓝G-250溶液,摇匀,静置2min,测定595nm处吸光度,查标准曲线即可得燕麦提取液蛋白含量。参比为1mL蒸馏水加入5mL考马斯亮蓝G-250溶液。
蛋白得率(mg/g)=提取液蛋白质量(mg/mL)/原料总质量(g)×提取液总体积(mL)
1.2.5抑菌圈的测定
1.2.5.1打孔法以链格孢菌作为指示菌,将链格孢菌接种到马铃薯(PDA)培养基中心,用灭过菌的打孔器在平皿上十字对称打四个孔,打孔直径为6mm。在三个孔中分别加入20μL的浓度为50mg/mL的燕麦水提取蛋白样品,一个孔作为空白对照加入20μL的灭菌蒸馏水,将培养基平稳地置于28℃恒温培养箱中培养48h,测量并记录抑菌圈直径,每个样品做三个重复,三个平行样。
1.2.5.2抑菌圈直径的测量方法在反射光的照射条件下用游标卡尺在培养皿背面测量抑菌圈直径,垂直测量三次,取平均值[15]。
1.2.6数据处理方法实验数据均经过三次平行实验得到的平均值,响应面实验数据采用Design Expert 8.0软件绘图并作方差和显著分析等。
2 结果与分析
2.1标准蛋白质溶液测定曲线
以标准蛋白质溶液的浓度C为横坐标,标准蛋白质溶液的吸光度A为纵坐标,绘制标准蛋白溶液标准曲线图。如图1标准曲线方程为:y=4.3083x+0.3823(R2=0.9971)。
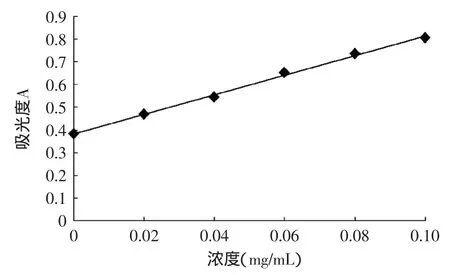
图1 标准曲线Fig.1 Standard curve
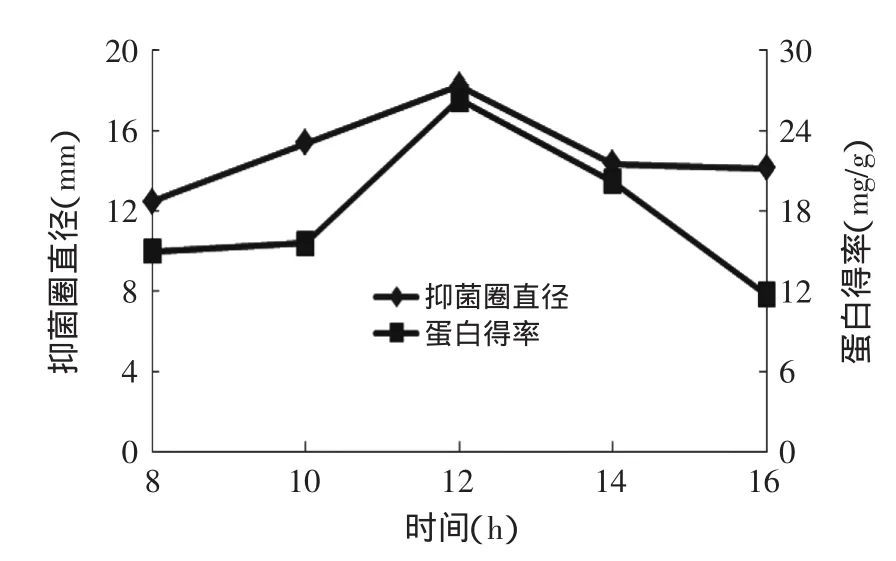
图2 提取时间对燕麦抗真菌蛋白抑菌性和蛋白得率的影响Fig.2 Effect of extraction time on oat protein antifungal activity and rate of protein extraction
2.2单因素实验
2.2.1提取时间对燕麦抗真菌蛋白抑菌性的影响由图2可知,提取时间在8~12h的范围内,随着提取时间的不断增加,抑菌圈直径和蛋白得率逐渐变大,当提取时间到达12h时,抑菌圈直径和蛋白得率都达到了最大。在此之后,随着提取时间增加,抑菌圈直径和蛋白质得率开始降低。这是因为提取时间会影响到溶剂与燕麦中抗真菌蛋白的接触与溶解。但是浸提时间过长,会引起燕麦中抗真菌蛋白抑菌性下降。所以选择12h为响应面时间因素的中心值。
2.2.2提取温度对燕麦抗真菌蛋白抑菌性的影响由图3可知,随着温度的升高,抑菌圈直径和蛋白得率也随之增大,温度达到30℃时,蛋白得率达到了最大。此时,该提取温度为燕麦中抗真菌蛋白溶出的最适温度,所以抑菌性也达到了最大。所以选择30℃为响应面的中心值。
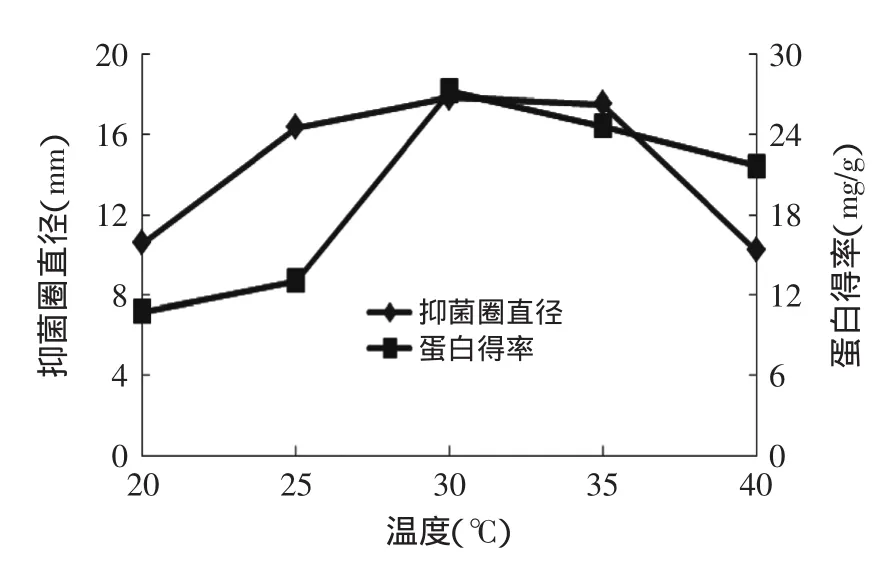
图3 提取温度对燕麦抗真菌蛋白抑菌性和蛋白得率的影响Fig.3 Effect of extraction temperature on oat protein antifungal activity and rate of protein extraction
2.2.3pH对燕麦抗真菌蛋白抑菌性的影响由图4可知,pH从6.0~7.0时,抑菌圈直径缓慢增大,当pH达到7.5时达到最大,抑菌圈直径为17.72mm。而蛋白得率随着pH的增大逐渐增大,pH为7.5时达到最大。这可能是因为燕麦抗真菌蛋白为一种偏碱性蛋白,过酸或过碱的条件下,会造成燕麦抗真菌蛋白质的结构发生变化,从而影响了抑菌效果。所以,选择7.5为响应面中心值。
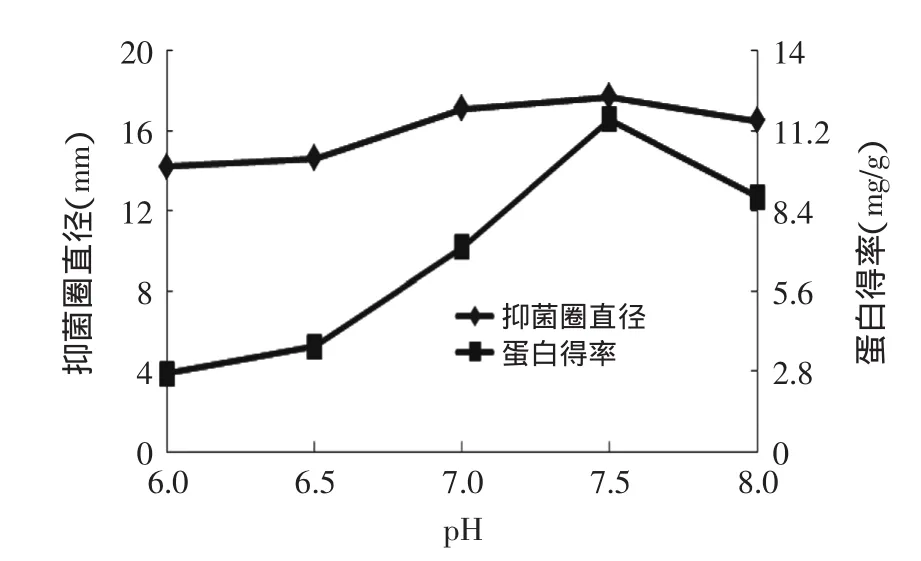
图4 pH对燕麦抗真菌蛋白抑菌性和蛋白得率的影响Fig.4 Effect of pH on oat protein antifungal activity and rate of protein extraction
2.2.4液料比对燕麦抗真菌蛋白抑菌性的影响由图5可知,随着液料比增大,抑菌圈直径逐渐变大,当液料比为10∶1mL/g时,抑菌圈直径达到了最大,但在液料比增至15∶1mL/g后,液料比对抑菌圈直径影响不大。而蛋白得率一直呈下降趋势。这是因为液料比过小可能会影响到燕麦中抗真菌蛋白的溶解情况,而液料比过大又会减少蛋白质含量,导致抑菌性下降,造成原料的浪费。所以,选择液料比10∶1mL/g作为响应面中心值。
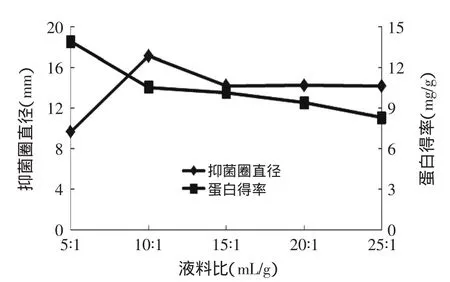
图5 液料比对燕麦抗真菌蛋白抑菌性和蛋白得率的影响Fig.5 Effect of liquid-to-solid ratio on oat protein antifungal activity and rate of protein extraction
2.3响应面优化实验结果与分析
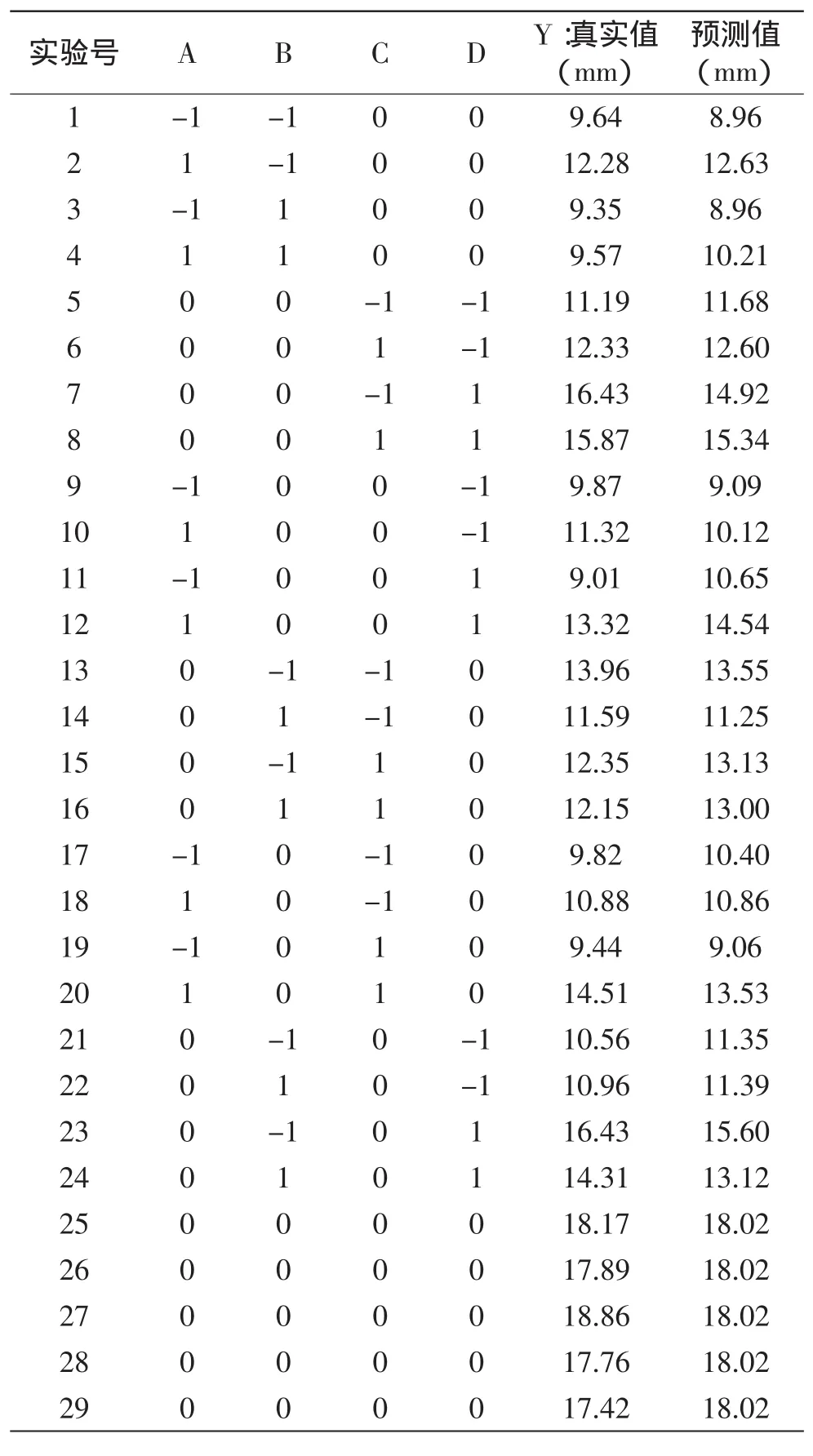
表2 响应曲面法优化水提条件的实验设计与结果Table 2 Experimental design and results for responses surface analysis
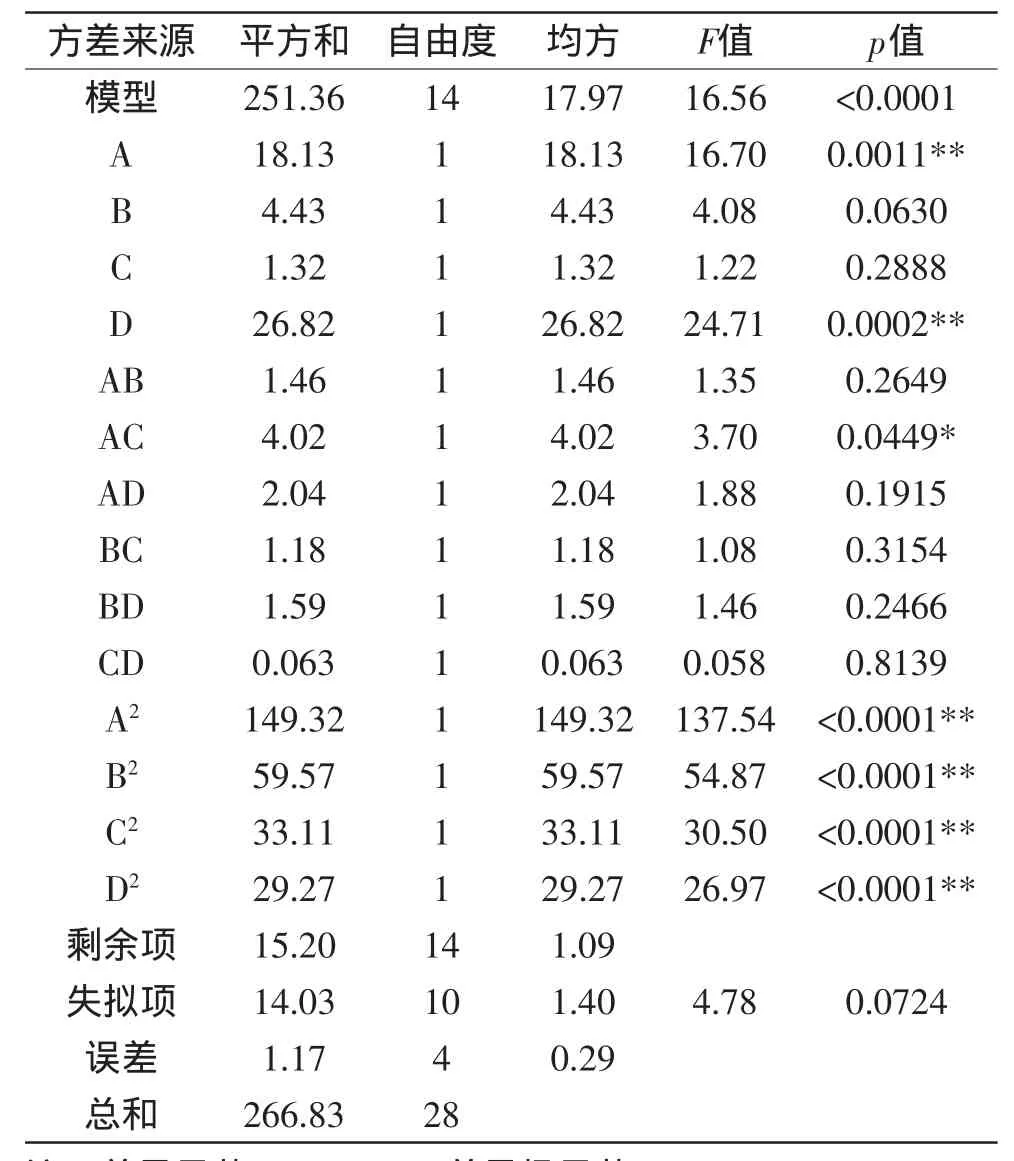
表3 方差分析表Table 3 Variance analysis for antifungal activity
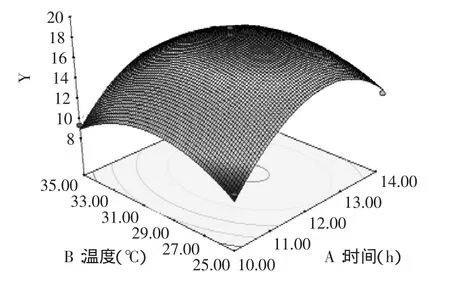
图6 温度和时间对对燕麦抗真菌蛋白抑菌性的响应曲面Fig.6 Extraction temperature and extraction time showing the effects on oat protein antifungal activity
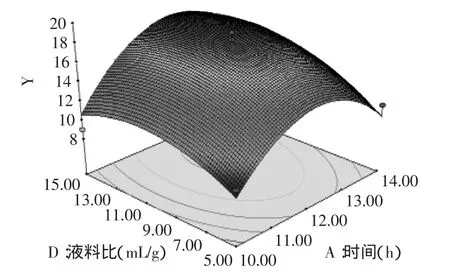
图7 液料比与时间对燕麦抗真菌蛋白抑菌性的响应曲面Fig.7 Liquid-to-solid ratio and extraction time showing the effects on oat protein antifungal activity
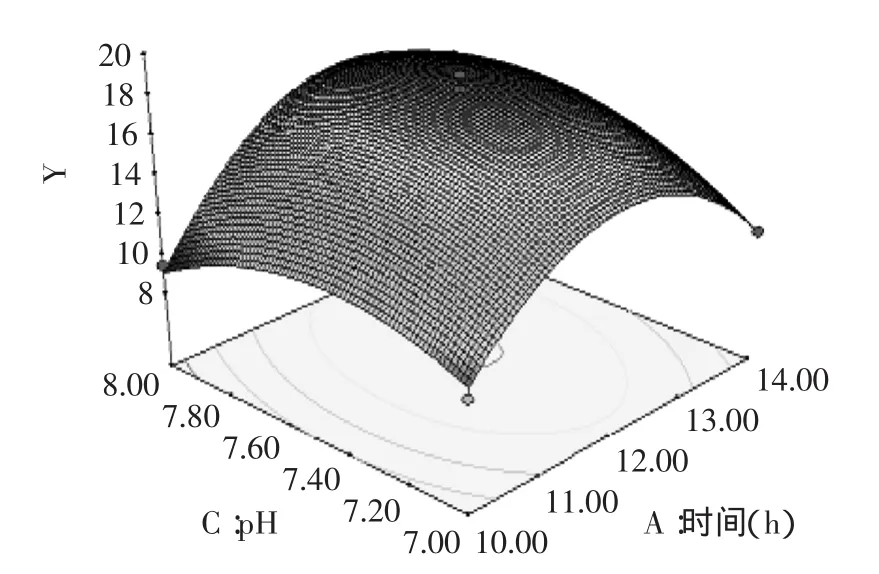
图8 pH与时间对燕麦抗真菌蛋白抑菌性的响应曲面Fig.8 pH and extraction time showing the effects on oat protein antifungal activit
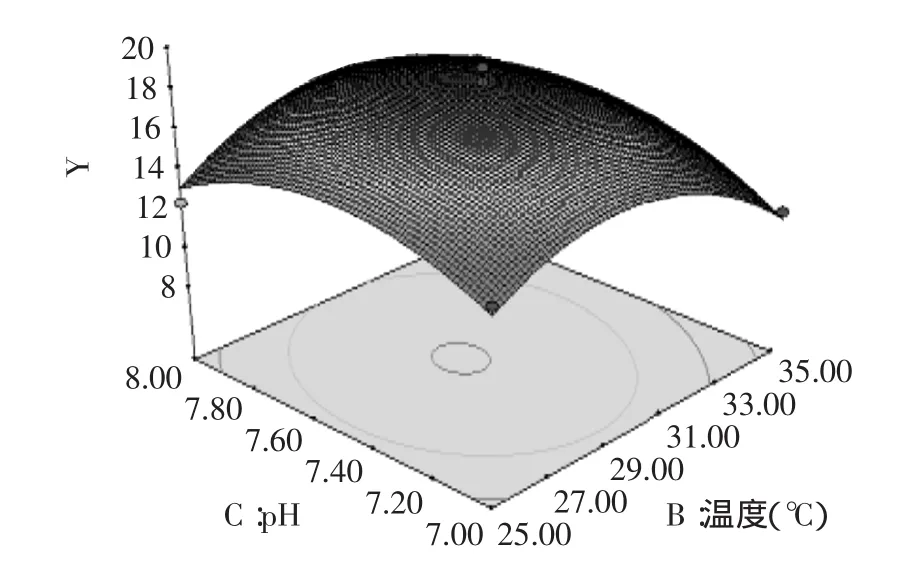
图9 pH与温度对燕麦抗真菌蛋白抑菌性的响应曲面Fig.9 pH and extraction temperature showing the effects on oat protein antifungal activity
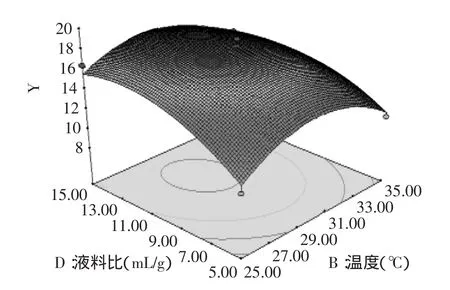
图10 液料比与温度对燕麦抗真菌蛋白抑菌性的响应曲面Fig.10 Liquid-to-solid ratio and extraction temperature showing the effects on oat protein antifungal activity
其二次方程为:
Y=18.02+1.23A-0.61B+0.33C+1.50D-0.61AB+ AC+0.71AD+0.54BC-0.63BD-0.13CD-4.80A2-3.03B2-2.26C2-2.12D2
对建立的模型进行方差分析,由表3的方差分析结果可以看出,模型p值极显著。失拟p=0.0724>0.05,不显著。说明未知因素对实验结果影响小。R2= 0.9430,说明该模型拟合度良好,实验误差小。回归系数显著性检验显示,一次项A、D和二次项A2、B2、C2、D2对燕麦抗真菌蛋白抑菌性影响均达到了极显著(p<0.01)水平。模型可以看出各个因素对燕麦抗真菌蛋白抑菌性影响的大小顺序:液料比(D)>提取时间(A)>提取温度(B)>pH(C)。
2.4响应面结果分析
由图6~图11可以看出,提取时间与pH交互作用显著,其余各因素之间交互作用都很小。根据模型优化的最佳水提条件:提取时间12.35h,提取温度29.24℃,pH7.54,液料比12.01mL/g,抑菌圈直径18.49mm。
2.5验证实验
结合实际条件,最终选择的实验条件:提取时间12h,提取温度30℃,pH7.5,液料比12mL/g,进行三组平行验证实验,实验得出实际数值为18.10mm与预测值18.49mm的差异为0.02%,说明该回归方程能够比较真实的反映各因素对燕麦抗真菌蛋白抑菌性的影响。证明响应面优化提取条件真实可靠。
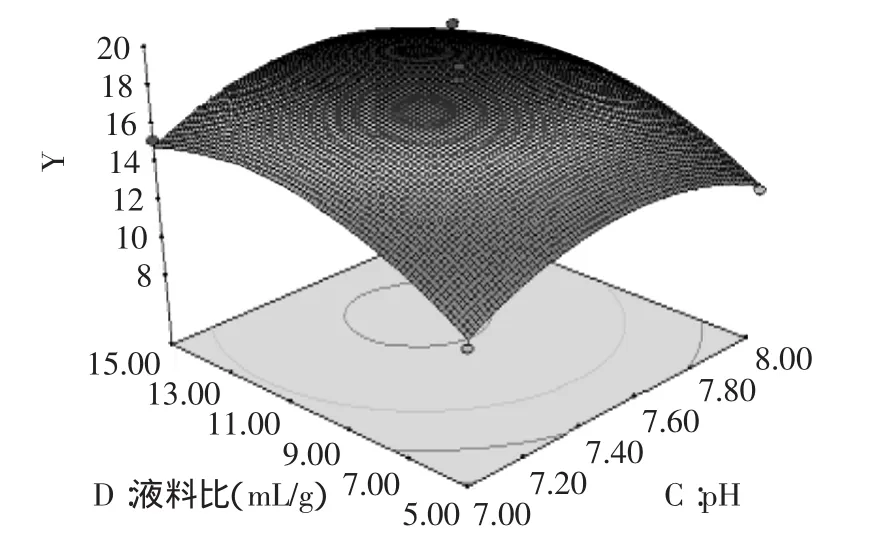
图11 液料比与pH对燕麦抗真菌蛋白抑菌性的响应曲面Fig.11 Liquid-to-solid ratio and pH showing the effects on oat protein antifungal activity
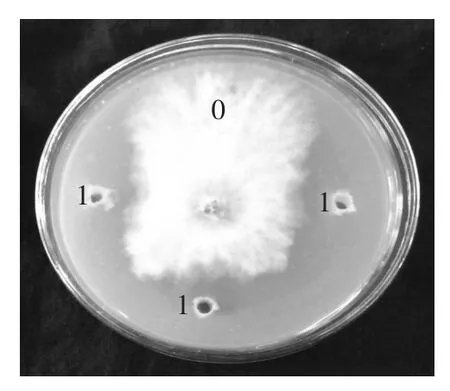
图12 验证实验结果Fig.12 Validation of the optimized process conditions
3 结论
水提取燕麦抗真菌蛋白的最优工艺参数:提取时间12h,提取温度30℃,pH7.5,液料比12∶1mL/g。在此条件下,抑菌圈直径达到18.10mm,与预测值18.49mm的差异为0.02%。证明响应面优化水提取燕麦抗真菌蛋白的条件是合理可靠的。该研究结果对燕麦抗真菌蛋白的进一步分离、纯化提供了理论基础。但本实验只选取一种菌作为指示菌,代表性不强,后续的工作应系统地研究燕麦抗真菌蛋白的抑菌活性。
[1]康振生.我国植物真菌病害的研究现状及发展策略[J].植物保护,2010,36(3):9-12.
[2]Park C J,Park C B,Hong S S,et al.Characterization and cDNA cloning of two glycine-and histidine-rich antimicrobial peptides from the roots of shepherd’s purse,Capsella bursapastoris[J].Plant Molecular Biology,2000,44(2):187-197.
[3]Ishisaki K,Honda Y,Taniguchi H,et al.Heterogonous expression and characterization of a plant class IV chitinase from thepitcherofthecarnivorousplantNepenthesalata[J]. Glycobiology,2012,22(3):345-351.
[4]Rensen H P,Madsen L S,Petersen J,et al.Oat(Avena sativa)seed extract as an antifungal food preservative through the catalytic activity of a highly abundant class I chitinase[J].Appl Biochem Biotechnol,2010(160):1573-1584.
[5]Leung E H W,Ng T B.A relatively stable antifungal peptide from buckwheat seeds with antiproliferative activity toward cancer cells[J].Journal of Peptide Science,2007,13(11):762-767.
[6]那冰,余明琨,龚隽,等.小黑麦抗真菌蛋白组分的分离纯化和性质研究[J].生物工程学报,2002(5):561-565.
[7]Wang H X,Ng T B.An antifungal protein from the pea Pisum sativum var.arvense Poir[J].peptides,2006,27:1732-1737.
[8]Thevissen K,De Mello Tavares P,Xu D,et al.The plant defensin RsAFP2 induces cell wall stress,septin mislocalization and accumulation of ceramides in Candida albicans[J].Molecular microbiology,2012,84(1):166-180.
[9]Vincent S M H,Jack H W,Ng T B.A thaumatin-like antifungal protein from the emperor banana[J].Peptides,2007(28):760-766.
[10]章海燕,张晖,王立,等.燕麦研究进展[J].粮食与油脂,2009(8):7-9.
[11]任顺成,马瑞萍.燕麦的功效因子及其保健功能[J].粮食科技与经济,2013(3):58-60.
[12]吕耀昌,郑殿升,赵炜.燕麦保健功能的开发利用[J].农产品加工,2011(3):8-9.
[13]周素梅,盛清凯,路长喜,等.不同燕麦品种的辅助降血脂功效研究[J].中国粮油学报,2011(3):25-29.
[14]董娜,贾艳菊,张晓,等.考马斯亮蓝法测定奶粉中蛋白的研究[J].食品科技,2011(11):272-274.
[15]王硕,朱超,杜欣军,等.食源性阪崎肠杆菌耐药性分析及超广谱β-内酰胺酶检测[J].食品科技,2011,36(9):330-333.
Study on the optimization of water extraction of oat antifungal protein by response surface anaylsis
SU Ri-na,ZHANG Mei-li*
(Food Science and Engineering College,Inner Mongolia Agricultural University,Hohhot 010018,China)
Antifungal proteins were extracted from seeds of naked oat by water extraction method.The antifungal activity of the protein was evaluated by hole method.Based on single factor method,response surface analysis were used to explore the effects of extraction time,extraction temperature,pH and liquid-to-solid ratio on antifungal activity of oat antifungal protein.These methods determined the optimal water extraction conditions of oat antifungal protein.Results:The optimal extraction time,extraction temperature,pH and liquid-to-solid ratio were 12h,30℃,7.5,12∶1mL/g.The actual maximum diameter of inhibition zone was 18.10mm.
oat;antifungal protein;water extraction method;response surface anaylsis
TS213.3
B
1002-0306(2015)14-0312-05
10.13386/j.issn1002-0306.2015.14.055
2014-12-08
苏日娜(1989-),女,在读硕士研究生,研究方向:植物活性成分的分离纯化。
张美莉(1966-),女,博士,教授,研究方向:植物活性成分的分离纯化。
