具有拮抗胶孢炭疽菌活性酵母菌的分离和筛选
2015-11-07罗姗姗王润菡邵远志
罗姗姗,王润菡,万 斌,邵远志
(海南大学食品学院,海南海口570228)
具有拮抗胶孢炭疽菌活性酵母菌的分离和筛选
罗姗姗,王润菡,万斌,邵远志*
(海南大学食品学院,海南海口570228)
从芒果果皮、叶片和芒果园土壤中分离筛选得到具有拮抗胶孢炭疽菌(Colletotrichum gloeosporioides)活性的酵母菌,研究其对芒果中胶孢炭疽菌的抑制作用。采用平板对峙法和活体实验进行筛选,采用形态学及rDNA-ITS序列分析等方法进行鉴定。通过平板对峙和活体实验筛选发现,菌株T18对芒果炭疽病病原菌胶孢炭疽菌的拮抗作用明显。抑菌实验表明,当T18菌悬液浓度为1×108cfu/mL时,对胶孢炭疽菌的抑菌半径为14.33mm。活体实验中,经T18处理的芒果果实炭疽病病斑直径仅为1.58mm,具有较强抑菌效果。通过菌落和菌体形态、生理生化、ITS序列分析对菌株T18进行鉴定,最终确定为尼泊尔德巴利酵母(Debaryomyces nepalensis)。
胶孢炭疽菌,酵母菌,筛选,鉴定
芒果(Mangifera indica.L)又称檬果,是热带和亚热带地区非常重要的水果。芒果营养丰富,并以其美观的果形、鲜美的色泽、香甜的果肉、芳香的气味而闻名于世,素有“热带水果之王”的美誉。但芒果果实贮藏较为困难,其中炭疽病是芒果采后贮藏运输过程中的主要病害,引起的芒果腐烂损失可达20%~30%[1]。长期以来,炭疽病的防治主要依赖使用化学杀菌剂[2],然而多菌灵、苯来特和甲基硫菌灵等苯并咪唑类杀菌剂的长期大量使用,导致炭疽病主要致病菌胶孢炭疽菌对该类杀菌剂产生了抗药性,使得防效下降。近年来,随着人们对环境保护和食品安全越来越重视,研发更加安全、环保的芒果炭疽病防治新技术(如生物防治),显得更加迫切[3-4]。在生防菌中,由于酵母具有抗逆性强、能在营养贫瘠的条件下生长、繁殖快速、不产生抗生素、受杀虫剂影响较小等优点,逐渐成为研究的热点[5-7]。以拮抗酵母菌制成的生物制剂取代化学菌剂也将成为果蔬保鲜绿色环保防治措施的必然趋势。
目前已报道的拮抗酵母菌有10余种,包括季也蒙毕赤酵母[8]、汉逊德巴利酵母、瓦尔维亚假丝酵母[9]等,主要用于防治果蔬贮藏时期的青霉病、绿霉病、灰霉病及其他腐烂病。此外,研究发现,多数拮抗酵母菌分离于健康芒果果皮表面或果实伤口处。为此,本研究从海南不同品种的芒果果皮、叶片以及不同地区芒果园土壤中分离筛选对胶孢炭疽菌具有拮抗作用的酵母菌,为进一步应用酵母菌防治芒果炭疽病奠定基础。
1 材料与方法
1.1材料与仪器
芒果果实摘自海南三亚芒果园,品种分别为红贵妃、鸡蛋芒、台农、象牙芒、澳芒、凯特芒、吕宋芒、金煌芒、红玉芒、苹果芒;土壤、叶片均取自海南三亚昌江芒果园;酵母膏、细菌学蛋白胨、细菌学琼脂粉分析纯,广东环凯微生物科技有限公司;无水葡萄糖分析纯,国药集团化学试剂有限公司;EX Taq酶、dNTP、100 bp DNA Ladder(Dye Plus) TaKaRa;引物(ITS1:5’-TCCGATGGTGAACCTGCGG-3、ITS4:5’-TCCTCCGCTTATTGATATGC-3’) 上海生工生物工程技术服务有限公司;Marker II(MD102) 天根生化科技(北京)有限公司。
AL-204电子分析天平梅特勒-托利多仪器(上海)有限公司;ZEALWAYGR60DA高压灭菌器厦门致微仪器有限公司;LRH-150B生化培养箱广东省医疗器械厂;SW-CJ-2FD超净工作台苏州尚田洁净技术有限公司;BHWV-200变频摇床宁波海曙赛福实验仪器厂;Nikon ECLIPSE Ci-s/Ci-L显微镜南京衡桥仪器有限公司;101-2型电热鼓风干燥箱常州市华普达教学仪器有限公司;A200基因扩增仪杭州朗基科学仪器有限公司;TG16KR台式高速冷冻离心机长沙东旺实验仪器有限公司;RDY-SP1Z核酸电泳仪北京容阳经典科技有限公司;JY04S-3C凝胶成像系统北京君意东方电泳设备有限公司。
1.2实验方法
1.2.1菌株的分离纯化为扩大酵母菌种资源,对海南地区不同品种的芒果果实及其叶片、土壤中的菌种进行分离筛选。采用稀释平板法和平板划线法多次分离、纯化酵母菌和芒果炭疽病原菌,直至获得纯培养物[10-11]。
1.2.2病原菌的鉴定及致病性检测参照《真菌鉴定手册》,同时采用rDNA-ITS序列分析(引物ITS1:5’-TCCGATGGTGAACCTGCGG-3’、引物ITS4:5’-TCCTCCGCTTATTGATATGC-3’)对芒果炭疽病原菌进行鉴定,确定病原菌种类。
1.2.3离体防效实验在平板上对分离纯化的酵母菌和芒果炭疽菌进行对峙培养[12]。测量抑菌带宽,每个测量重复4次,计算平均值。
1.2.4活体防效实验参考Lima等[13]的方法:用接种针在果实腰部制造一个4mm(深)×3mm(宽)的伤口,室温下干燥1h,分别接种离体复筛抑菌效果较好、浓度为1×108cfu/mL的酵母悬浮液20μL,4h后接种20μL浓度为1×106个/mL的炭疽菌孢子悬浮液。设无菌水(只加入40μL无菌水)和CK(20μL无菌水+ 20μL C.gloeosporioides菌液)两种对照,室温晒干后,于28℃高湿条件下培养。分别于接种第6d和12d观察各处理果实的病斑直径及其发病率,每个测量重复4次,计算平均值,筛选出拮抗效果最好且稳定的酵母菌。
1.2.5酵母菌的鉴定菌体形态特征观察参照沈萍等[14]的方法,采用美兰浸片染色法,生理生化特征按照《酵母菌的特征与鉴定手册》进行[15]。同时采用rDNA-ITS序列分析(引物ITS1:5’-TCCGATGGTGAA CCTGCGG-3’、引物ITS4:5’-TCCTCCGCTTATTGAT ATGC-3’)对酵母菌进行分子生物学鉴定。
1.2.6数据分析实验中所有数据采用SPSS Statistics 19.0统计分析软件进行处理,采用ANOVA进行Duncan多重差异分析。
2 结果与分析
2.1酵母菌的分离、筛选
本研究从不同品种芒果表皮分离纯化酵母菌192株,土壤分离97株,叶片分离70株,共分离359株(图1),其中从芒果果皮病健交界处分离到的菌株最多,占总分离酵母数的33.70%。不同品种的芒果分离结果也有所差异,其中从吕宋芒、象牙芒、凯特芒处分离的酵母最多,分别为74、55、29株,占总分离酵母菌数的20.61%、15.32%、8.07%。所有酵母菌接种于试管斜面,4℃保藏。

图1 酵母菌菌株培养形态Fig.1 The colony morphology of yeasts
2.2炭疽病原菌的鉴定及致病性检测结果
2.2.1炭疽病原菌的形态特征观察结果菌落近圆形,边缘整齐。气生菌丝白色至灰白色,渐变为深灰色,絮状或绒状(图2A)。分生孢子圆筒形或长椭圆形,有些一端稍尖,单胞无色,有油球(图2B)。在PDA培养基上,多数菌株在后期能产生橘红色或黑色的分生孢子堆,分生孢子梗短小,单枝,分生孢子圆柱形、椭圆形或卵圆形,单孢,近中部有一油球。
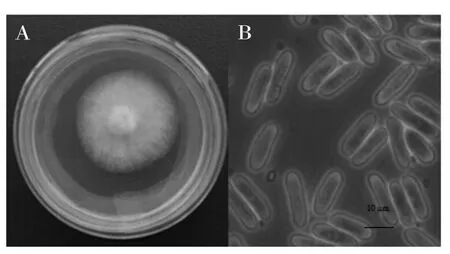
图2 胶孢炭疽菌菌落形态(A)和菌体形态(B)Fig.2 Photographs of colonies(A)and cells(B)of the C.gloeosporioides
2.2.2病原菌的致病性检测依据柯赫氏法则,从病果的病健交界处分离的芒果炭疽病原菌,在PDA培养基上分离纯化,获得炭疽病原菌纯培养;再将纯培养菌株接种到健康的芒果果实上,出现了相同症状的病害;从接种发病的芒果果实上再分离得到的纯培养,性状与接种物相同。
2.2.3炭疽病原菌的rDNA-ITS序列分析结果由图3并结合rDNA-ITS序列分析结果可知,该病原菌的ITS序列全长为576bp,在GenBank数据库中进行Blast同源性分析,结果表明菌株与Colletotrichum gloeosporioides的同源性为100%(EU149938)。综合以上各项实验结果,可以鉴定该病原菌为胶孢炭疽菌。
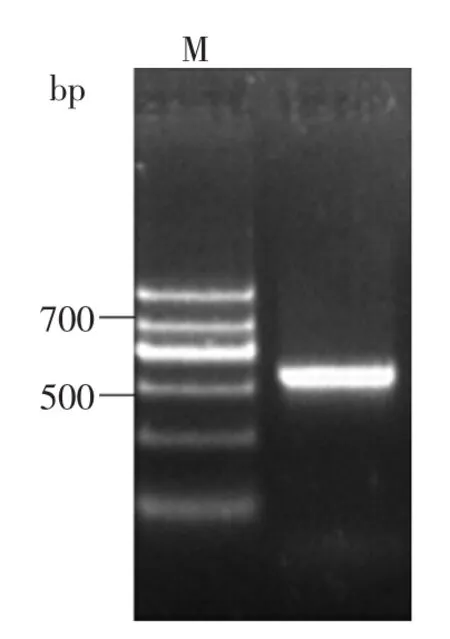
图3 病原菌的rDNA-ITS电泳图谱Fig.3 PCR amplification of rDNA-ITS sequence of the pathogen
2.3平板对峙法拮抗酵母菌筛选结果
通过平板对峙法初筛,共筛选出对胶孢炭疽菌有拮抗作用的酵母菌67株,占总分离酵母菌株的18.66%。再经过平板对峙法复筛,从67株拮抗胶孢炭疽菌的酵母菌中共筛选出21株抑菌圈较明显的酵母菌,菌种名称及其抑菌带宽见表1。其中从吕宋芒果果皮分离到的拮抗胶孢炭疽菌的酵母菌最多,为7株,占21株酵母菌的33.33%,从象牙芒、红贵妃、表金煌芒和凯特芒果皮表面分离得到有效拮抗酵母菌株数依次为6、5、2、1,分别占其总数的28.57%、23.81%、9.52%和4.77%。再次复筛得到4株酵母菌,由表1可知,F1-3、T18、T21、LA-4这4株酵母菌对胶孢炭疽菌的拮抗作用较明显,抑菌带宽分别为14.90、14.33、12.45、12.45mm(图4)。
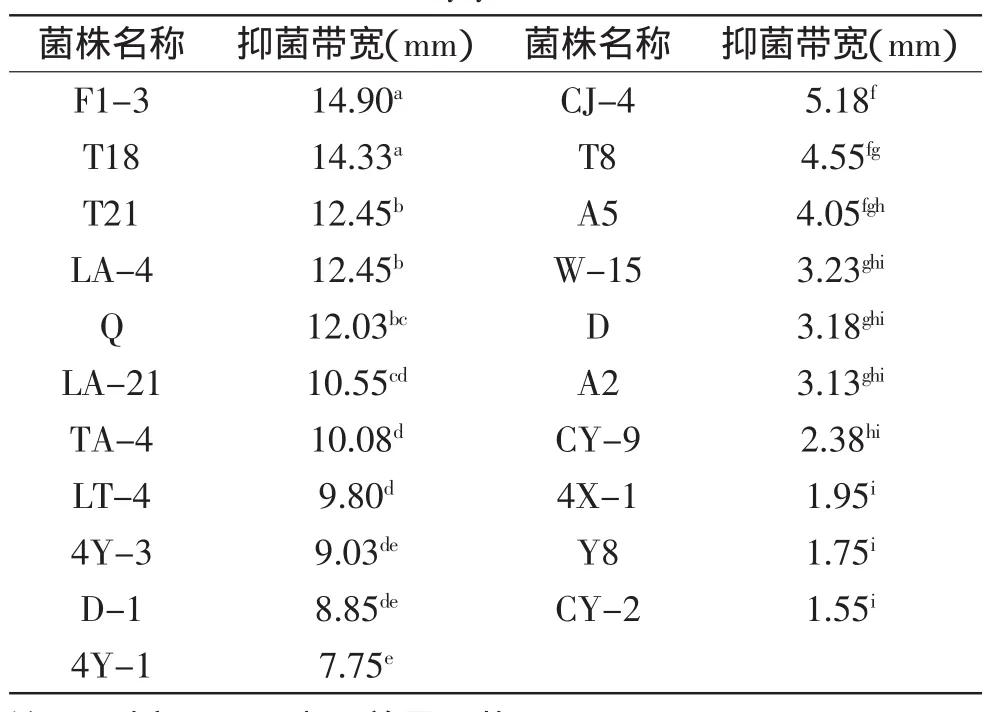
表1 拮抗胶孢炭疽菌的酵母菌离体复筛结果Table 1 Results of in vitro inhibition of C.gloeosporioides by yeasts

图4 拮抗酵母菌在PDA平板上对胶孢炭疽菌的抑菌效果Fig.4 Antagonistic action of yeast strains on C.gloeosporioides in PDA medium
2.4拮抗酵母菌活体筛选结果
将复筛得到的21株酵母菌与胶孢炭疽菌(各20μL)共同接种到芒果果实伤口处,于28℃高湿条件下培养后发现,经菌株T18处理的芒果果实炭疽病病斑直径为1.58mm,显著(p<0.05)低于CK的13.11mm。菌株F1-3、LA-4、T21接种到果实上基本没有表现出抑菌效果,其果实病斑直径分别为11.31、10.97和12.91mm,与CK的差异不显著(p≥0.05)。
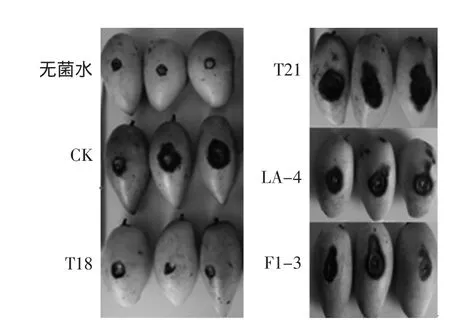
图5 酵母菌T18、T21、LA-4、F1-3的活体筛选结果Fig.5 Results of in vivo test of T18、T21、LA-4 and F1-3
2.5拮抗胶孢炭疽菌酵母菌的形态特征观察结果
平板菌落奶白色,不透明,表面光滑且粘稠,边缘光滑,反光,有发酵的香气(图6A)。麦芽汁液体培养基中25℃培养三天,菌体呈椭圆形,芽殖,未观察到假菌丝(图6B)。

图6 酵母菌T18菌落形态(A)和细胞形态(B)Fig.6 Photographs of colonies(A)and cells(B)of T18
2.6拮抗酵母菌的生理生化特征
对菌株T18进行了生理生化实验,包括糖类发酵实验、碳源同化实验、氮源同化实验,结果如表2所示。

表2 酵母菌T18的生理生化鉴定结果Table 2 Result of biochemical and physiological identification of T18
2.7拮抗胶孢炭疽菌酵母菌的ITS序列分析结果
PCR扩增结果显示(图7),扩增得到的序列大小约647bp。将扩增得到的产物进行测序,所测得序列经过与GenBank数据库中的已有序列进行Blast分析后发现,菌株T18与GenBank中Debaryomyces nepalensis的rDNA-ITS序列相似性为99%(JN942654)。根据同源性比较结果,可以初步确定菌株T18为尼泊尔德巴利酵母(D.nepalensis)。
综合形态学观察、生理生化测定和ITS序列分析结果,酵母菌T18被鉴定为尼泊尔德巴利酵母(D. nepalensis)。
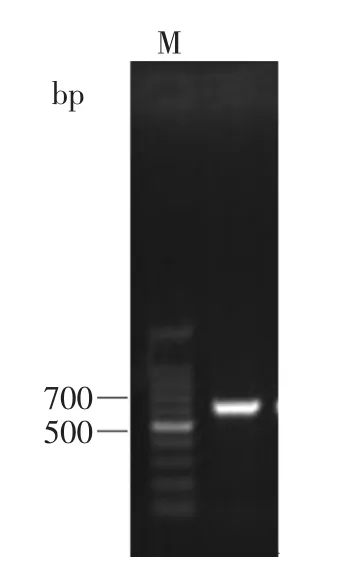
图7 酵母菌T18的rDNA-ITS电泳图谱Fig.7 PCR amplification of rDNA-ITS sequence of T18
3 结论
本研究从土壤中分离筛选出的T18菌株在离体防效实验和活体防效实验对芒果胶孢炭疽菌都具有明显的拮抗效果。通过形态学、生理生化实验和分子生物学相结合的方法对该菌株进行鉴定,鉴定为尼泊尔德巴利酵母。目前尚无从芒果果实、叶片和芒果园土壤中分离出尼泊尔德巴利酵母和关于该菌应用于芒果采后炭疽病防治的报道。有研究已从不同来源的酵母菌中分离到挥发性产物、病程蛋白、抗菌肽等多种不同的抗菌物质,今后的研究可以集中在探索尼泊尔德巴利酵母的拮抗机理和增加拮抗效力的方法上。本研究首次证明尼泊尔德巴利酵母对芒果采后炭疽病具有生防效果,扩大了拮抗酵母菌的来源,为以后开展芒果采后炭疽病的生物防治具有重大的指导意义。
[1]刘普,方静凡,程运江,等.生防酵母菌防治果品采后病害机理的研究进展[J].华中农业大学学报,2013(2):134-140.
[2]Chrys N A.Mango anthracnose disease:present status and future research priorities[J].Plant Pathology Journal,2006,53:266-273.
[3]Kupper C,Cervantes L,Klein N,et al.Evaluation of antagonistic microorganisms Saccharomyces cerevisiae and Bacillus subtilis for control of Penicillium digitatum[J].Rev Bras Frutic,2013,35:425-436.
[4]Sugar D,Basile S R.Orchard calcium and fungicide treatments mitigate effects of delayed postharvest fungicide applications for control of postharvest decay of pear fruit[J].Postharvest Biology and Technology,2010,60(1):52-56.
[5]Lima G,Castoria R,Curtis F D,et al.Integrated control of blue mould using new fungicides and biocontrol yeasts lowers levels of fungicide residues and patulin contamination in apples[J].Postharvest Biology and Technology,2010,60(2):164-172.
[6]Zhang H Y,Yang Q Y,Lin H T,et al.Phytic acid enhances biocontrol efficacy of Rhodotorula mucilaginosa against postharvest gray mold spoilage and natural spoilage of strawberries[J].LWTFood Science and Technology,2013,53:110-115.
[7]Sun F,Zhang P Y,Guo M R,et al.Burdock fructooligosaccharide induces fungal resistance in postharvest Kyohograpesby activating the salicylic acid-dependent pathway and inhibiting browning[J].Food Chemistry,2012,138(1):539-546.
[8]许春青.芒果炭疽病菌拮抗酵母的筛选、鉴定及其保护剂的评价[D].武汉:华中农业大学,2013.
[9]何秀娟.筛选芒果采后炭疽病和蒂腐病的生防菌研究[D].武汉:华中农业大学,2006.
[10]Tu Q H,Chen J Y,Guo J H.Screening and identification of antagonistic bacteria with potential for biological control of Penicillium italicum of citrus fruits[J].Scientia Horticulturae,2013,150(4):125-129.
[11]Cristiane M,Cervantes A,Filho A B,et al.Integrated control of green mold to reduce chemical treatment in postharvest citrus fruits[J].Scientia Horticulturae,2013,165:433-438.
[12]王笑梅,范飞,李新国,等.香蕉炭疽病优势拮抗酵母菌的分离及筛选[J].热带作物学报,2013,34(2):339-343.
[13]Lima J R,Gondim D,Oliveira J,et al.Use of killer yeast in the management of postharvest papaya anthracnose[J].Postharvest Biology and Technology,2013,83:58-64.
[14]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999.
[15]Barnett J A,Penn R W,Yaro D著,胡瑞卿译.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:60-117.
Isolation and screening of antagonism yeast against mango Colletotrichum gloeosporioides
LUO Shan-shan,WANG Run-han,WAN Bin,SHAO Yuan-zhi*
(College of Food Science and Technology,Hainan University,Haikou 570228,China)
Isolation and screening of antagonism yeast against Colletotrichum gloeosporioides from peel,leaf and soil of mango fruits,and investigation of antagonistic effect of isolated yeast against C.gloeosporioides. Yeast was screened out through confront culture method and in vivo test,and identified by phenotypic and genotypic characteristics.The yeast strain T18 showed highest and most stable antagonistic effect.Results showed that inhibition zone diameter of T18 was 14.33mm at concentration of 1.0×108cfu/mL,with strong in vivo antagonistic effect of lesion diameter of 1.58mm.The strain T18 isolated from soil was identified by colony and cell morphology,biological and biochemical characteristics,and ITS sequence,and was identified as Debaryomyces nepalensis.
Colletotrichum gloeosporioides;yeast;screening;identification
TS201.3
A
1002-0306(2015)14-0216-04
10.13386/j.issn1002-0306.2015.14.036
2014-10-31
罗姗姗(1989-),女,硕士研究生,研究方向:果蔬保鲜与贮藏。
邵远志(1969-),男,本科,副教授,研究方向:果蔬保鲜与贮藏。
农业部南亚热作项目(14RZNJ-59);海南省重大科技专项(ZDZX-2013011)。
