白地霉发酵过程中菌体量检测方法的研究
2015-11-07张良雨赵强强郝灵珍刘祝兵范金石
张良雨,赵强强,郝灵珍,刘祝兵,管 斌,*,孔 青,范金石
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.青岛科技大学化工学院,山东青岛266042)
白地霉发酵过程中菌体量检测方法的研究
张良雨1,赵强强1,郝灵珍1,刘祝兵2,管斌1,*,孔青1,范金石2
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.青岛科技大学化工学院,山东青岛266042)
探讨了白地霉发酵过程中菌体量的检测方法,对白地霉的细胞组分麦角固醇和氨基葡萄糖,能否作为菌体量检测指标的可行性进行了比较分析。结果表明:氨基葡萄糖在白地霉细胞中的含量较为稳定,在不同的培养时间、培养条件和培养基中都有较好的稳定性,可以作为白地霉菌体量的检测指标;麦角固醇受培养时间和培养基成分的影响较大,含量不稳定,不太适合作为白地霉菌体量的检测指标。用氨基葡萄糖法测得的白地霉生长曲线与用干重法测得的生长曲线变化一致,能够较为准确地反映白地霉菌体量变化。将此方法应用到白地霉固态发酵中,可快速得到白地霉固态发酵过程中的菌体量变化,为以后固态发酵菌体量的测定提供了依据。
白地霉,菌体量,麦角固醇,氨基葡萄糖
白地霉(Geotrichum candidum)是一种常见真菌,形态特征介于酵母菌和霉菌之间,繁殖方式以裂殖为主,少数菌株间有芽生孢子。菌落呈绒毛状或粉状,韧或易碎,具有真菌丝,芽孢子单个或连接成链,长筒状,也有些呈椭圆形[1]。白地霉生长适应性强,生长快,在多种介质中均能生长,菌体蛋白含量丰富,可用于优质的蛋白饲料及脂肪酶的发酵生产等。
菌体量是反映微生物生长情况的一项基本参数,通过测定其菌体量可了解发酵过程中微生物的生长及发酵状况。与液态发酵相比,固态发酵具有投资少,易操作,后处理简单,污染少,生长粗放,产量高等优点,因此受到国内外人士的广泛青睐,成为发酵行业中广泛应用的工艺类型之一。但白地霉,在固态基质中生长时,菌丝会深入培养基内部,与培养基紧密缠绕在一起,不易从底物中分离出来,所以很难直接测定其菌体量。为解决这一难题,通常采用间接法来进行微生物菌体量的测定。固态发酵中测定微生物菌体量的方法大致可分为以下4大类:a.直接从固态培养基中将菌体分离出来进行测定,如:直接计数[2]等;b.检测细胞的代谢成分变化,如测定O2和CO2的代谢量[3-4]、测定胞外酶的活性[5]、测定ATP[6]、免疫活性等;c.测定营养物质的消耗,如干重损失法[7]等;d.测定细胞中的某些特殊组分,如几丁质[8]、核酸[9]和蛋白质等。
目前国内外有关白地霉液态以及固态发酵菌体量的测定方法报道较少,综合对液态和固态发酵生物量的研究结果,选用文献中较为准确且易行的几种方法:测定细胞中的特殊物质如麦角固醇[10]、氨基葡萄糖[11]等组分含量来推测微生物菌体量。麦角固醇,是存在于真菌细胞膜中的甾类化合物,是真菌中主要的固醇类物质,专一性很强。几丁质是真菌细胞壁的主要成分,是一种由N-乙酰氨基葡萄糖通过α-1,4糖苷键连接而成的直链高分子聚合物。本文通过研究白地霉菌体内麦角固醇和氨基葡萄糖含量与菌体量之间的关系,考察了培养时间、培养条件、培养基成分对其含量的影响,力求确定一种操作简便、快速准确的测定白地霉菌体量或反映白地霉生长状况的方法。
1 材料与方法
1.1材料与仪器
白地霉(编号:2.0498 Geotrichum candidum) 中国微生物菌种保藏中心;菌种保藏培养基10°Brix麦芽汁1000mL,琼脂20g,pH6.0;液态发酵培养基培养基Ⅰ:葡萄糖10g,MgSO4·7H2O 1g,KH2PO45g,酵母浸膏2g,尿素1g,加水定容至1L,pH6.0;培养基Ⅱ:10°Brix麦芽汁1000mL,pH6.0;固态发酵培养基处理秸秆∶麸皮∶豆粕=6∶3∶1,固液比1∶1.5;麦角固醇标准溶液、氨基葡萄糖标准溶液用Sigma公司提供的标准品配制;醇碱溶液50%KOH:无水乙醇(体积比2∶3);正庚烷分析纯;乙酰丙酮试剂3.5mL乙酰丙酮溶于50mL 1.2mol/L碳酸钠溶液中,现用现配;对二甲氨基苯甲醛试剂1.333g对二甲氨基苯甲醛溶于25mL无水乙醇及25mL浓盐酸的混合液中,棕色瓶保存,现用现配。
SPS202F型电子分析天平梅特勒-托利多称重设备有限公司;ZDX-35BI型高压蒸汽灭菌锅上海申安医疗器械厂;DH4000AB型电热恒温培养箱、DL-I-15型高级台式封闭电炉天津市泰斯特仪器有限公司;SHZ-C型水浴恒温振荡器上海跃进医疗器械厂;HWS-250型恒温恒湿箱、DZF-6020型真空干燥箱上海精宏实验设备有限公司;SHZ-D(Ⅲ)循环水式真空泵巩义市英峪予华仪器厂;PHS-2F型pH计、722N型可见分光光度计上海精科电子有限公司;BCM-1000型超净工作台苏净集团安泰公司;LD5-10B型低速离心机北京雷勃尔离心机有限公司;UV-2802PC型紫外分光光度计尤尼克仪器有限公司。
1.2实验方法
1.2.1菌种培养方法斜面种子培养:将保存的白地霉菌种接入斜面麦芽汁培养基上,28℃下培养至菌苔长满斜面,置冰箱中保存备用。
液态发酵培养:用生理盐水冲洗斜面,并稀释至孢子浓度为106~107cfu/mL(血球计数板计数)。在300mL三角瓶中加入100mL液体培养基Ⅰ,115℃灭菌30min后,接入白地霉孢子悬浮液5mL,30℃、180r/min恒温振荡培养48h。
固态发酵培养:在500mL三角瓶中加入固态培养基20g,灭菌后接入白地霉液体种子液2mL,30℃下恒温静置培养,每天摇动三角瓶以防止结块。
1.2.2纯菌丝体的获得培养结束后,将发酵液抽滤,并用蒸馏水充分洗涤滤纸上的滤出物,收集滤出物,然后置60℃真空干燥箱内烘干至恒重,研钵研碎,置于干燥处保存备用。
1.2.3标准曲线的绘制
1.2.3.1麦角固醇标准曲线的绘制准确配制浓度为100μg/mL的麦角固醇标准溶液,稀释成梯度溶液,用紫外分光光度计测其282nm处吸光值,绘制麦角固醇浓度与吸光值的标准曲线。
1.2.3.2氨基葡萄糖标准曲线的绘制准确配制浓度为100μg/mL的氨基葡萄糖标准溶液,稀释成梯度溶液,各取2mL样液(空白为蒸馏水),分别加入1mL乙酰丙酮试剂,沸水浴30min,冷却后加入2mL无水乙醇、1mL对二甲氨基苯甲醛试剂振荡,再加入4mL无水乙醇,60℃保温1h,用可见分光光度计测其530nm处吸光值[12],绘制氨基葡萄糖浓度与吸光值的标准曲线。
1.2.4微生物菌体量与麦角固醇以及氨基葡萄糖含量的关系
1.2.4.1菌体中麦角固醇含量与菌体量的关系准确称取在同一培养条件下培养相同时间所得到的纯菌体0.1、0.2、0.3、0.4、0.5g,提取菌体中的麦角固醇并测其吸光值,计算不同质量菌体中麦角固醇的含量。
1.2.4.2菌体中氨基葡萄糖含量与菌体量的关系准确称取在同一培养条件下培养相同时间所得到的纯菌体0.1、0.2、0.3、0.4、0.5g,提取菌体中的氨基葡萄糖并测其吸光值,计算不同质量菌体中氨基葡萄糖的含量。
1.2.5培养条件对菌体中麦角固醇和氨基葡萄糖含量的影响
1.2.5.1培养时间对菌体中麦角固醇和氨基葡萄糖含量的影响将白地霉接种于液体培养基Ⅰ中,30℃,180r/min下培养,每12h进行取样分析,测定不同菌龄下白地霉单位菌体内麦角固醇和氨基葡萄糖的含量。
1.2.5.2摇床转速对菌体中麦角固醇和氨基葡萄糖含量的影响在液体发酵中,影响微生物生长的主要因素为培养过程中的溶氧量(与摇床转速相关)[8]。为研究培养条件对菌体中麦角固醇和氨基葡萄糖含量的影响,在此选择不同的摇床转速作为改变的培养条件进行实验。在培养基Ⅰ中接种白地霉,选择摇床转速为160、180、200r/min,30℃培养48h后获得纯菌体,测定单位菌体内麦角固醇和氨基葡萄糖的含量。
1.2.5.3培养基对菌体中麦角固醇和氨基葡萄糖含量的影响分别在培养基Ⅰ、培养基Ⅱ中接种等量的白地霉,30℃,180r/min下培养48h后获得纯菌丝体,测定单位菌体内麦角固醇和氨基葡萄糖的含量。
1.2.6氨基葡萄糖含量与微生物菌体量的变化曲线
将白地霉接种于液体培养基Ⅰ中,30℃,180r/min下培养,每隔4h取样,先通过抽滤烘干测其菌体干重,再检测干燥后菌体中的氨基葡萄糖含量,根据氨基葡萄糖与菌体量的关系进而推算出白地霉的菌体干重,每组实验做三次平行,取其平均值,通过两种方法绘制生长曲线并比较两条曲线的变化情况。
1.2.7白地霉固态发酵过程中菌体量的变化按10%的接种量,将液态培养24h的白地霉种子液接入固体培养基中,30℃恒温静置培养,每天提取固体培养基中的氨基葡萄糖含量,并计算白地霉菌体量,绘制白地霉固态发酵菌体量随时间的变化曲线。
1.3测定方法
1.3.1麦角固醇的提取和测定按照张博润等[13]的方法,并作出适当修改。准确称取干菌体0.1g(空白不加)置于100mL磨口三角瓶中,加入20mL醇碱溶液,85~90℃水浴中皂化3h,室温下冷却,加入20mL正庚烷进行萃取,加瓶塞振荡30s,静置30min分层。取上清液0.5mL,加4.5mL 95%乙醇稀释10倍,用紫外分光光度计测定282nm处的吸光值。其单位干菌体细胞中麦角固醇的含量计算公式如下:

式中:c—根据样品在282nm处的吸收值,从标准曲线中获得麦角固醇的浓度(μg/mL);N—稀释倍数;V—萃取液的体积(mL);w—菌体干重(g)。
1.3.2氨基葡萄糖的提取和测定
1.3.2.1样品预处理[14]准确称取干菌体0.3g(干固态培养基0.6g),加2mL 60%H2SO4,25℃浸泡24h,稀释至1mol/L H2SO4,置于250mL三角瓶中,9.8×104Pa高压加热1h,冷却后用1mol/L NaOH中和至pH7,定容到100mL。
1.3.2.2测定方法[12]Elson-Morgan法用于测定游离的氨基糖,氨基糖在碱性条件下与乙酰丙酮缩合形成生色原——2-甲基-3-二乙酰吡咯衍生物,生色原再与对二甲氨基苯甲醛在浓盐酸乙醇溶液中生色,在530nm处有最大吸收值。取2mL样液(空白为蒸馏水),加1mL乙酰丙酮试剂,沸水浴加热30min,冷却后加入2mL无水乙醇、1mL对二甲氨基苯甲醛试剂振荡,再加入4mL无水乙醇,60℃保温1h,530nm处测定吸光值。其单位干菌体细胞中氨基葡萄糖的含量为:

式中:c—根据样品在530nm处的吸收值,从标准曲线中获得氨基葡萄糖的浓度(μg/mL);V—样液的总体积(mL);w—菌体干重(g)。
1.4数据统计分析
每组实验做三个平行,结果均以均值±标准差表示,采用SPSS软件对实验数据进行单因素方差分析(One-Way ANOVA),比较数据间的差异性是否显著,显著水平为p<0.05。
2 结果与分析
2.1麦角固醇与氨基葡萄糖的标准曲线
麦角固醇含量的标准曲线如图1所示。由此得到麦角固醇含量与光吸收值的函数关系:麦角固醇含量(μg/mL)=35.84×A282。

图1 麦角固醇标准曲线Fig.1 Standard curve of ergosterol
氨基葡萄糖含量的标准曲线如图2所示。由此得到氨基葡萄糖含量与光吸收值的函数关系:氨基葡萄糖含量(μg/mL)=113.64×A530。
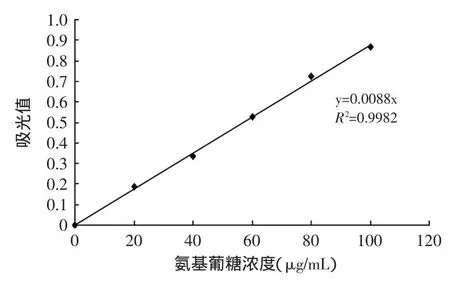
图2 氨基葡萄糖标准曲线Fig.2 Standard curve of glucosamine
2.2微生物菌体量与麦角固醇以及氨基葡萄糖含量的关系
一种细胞组分能否作为微生物菌体量的检测指标,首要的条件就是其在细胞中的含量应与菌体量具有良好的线性关系。因此,首先对细胞中麦角固醇、氨基葡萄糖含量与菌体量的关系进行考察。
2.2.1菌体中麦角固醇含量与菌体量的关系由图3可知,在同一培养条件下培养相同时间所得到的不同质量的白地霉菌体中,麦角固醇含量与菌体量之间呈现良好的线性关系,所得线性回归方程为y= 3.106x-0.0314,相关系数R2=0.9962。

表1 培养时间对菌体中麦角固醇和氨基葡萄糖含量的影响Table 1 Effect of culture time on content of ergosterol and glucosamine
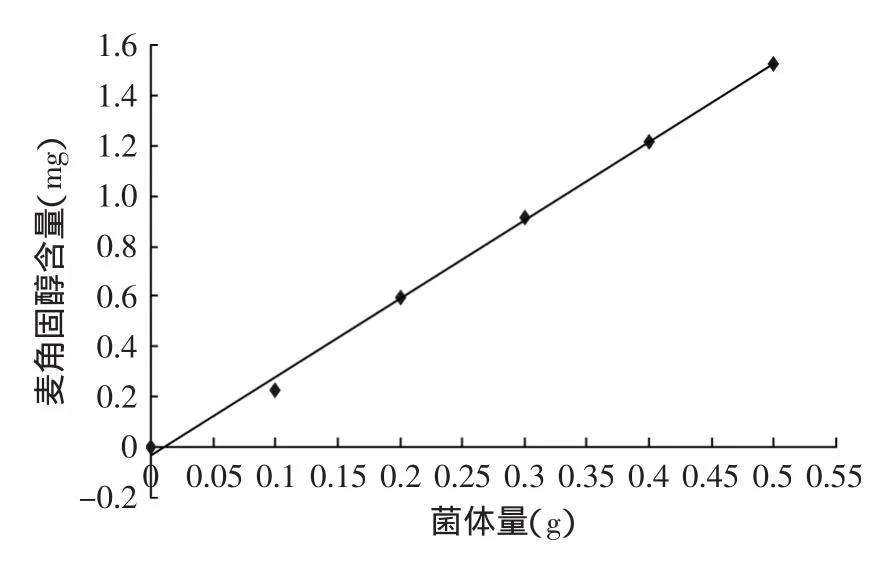
图3 菌体生物量与麦角固醇含量的关系Fig.3 Correlation between mycelia biomass and ergosterol content
2.2.2菌体中氨基葡萄糖含量与菌体量的关系由图4可知,在同一培养条件下培养相同时间所得到的不同质量的白地霉菌体中,氨基葡萄糖含量与菌体量之间呈现良好的线性关系,所得线性回归方程为y=37.834x+0.0716,相关系数R2=0.9945。

图4 菌体生物量与氨基葡萄糖含量的关系Fig.4 Correlation between mycelia biomass and glucosamine content
2.3培养条件对菌体中麦角固醇和氨基葡萄糖含量的影响
一种细胞组分能否作为微生物菌体量的检测指标,其在细胞中的含量与微生物菌体量仅有良好的线性关系还不够,此组分在细胞中的含量还必须在微生物的整个生长周期内基本维持恒定,即与培养时间无关;而且在不同的培养条件下基本保持相同[15]。因此,接下来从培养时间、培养条件、培养基成分三方面对菌体中麦角固醇和氨基葡萄糖含量的稳定性进行了验证。
2.3.1培养时间对菌体中麦角固醇和氨基葡萄糖含量的影响由表1可以看出,培养12h的菌体中麦角固醇和氨基葡萄糖含量与其他数据相差较大,这可能是因为培养12h时白地霉菌丝体的量很少,通过过滤法收集菌体后烘干称重所产生的相对误差较大,故可以将此组数据舍去。将其余数据进行单因素方差分析,结果表明在检验水平α=0.05时,不同菌龄的白地霉单位菌体内麦角固醇含量差异显著(p<0.05),而单位菌体内氨基葡萄糖含量无显著差异(p>0.05),故可认为菌龄对白地霉单位菌体内麦角固醇含量有较大影响,而对单位菌体内氨基葡萄糖含量影响不大。
2.3.2摇床转速对菌体中麦角固醇和氨基葡萄糖含量的影响溶氧量是影响微生物生长的主要因素,通过改变摇床转速来改变溶氧量,探究不同培养条件下单位菌体内麦角固醇和氨基葡萄糖含量的变化。将表2数据进行单因素方差分析,结果表明在检验水平α=0.05时,不同摇床转速下,白地霉单位菌体内麦角固醇和氨基葡萄糖的含量均无显著差异(p>0.05),故可视作单位菌体内麦角固醇和氨基葡萄糖含量在不同的摇床转速下基本保持相同。

表2 摇床转速对菌体中麦角固醇和氨基葡萄糖含量的影响Table 2 Effect of shaking speed on content of ergosterol and glucosamine
2.3.3培养基对菌体中麦角固醇和氨基葡萄糖含量的影响培养基Ⅰ是以葡萄糖为碳源,尿素为氮源,添加营养盐的合成培养基;培养基Ⅱ所采用的麦芽汁培养基为天然培养基,其主要成分来源于麦芽,两种培养基的组成显然不同。将表3数据进行单因素方差分析,结果表明在检验水平α=0.05时,对于不同的培养基组成,白地霉单位菌体内麦角固醇含量差异较为显著(p<0.05),而单位菌体内氨基葡萄糖含量无显著差异(p>0.05),因此可认为培养基成分的不同对单位菌体内氨基葡萄糖的含量几乎没有影响,而对单位菌体内麦角固醇含量的影响则相对要大。
综合以上三个实验的结果得出:氨基葡萄糖在白地霉菌体中的含量相对稳定,与菌龄、摇床转速和培养基组成无关,可以作为衡量白地霉菌体量的检测指标;而麦角固醇虽不受摇床转速的影响,但受菌龄和培养基成分的影响较大,不适合作为白地霉菌体量测定的指标。
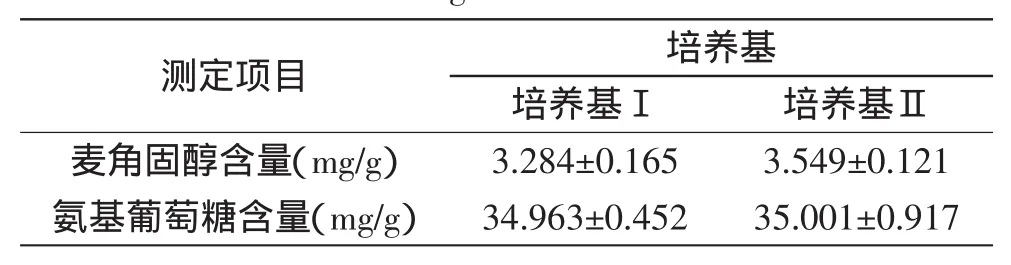
表3 培养基成分对菌体中麦角固醇和氨基葡萄糖含量的影响Table 3 Effect of different mediums on content of ergosterol and glucosamine
2.4氨基葡萄糖含量与微生物菌体量的变化曲线
由图5可以看出,液体发酵后得到的白地霉纯菌体,通过称量不同培养时间的菌体干重绘制出来的生长曲线,与通过检测培养不同时间菌体内氨基葡萄糖含量进而推算出的菌体干重变化趋势一致,最大偏差为0.271g,可以认为,菌体中氨基葡萄糖的含量能够较为准确地反映白地霉菌体量的变化。
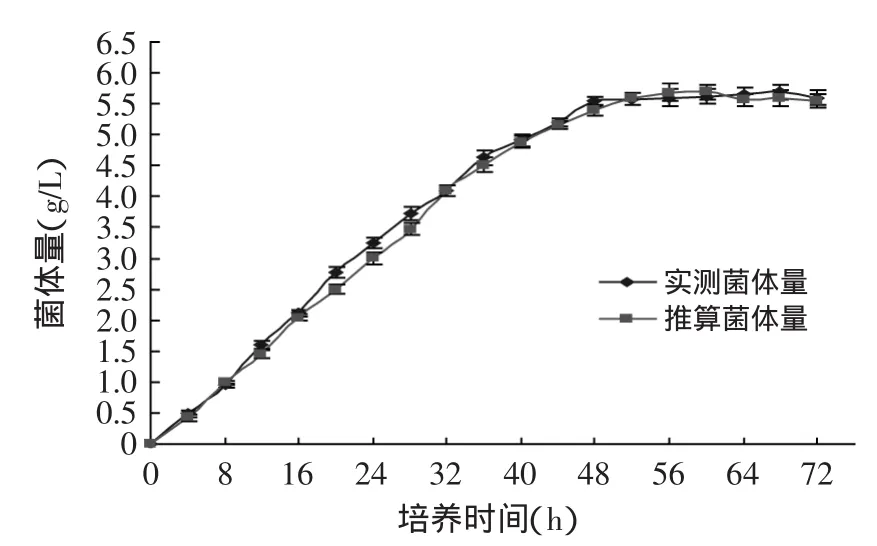
图5 白地霉实测菌体量和推算菌体量的变化曲线Fig.5 The changed curve of Geotrichum candidum actual biomass and calculated biomass
2.5白地霉固态发酵过程中菌体量的变化
白地霉在固态发酵过程中由于菌丝体与培养基缠绕在一起不容易直接测定,故在确定了其菌体量检测方法之后,进行固态发酵时,便可利用氨基葡萄糖法测定其菌体量的变化情况,结果如图6所示。
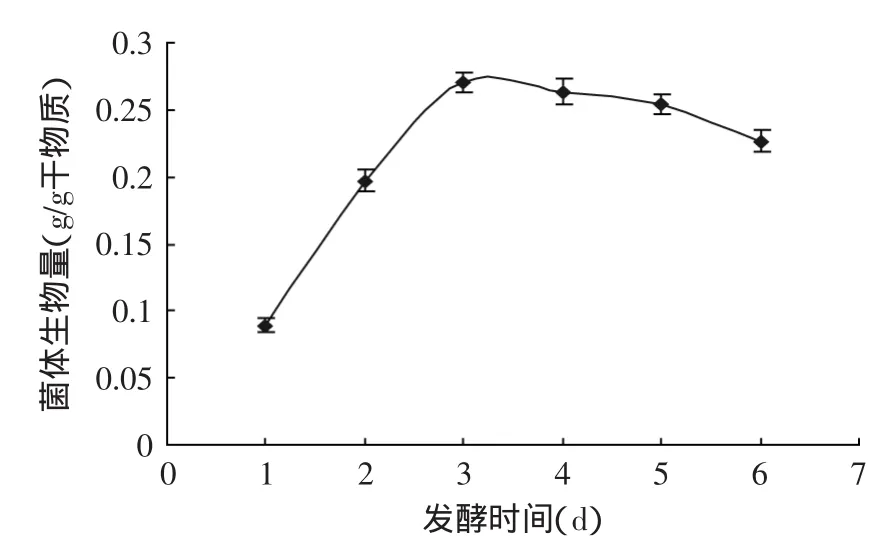
图6 白地霉固态发酵过程中菌体量的变化Fig.6 Mycelia development of Geotrichum candidum during solid state fermentation process
由于氨基葡萄糖是真菌细胞壁的主要成分,固态基质中并不存在氨基葡萄糖,因此通过检测培养基中的氨基葡萄糖含量,并根据公式来计算菌体量的方法是可行的。由图6可以看出,在白地霉固态发酵过程中,前3d菌体生物量显著增加,第3d菌体量达到最大,为0.2702g/g干物质,稍后基本保持恒定变化较小,第6d开始下降,这可能是由于营养物质被大量消耗,营养不足,导致菌体大量死亡,此种方法较好地反映了白地霉固态发酵过程中菌体量的变化,为解决固态发酵菌体量检测困难的问题提供了依据。
3 结论
本文对白地霉细胞组分中的特殊物质——麦角固醇和氨基葡萄糖含量是否适合作为白地霉菌体量的检测指标进行了一系列研究,最终得出了较为准确的白地霉菌体量检测方法。
3.1不同质量的白地霉菌体中,麦角固醇和氨基葡萄糖含量与菌体量呈现良好的线性关系,相关系数均达到0.99以上。
3.2通过检验白地霉单位菌体内麦角固醇和氨基葡萄糖含量的稳定性,得到白地霉菌体量的检测指标。单位菌体内氨基葡萄糖在白地霉生长过程中较为稳定,不受培养时间、培养基成分、摇床转速的影响,适合作为白地霉菌体量的检测指标;而单位菌体内麦角固醇受培养时间和培养基成分的影响较大,即不同菌龄和在不同培养基中生长的白地霉,其单位菌体内麦角固醇含量波动较大,不适宜作为白地霉菌体量的检测指标。
3.3利用氨基葡萄糖法测得的白地霉菌体量与干重法测得的菌体量变化趋势相同,两种方法较为一致地显示了白地霉在生长过程中菌体量的变化情况,因此菌体中氨基葡萄糖含量能够较好地反映白地霉的生长状况。
3.4将此方法应用到白地霉固态发酵过程中,通过检测固体培养基中的氨基葡萄糖含量间接得到微生物菌体量,实验结果显示,在第3d菌体量达到最大,
为0.2702g/g干物质,说明氨基葡萄糖法检测白地霉固态发酵菌体量是可行的。
[1]孙丙升.产香白地霉发酵无醇类啤饮料的研究[D].济南:山东轻工业学院,2009.
[2]范广璞.白酒中生香酵母的筛选及培养条件的研究[J].中国酿造,2008,14:44-47.
[3]Sugama S,Okazaki N.Growth estimation of Aspergillus oryzae cultured on solid meida[J].J Ferment Technol,1979,57:408-412.
[4]Narahaaara H,Kyoama Y.Growth and enzyme production in a solid-state culture of Aspergillus oryzae[J].J Ferment Technol,1982,60:311-319.
[5]Carrizalez V,Rodriguez H,Sarrdina I.Determination of specific growth of molds on semi-solid cultures[J].Biotechnol Bioeng,1981,23:321-333.
[6]Matcham S E,Jordan B R,Wood D A.Methods for assessmentof fungal growth on solid substrates[J].Soc Appl Bacterioc Tech Ser,1984,19:6-18.
[7]苏东海,石坚,刘萍,等.秸秆固态发酵酒精过程中参数的测定[J].食品与发酵工业,2005,31(6):1-5.
[8]高修功,章克昌.纤维素酶固态发酵过程中菌体生长量的测定[J].工业微生物,1994,24(3):26-30,34.
[9]Koliander B,Hampel W,Roehr M.Indirect estimation of biomass by rapid ribonucleic acid determination[J].Appl Microbiol Biotechnol,1984,19:272-276.
[10]Pant D,Adholeya A.Enhanced production of ligninolytic enzymes and decolorization of molasses distillery wastewater by fungi under solid state fermentation[J].Biodegradation,2007,18(5):647-659.
[11]Palanivel Velmurugan,Hyun Hur,Vellingiri Balachandar,et al.Monascus pigment production by solid-state fermentation with corn cob substrate[J].Journal of Bioscience and Bioengineering,2011,112:590-594.
[12]苏畅,夏文水,姚惠源.氨基葡萄糖和乙酰氨基葡萄糖的测定方法[J].食品工业科技,2003,24(6):74-75.
[13]张博润,何秀萍,铁翠娟,等.麦角固醇高产菌株的构建及其培养优化条件的研究[J].生物工程学报,1999,15(1):46-51.
[14]路秀玲,赵树欣,刘忠华.红曲霉固态发酵中生物量的测定方法[J].食品与发酵工业,2000,27(6):45-49.
[15]魏培莲,岑沛霖,盛春琦.3种固态发酵生物量测定方法的比较[J].食品与生物技术学报,2006,25(1):60-64,69.
Study on Geotrichum candidum biomass detection methods in fermentation process
ZHANG Liang-yu1,ZHAO Qiang-qiang1,HAO Ling-zhen1,LIU Zhu-bing2,GUAN Bin1,*,KONG Qing1,FAN Jin-shi2
(1.College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China;2.College of Chemical Engineering,Qingdao University of Science&Technology,Qingdao 266042,China)
The detection methods of Geotrichum candidum biomass in its fermentation process were discussed in this study.The feasibility of whether the cell components in Geotrichum candidum-ergosterol and glucosamine could be used as indicators for biomass estimation in fermentation was examined and analyzed.The experimental results showed that glucosamine could be a good biomass indicator as it remained constant in cells with the changes of culture time,culture condition and medium.Ergosterol amount changed with the different culture time and medium type;therefore,it could not accurately represent the changes of biomass.The growth curve of Geotrichum candidum measured by glucosamine method was in accordance with the growth curve by dry weight,so it could be able to reflect the changes of Geotrichum candidum biomass accurately.This method was also applied to the process of solid-state fermentation,getting the variation of Geotrichum candidum biomass in its process of solid-state fermentation quickly.So in solid-state fermentation,glucosamine could be used as the indicator to calculate Geotrichum candidum biomass indirectly,which provided the basis for biomass detection in solid-state fermentation.
Geotrichum candidum;biomass;ergosterol;glucosamine
TS201.3
A
1002-0306(2015)14-0184-06
10.13386/j.issn1002-0306.2015.14.030
2014-10-13
张良雨(1990-),女,硕士研究生,主要从事发酵工程方面的研究。
管斌(1957-),男,博士,教授,主要从事发酵工程方面的研究。
“十二五”农村领域国家科技计划(2013BAD10B02-06);青岛市公共领域科技支撑计划项目(11-2-3-63-nsh);啤酒生物发酵工程国家重点实验室开放课题(K2012002)。
