不同生育期紫苏叶中β-胡萝卜素和总黄酮的动态积累
2015-11-07江安娜方元平付建强王书珍
向 福,江安娜,项 俊,*,方元平,付建强,王书珍
(1.经济林木种质改良与资源综合利用湖北省重点实验室,黄冈师范学院,湖北黄州438000;2.大别山特色资源开发湖北省协同创新中心,湖北黄州438000)
不同生育期紫苏叶中β-胡萝卜素和总黄酮的动态积累
向福1,2,江安娜1,项俊1,2,*,方元平1,2,付建强1,王书珍1,2
(1.经济林木种质改良与资源综合利用湖北省重点实验室,黄冈师范学院,湖北黄州438000;2.大别山特色资源开发湖北省协同创新中心,湖北黄州438000)
为了探讨紫苏品种和生育期对紫苏叶中β-胡萝卜素和总黄酮含量的影响,指导紫苏的合理采收和资源化利用,采用高效液相和紫外分光光度法分别测定四种紫苏叶在营养生长期、开花期和落叶期的β-胡萝卜素和总黄酮含量。结果表明:四种紫苏叶中β-胡萝卜素均在开花期达到最大含量,以河北保定栽培种P11-3紫苏叶中β-胡萝卜素含量最高,为4.32mg/g;不同紫苏叶中总黄酮分别在开花期和落叶期有最大含量,以湖北英山野生种P11-7开花期紫苏叶中总黄酮含量最高,达83.9mg/g。因此,开花期是利用湖北英山野生紫苏叶中β-胡萝卜素和总黄酮的最佳采收期,从而为大别山紫苏的合理采收和资源化利用提供了理论依据。
紫苏叶,β-胡萝卜素,总黄酮,动态积累,开花期
紫苏(Perilla frutescens L.Britt)为一年生草本植物,具有特异芳香味,栽培历史悠久,既是我国传统的油料作物,也是卫生部首批颁布的药食兼用植物品种。紫苏叶富含β-胡萝卜素、黄酮等多种生物活性物质[1-2],具有抗肿瘤、抗氧化、抗菌、抗病毒、降血脂、止血镇痛等功效[2-3],可用于开发改善免疫功能、延缓衰老、抗癌、抗过敏以及心血管疾病相关药物和功能产品[4],应用前景广阔。
近年来,人们探讨植物中总黄酮含量的动态变化的研究较多。研究发现,不同居群不同部位紫苏总黄酮含量存在明显差异[5],不同品种桑叶中黄酮含量差异较大[6],不同属间和品种间豆科牧草总黄酮的动态变化和不同组织中的分布存在明显差异[7]。通过黄酮含量的积累变化研究,确定了银杏叶、射干、荷叶等资源利用的最佳采收期[8-10]。就紫苏而言,相关研究目前主要集中在化学成分分析、提取工艺优化以及药理作用方面[3-4],通过探讨紫苏主要活性成分的积累与转化规律,进而为紫苏资源的科学利用和合理采收提供依据的研究较少。大别山地区紫苏资源丰富,区域紫苏产业正在形成。本文拟通过研究四种不同紫苏叶中β-胡萝卜素和总黄酮在植株营养生长期、开花期和落叶期的含量变化,探讨紫苏品种和采收期对紫苏叶资源利用的影响,从而为紫苏的合理采收和资源化利用提供理论依据,促进大别山地区紫苏产业的科学发展。
1 材料与方法
1.1材料与仪器
重庆丰都紫苏栽培种P11-1、甘肃庆阳紫苏栽培种P11-2、河北保定紫苏栽培种P11-3重庆阿尔康生物工程有限公司;湖北英山紫苏野生种P11-7湖北李时珍生物科技有限公司;石油醚(30~60℃沸程)、无水乙醇、三氯甲烷、丙酮、二氯甲烷、无水硫酸钠、亚硝酸钠、硝酸铝、氢氧化钠天津市凯通化学试剂有限公司,分析纯;甲醇天津市凯通化学试剂有限公司,色谱纯;芦丁上海阿拉丁试剂公司,标准品;β-胡萝卜素中国药品生物制品检定所,标准品。
TD5自动平衡离心机长沙平凡仪器仪表有限公司;Waters2695高效液相色谱仪美国Waters公司;Cary-100紫外可见分光光度计美国Varian公司;FA2014电子天平上海精细天平有限公司;SZF-06脂肪测定仪上海精隆科学仪器有限公司;HH-6型数显恒温水浴锅国华电器有限公司;KQ-250DB型数控超声波清洗器昆山市超声仪器有限公司;RE-S2AA旋转蒸发仪上海亚荣生化仪器厂。
1.2实验方法
播种长至有2对叶片的幼苗时进行移栽,采用完全随机区组设计,每小区面积大约23m2,行间距60cm×45cm。移栽实验田20d后,开始每隔20d采摘一次叶片,每次按离实验区边界相同距离随机选择5个点取样,采摘方法为全株采摘。根据紫苏生长情况,叶片采摘分为营养生长期、开花期和落叶期。将新鲜叶片用清水漂洗除去泥砂后拭干表面水分,自然阴干,粉碎过40目,得紫苏叶粉,备用。
1.2.1β-胡萝卜素含量的测定
1.2.1.1色谱条件β-胡萝卜素标准品样液扫描,在455nm和481nm处有两个吸收峰,由于455nm处吸收强度最大,故将其作为检测波长。色谱条件为:色谱柱Symmetry C18,流动相乙腈-二氯甲烷(体积比80∶20),检测波长455nm,柱温30℃,流速1.0mL/min;进样体积20μL。
1.2.1.2β-胡萝卜素标准曲线的制作精确配制浓度为500μg/mL的标品母液,分别稀释成高、低两种不同浓度范围的系列标准溶液:10、20、30、40和50μg/mL及1.0、2.5、5.0、7.5和10μg/mL。取各浓度标准溶液,进样量20μL,平行进样三次,测得其峰面积值。
1.2.1.3样品制备及含量测定精确称取四种紫苏粉1.25g于离心管中,并加0.1g VC,分次加入石油醚-丙酮(体积比8∶2)混合液24mL,在振荡器上避光振摇提取15min,无水硫酸钠脱水,离心后吸取上清液,合并提取液,定容于25mL棕色容量瓶。取该提取液10mL在45℃旋蒸至干得样品,用10mL甲醇溶解,稀释100倍后,经0.45μm的微孔滤膜过滤,按色谱条件在455nm波长处测定峰面积。
β-胡萝卜素标液保留时间为10.975min,样品保留时间为10.934min,出峰较一致。将样品色谱图中相应的色谱峰面积代入回归方程,利用式(1)计算β-胡萝卜素含量:

式(1)中,C为样品中β-胡萝卜素含量,mg/g;X为进样液中β-胡萝卜素浓度,μg/mL;V为定容体积,mL;100为样品稀释倍数;M为样品质量,g。
1.2.1.4精密度实验将四种开花期紫苏粉按上述方法重复提取5份,以相同方法测定β-胡萝卜素。
1.2.1.5回收率实验取已测定β-胡萝卜素含量的P11-3紫苏粉5份,每份1.25g,分别加入一定量的β-胡萝卜素标液,按上述方法提取定容,测β-胡萝卜素回收率。
1.2.2总黄酮含量的测定
1.2.2.1标品液和样品液制备精确称取在120℃烘至恒重的芦丁标准品11.5mg,用50%的乙醇溶液定容至25mL,摇匀,即得浓度为0.46mg/mL的标品液。
根据文献方法[11],分别精确称取四种紫苏粉2.5g,先用石油醚脱脂6h,石油醚挥发干净后,加入60%乙醇溶液40mL,60℃超声30min(100W),再恒温提取1.5h,渣重提一次,合并提取液,旋蒸至干,用50%乙醇溶液溶解过滤后,定容到50mL,摇匀,即得样品液。
1.2.2.2波长扫描精密量取芦丁标品液和四种样品液各0.5mL,置25mL容量瓶中,加50%乙醇溶液5.5mL,加5%NaNO2试液1.0mL,摇匀,放置6min,加10%Al(NO3)3试液1.0mL,摇匀,放置6min,加4% NaOH试液10mL,加50%乙醇溶液至刻度,摇匀,放置15min,以相应试剂作空白,于紫外可见分光光度计上,在波长400~700nm进行波长扫描。
1.2.2.3芦丁标准曲线的制作精确吸取0.0、0.5、1.0、2.0、3.0、4.0、5.0mL标品液分别置于25mL容量瓶中,加50%乙醇溶液5.5mL,其余操作同上。
1.2.2.4总黄酮含量的测定取样品液0.5mL,置25mL容量瓶中,加50%乙醇溶液5.5mL,其余操作同上。在506nm处测定吸光值,由回归方程计算得样品液总黄酮浓度,由式(2)计算得样品中总黄酮含量:

式(2)中,D为样品中总黄酮含量,mg/g;B为样品液中总黄酮浓度,mg/mL;V为定容的体积,mL;50为样品稀释倍数;M为样品质量,g。
1.2.2.5精密度实验将四种开花期紫苏粉按上述方法重复提取5份,以相同方法测定总黄酮。
1.2.2.6重现性实验取开花期河北保定的栽培种P11-3紫苏粉按上述方法重复提取5份,以相同方法平行测定总黄酮含量。
1.2.2.7回收率实验取开花期河北保定的栽培种P11-3紫苏粉5份,各加入芦丁对照品适量按上述方法制备5份样品液,每份吸取0.5mL,置于25mL容量瓶中,按上述方法分别测定总黄酮含量。
2 结果与讨论
2.1β-胡萝卜素的含量变化
2.1.1β-胡萝卜素含量测定β-胡萝卜素在1.0~10μg/mL范围内线性关系良好,回归方程为:Y= 9678.1X-5936.9,R2=0.9988。其中,Y为色谱峰面积,X为进样液中β-胡萝卜素浓度(μg/mL)。根据式(1)计算四种紫苏在不同生育期其叶中β-胡萝卜素的含量,结果如表1所示。方差分析表明,在不同生育期各品种紫苏叶中β-胡萝卜素含量差异极显著(p<0.01)。表1中精密度实验RSD在1.81%~5.87%,表明测定方法精密度较高。回收率实验所得β-胡萝卜素平均回收率为93.66%,RSD为6.48%。
2.1.2β-胡萝卜素含量变化规律从表1可知,除重庆丰都的栽培种P11-1外,P11-2、P11-3、P11-7三种紫苏叶中β-胡萝卜素含量从营养生长期到开花期均有所增加,特别是河北保定的栽培种P11-3,其叶中β-胡萝卜素积累效应最为显著,从营养生长期到开花期增加了35%,β-胡萝卜素含量高达4.32mg/g,含量和增量均远高于其他品种。到了落叶期,除湖北英山的野生种P11-7紫苏叶中β-胡萝卜素含量由3.18mg/g降为2.9mg/g外,P11-1、P11-2、P11-3三种紫苏叶中均检测不到β-胡萝卜素。
光合作用是植物生理代谢的基础,为植物的生长发育提供物质能量。β-胡萝卜素作为光合作用过程中的光保护色素和天线色素,在保护光和器官、防止光氧化损伤等方面具有重要作用[12-13]。表1中结果表明,紫苏叶中含有丰富的β-胡萝卜素(四种紫苏叶中最低也达到2.44mg/g),其主要营养生长期和开花期大量积累和转化,在落叶期β-胡萝卜素则迅速减少。这可能是由于紫苏在营养生长期处于不断生长新叶阶段,紫苏叶不断发育,β-胡萝卜素的含量逐渐增加,为光合作用提供支持,到开花期紫苏叶完全发育,β-胡萝卜素含量达到最大;落叶期时,由于叶片衰老、纤维化以及营养物质转移等原因[14],紫苏叶片生理活动减弱、β-胡萝卜素合成能力降低,含量急剧下降。食叶红紫苏叶中β-胡萝卜素含量在不同生育期也有相同的变化规律[15]。
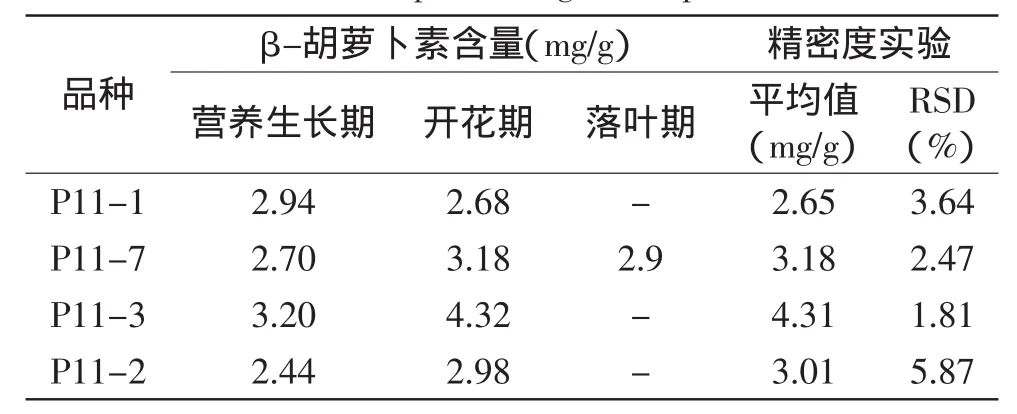
表1 不同生育期不同品种紫苏叶中β-胡萝卜素含量及精密度实验分析Table 1 The β-carotene contents in leaves of Perilla frutescens at different development stages and precision test
另外,不同品种紫苏叶中β-胡萝卜素含量变化较大。在相同种植背景下,河北保定的栽培种P11-3紫苏叶中β-胡萝卜素含量最高,分别是重庆丰都栽培种P11-1的1.6倍,甘肃庆阳栽培种P11-2的1.5倍和湖北英山野生种P11-7的1.4倍。在四种紫苏中,又以湖北英山野生种P11-7较为独特,紫苏叶在落叶期仍有高达2.9mg/g的β-胡萝卜素含量。
尽管不同采收期、不同品种紫苏叶中β-胡萝卜素含量存在较大差异,但都在开花期接近最大值,以河北保定栽培种P11-3紫苏叶中β-胡萝卜素含量最高,其次为湖北英山野生种P11-7。
2.2总黄酮的含量变化
2.2.1总黄酮含量测定芦丁标品液和各样品溶液均在506nm处有最大吸收,故选506nm为测定波长。同时,在显色反应结束10min后,取同一样品在506nm波长进行稳定性考察发现,在30min内吸光度稳定。本实验选择在加NaOH后20min测吸光度,得吸光值(A)与芦丁浓度(B)的回归方程为:A=10.084B-0.0003,R2=0.9998,线性关系良好。
根据式(2)计算不同生育期四种紫苏叶中总黄酮含量,结果如表2所示。方差分析表明,在不同生育期各品种紫苏叶中总黄酮含量均差异显著(p<0.1)。表2中精密度实验RSD在1.11%~3.40%范围,表明测定方法精密度较高。
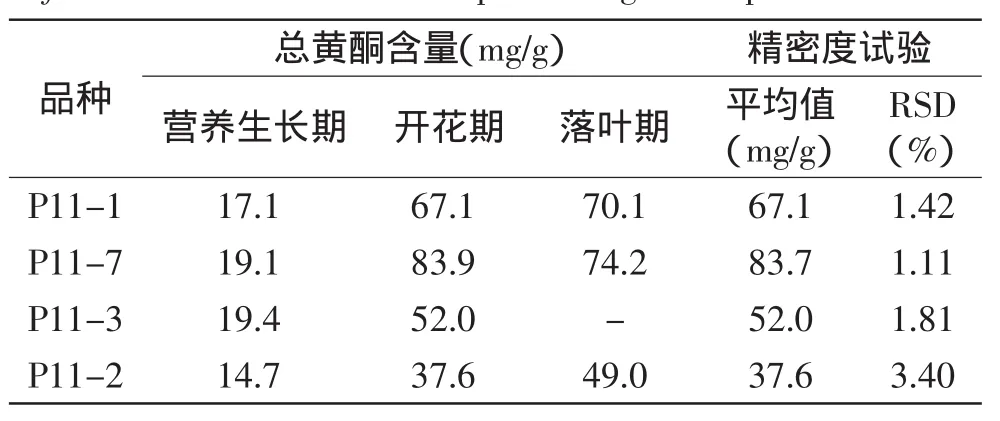
表2 不同生育期不同品种紫苏叶中总黄酮含量及精密度实验分析Table 2 The total flavonoids contents in leaves of Perilla frutescens at different development stages and precision test
回收率实验所得总黄酮平均回收率为97.87%,RSD为0.70%,说明测定方法准确可靠。重现性实验测定总黄酮平均含量为52mg/g,RSD为1.81%,表明重现性良好。
2.2.2总黄酮含量变化规律从表2可知,四种紫苏叶中总黄酮含量在营养生长期均较低,其中以甘肃庆阳的栽培种P11-2最低,总黄酮含量14.7mg/g;含量较高的为河北保定的栽培种P11-3和湖北英山野生种P11-7,其叶中总黄酮含量分别有19.4mg/g和19.1mg/g。
植株生长到开花期,四种紫苏叶中总黄酮含量急剧增加,其中湖北英山野生种P11-7增量最大,由生长期的19.1mg/g剧增到开花期的83.9mg/g,总黄酮含量增加了3.4倍;重庆丰都的栽培种P11-1也由17.1mg/g剧增到67.1mg/g,开花期总黄酮含量是生长期的3.9倍;河北保定的栽培种P11-3次之,开花期总黄酮含量52.0mg/g,是生长期的2.7倍;总黄酮含量增长最低的是甘肃庆阳的栽培种P11-2,开花期总黄酮含量是生长期的2.6倍。
落叶期时,各品种紫苏叶中总黄酮含量无明显的整体变化趋势。如表2所示,河北保定栽培种P11-3和湖北英山野生种P11-7紫苏叶总黄酮含量呈下降趋势,从开花期到落叶期P11-3紫苏叶则在落叶期未检测出黄酮,P11-7紫苏叶总黄酮含量降低了11.6%;相反,重庆丰都栽培种P11-1和甘肃庆阳栽培种P11-2紫苏叶总黄酮则在落叶期继续合成积累,含量分别增加了4.5%和30.3%。上述结果表明,紫苏叶中含有丰富的黄酮类化合物,且在开花期大量合成和积累。
作为次生代谢产物,总黄酮的合成积累是以叶片成熟为前提,以光合产物为基础[16]。随着植物从幼苗生长到开花期,紫苏叶片渐为成熟,光合作用能力增强,初生和次生代谢活动旺盛,从而在开花期形成黄酮合成高峰,积累了较多的黄酮类物质成分,总黄酮含量急剧增加。在落叶期,由于紫苏籽的充分生长和成熟,需要紫苏叶提供大量营养物质,使得紫苏叶中的黄酮类物质大量转移至紫苏籽中,同时由于代谢机能变缓,紫苏叶的次生代谢逐渐降低,而紫苏叶中原有黄酮类物质也因持续参与代谢而消耗,导致P11-7紫苏叶在落叶期的总黄酮含量呈下降趋势,甚至在落叶期的P11-3紫苏叶中未检测到总黄酮。
早期人们研究桂叶岩蔷薇叶中黄酮的积累规律发现,叶片活跃生长时,叶中黄酮类物质合成较快,会产生一个黄酮合成高峰,在植物叶片停止生长而接近衰老时又会出现一个黄酮合成高峰[17]。P11-1和P11-2紫苏在落叶期紫苏籽已趋于成熟,对总黄酮需求量减少,且可能再次出现黄酮合成高峰,从而导致P11-1和P11-2紫苏叶总黄酮含量在落叶期反常增加。
紫苏叶总黄酮含量的变化还与品种种质不同有关。在营养生长期,不同品种紫苏叶中总黄酮含量较为一致,差别较小。在开花期和落叶期,紫苏品种对叶中总黄酮含量的影响特别显著。开花期时,湖北英山野生种P11-7紫苏叶中总黄酮含量高达83.9mg/g,甘肃庆阳栽培种P11-2紫苏叶中总黄酮含量只有37.6mg/g,前者是后者的2.2倍。落叶期时,P11-1和P11-7紫苏叶中总黄酮含量均超过70mg/g,在四种紫苏中含量最高,而河北保定栽培种P11-3紫苏叶中甚至检测不到总黄酮。表2结果说明,不同紫苏品种间紫苏叶黄酮含量存在巨大差异,而部分品种间紫苏叶总黄酮含量又趋一致。紫苏叶总黄酮含量在不同品种间变化的这种二重性与人们报道的银杏叶黄酮含量变化的二重性一致[16,18]。
因此,不同采收期、不同品种紫苏叶中黄酮含量存在较大差别,P11-3和P11-7紫苏叶在开花期采收总黄酮含量较高,P11-1和P11-2在落叶期采收总黄酮含量较高;就品种而言,以湖北英山野生种P11-7紫苏叶中总黄酮含量最高。在开发利用紫苏叶中黄酮时,应注意不同品种和不同采收期的影响。
3 结论
为科学利用紫苏叶中总黄酮和β-胡萝卜素等活性成分,应注意不同紫苏品种和不同采收期对其含量变化的影响。开花期是利用紫苏叶β-胡萝卜素的最佳采收期,而利用紫苏叶总黄酮的最佳采收期则应视具体品种而确定为开花期或落叶期。就大别山紫苏资源利用而言,开花期则是利用湖北英山野生紫苏叶中总黄酮和β-胡萝卜素的最佳采收期。不同生育期紫苏叶中β-胡萝卜素和总黄酮的积累变化研究为紫苏资源的合理采收和资源化利用提供了理论依据,有利于促进大别山地区紫苏产业的科学发展。
[1]张洪,黄建韶,赵东海.紫苏营养成分的研究[J].食品与机械,2006,22(3):41-43.
[2]郭晓青,陈晓靓,杨春梅,等.紫苏叶活性成分及抗氧化性研究[J].食品与机械,2014,30(4):179-181,185.
[3]刘浏.紫苏叶的研究进展[J].中国医学创新,2012,9(6):162-163.
[4]谭关莲,严明芳,汪磊,等.国内外紫苏研究进展概述[J].中国油料作物学报,2012,34(2):225-231.
[5]邹茜.浅谈紫苏不同居群不同部位总黄酮含量的差异[J].当代医药论丛,2014,12(9):32-34.
[6]张亮亮,汪咏梅,徐曼,等.不同品种桑叶多酚和黄酮含量变化规律研究[J].时珍国医国药,2013,24(5):1064-1066.
[7]魏伯平,张咏梅,曹致中.9种豆科牧草总黄酮和总皂苷积累规律的研究[J].草地学报,2012,20(1):88-95.
[8]赵昕岚,邓放明.荷叶中总黄酮和荷叶碱含量变化规律[J].食品与机械,2013,29(2):37-40.
[9]普冰清,朱艳,许方云,等.射干不同采收期黄酮类成分的动态变化规律[J].药学与临床研究,2014,22(3):212-215.
[10]胡燕梅,罗凯,张腾飞.银杏叶黄酮含量积累规律与最佳采收期研究[J].武汉生物工程学院学报,2012,8(3):177-179.
[11]上官海燕,吴巧凤.紫苏叶与白苏叶的总黄酮和微量元素的比较分析[J].广东微量元素科学,2008,15(4):29-32.
[12]张芬,张波,田丽萍,等.盐胁迫对番茄幼苗叶片光合特性及叶绿素和β-胡萝卜素含量的影响[J].北方园艺,2014(11):15-20.
[13]Isaacson T,Ronen G,Zamir D,et al.Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of β-carotene and xanthophylls in plants[J].The Plant Cell,2002,14(2):333-342.
[14]唐延林,黄敬峰,王人潮.水稻不同发育时期高光谱与叶绿素和类胡萝卜素的变化规律[J].中国水稻科学,2004,18(1):59-66.
[15]张占军.食叶红紫苏不同生育期主要营养成分分析研究[J].中国食物与营养,2014,20(4):69-72.
[16]程水源,顾曼如,束怀瑞.银杏叶黄酮研究进展[J].林业科学,2000,36(6):110-115.
[17]Vogt T,Gerhard Gul P.Accumulation of flavonoids during leaf development in Cistus laurifolius[J].Phytochemistry,1994, 36(3):591-597.
[18]程水源,顾曼如,束怀瑞.银杏叶黄酮种类、含量变化及形成规律与调控[J].资源科学,2000,22(5):46-48.
Dynamic accumulation of flavonoids and β-carotene in leaves of Perilla frutescens at different stages of development
XIANG Fu1,2,JIANG An-na1,XIANG Jun1,2,*,FANG Yuan-ping1,2,FU Jian-qiang1,WANG Shu-zhen1,2
(1.Hubei Key Laboratory of Economic Forest Germplasm Improvement and Resources Comprehensive Utilization,Huanggang Normal University,Huangzhou 438000,China;2.Hubei Collaborative Innovation Center for the Characteristic Resources Exploitation of Dabie Mountains,Huangzhou 438000,China)
In order to investigate the accumulation of flavonoids and β-carotene in leaves of Perilla frutescens,the contents of flavonoids and β-carotene in four kinds of perilla leaves at different stages of development,namely vegetation,blossom,and defoliation phases,were determined by UV spectrophotometry and HPLC,respectively.Results showed that β-carotene in perilla leaf were greatly accumulated at blossom phase and the highest content of β-carotene was in the leaf of Baoding-cultivar P11-3 with 4.32mg/g and flavonoids contents reached the maximum at blossom or defoliation phases with the highest content of total flavonoids being in leaf of Yingshan-wild-specie P11-7 with 83.9mg/g.Consequently,the best harvest period of perilla leaf for the development and utilization of flavonoids and β-carotene in Yingshan-wild-specie P11-7 was blossom phase,which provided theoretical basis for the reasonable harvest and utilization of perilla resources in Dabie Mountains.
folium perillae;β-carotene;total flavonoids;dynamic accumulation;blossom phase
TS255.1
A
1002-0306(2015)14-0143-05
10.13386/j.issn1002-0306.2015.14.021
2015-01-30
向福(1977-),男,博士,副教授,主要从事生物资源利用方面的研究。
项俊(1963-),男,教授,主要从事天然植物资源利用方面的研究。
生物资源保护与利用湖北省重点实验室开放基金(PKLHB1103)。
