不同提取方法对金华火腿粗肽液抗氧化活性的影响
2015-11-07胡亚亚邢路娟周光宏张万刚
胡亚亚,邢路娟,周光宏,张万刚
(南京农业大学肉品加工与质量控制教育部重点实验室,江苏南京210095)
不同提取方法对金华火腿粗肽液抗氧化活性的影响
胡亚亚,邢路娟,周光宏,张万刚*
(南京农业大学肉品加工与质量控制教育部重点实验室,江苏南京210095)
研究两种提取方法(磷酸盐和盐酸)所得金华火腿粗肽液的抗氧化活性,以自由基的清除能力,金属离子螯合能力,还原力以及总抗氧化能力为测定指标,以还原型谷胱甘肽(GSH)作对照。结果表明:磷酸盐法提取的金华火腿粗肽液(P)多肽含量显著(p<0.05)高于盐酸法提取的金华火腿粗肽液(H);质量浓度低于5mg/mL时,P和H清除DPPH自由基与超氧阴离子自由基能力无显著差异;P螯合金属离子的能力显著(p<0.05)高于H和GSH;当质量浓度为4mg/mL时,P还原力显著(p<0.05)高于H;当质量浓度为1mg/mL时,P总抗氧化能力达到GSH的48%,显著高于H(p<0.05)。因此磷酸盐所提取的金华火腿粗肽液抗氧化能力优于盐酸所提取的金华火腿粗肽液。
金华火腿,抗氧化肽,DPPH自由基清除率
自由基是一类具有高度氧化活性的带有单个或多个不配对电子的分子或原子,化学性质活跃[1],过量会导致细胞组织受到氧化胁迫,引起细胞和机体的损伤[2]。目前一些人工合成的抗氧化剂如BHT(butylated hydroxytoluene,二丁基羟基甲苯)、BHA(butylated hydroxyanisole,丁基羟基茴香醚)、TBHQ(tert-butylhydroquinone,特丁基对苯二酚)等虽能有效抑制脂质氧化,但研究证实其有一定的毒性[3]。因此,越来越多的国家开始寻求高效、无毒、安全的天然抗氧化剂替代合成抗氧化剂[4]。
金华火腿是我国著名的传统肉制品,其在制作过程中,经历很长时间发酵,在此期间蛋白质发生强烈降解,生成许多肽类[5]。Escudero[6]用盐酸溶液从西班牙干腌火腿中提取分离出具有抗高血压和抗氧化活性的短肽。王娟[7]利用磷酸盐提取金华火腿中的小肽并研究其结构。对于金华火腿抗氧化肽的提取,Zhu[8]参照西班牙干腌火腿选用盐酸作为提取液,但是西班牙干腌火腿和金华火腿之间加工方法和品质等方面存在很大差异[9],并且在强酸条件下,抗氧化肽的活性也会受到影响[8],因此提取液对不同火腿抗氧化肽的提取可能会有很大影响。而对于不同提取方法对金华火腿粗肽液抗氧化活性的影响还未见报道。本实验以两种方法提取的金华火腿粗肽液为研究对象,通过对两种金华火腿粗肽液自由基清除能力,螯合金属离子能力,还原力以及总抗氧化能力等指标的测定,确定金华火腿抗氧化活性肽的提取工艺,探讨金华火腿粗肽液的抗氧化能力,为下一步研究金华火腿多肽的抗氧化机制奠定基础。
1 材料与方法
1.1材料与仪器
金华火腿购自浙江省金字火腿食品有限公司;1,1-二苯基-2三硝基苯肼(DPPH)、还原型谷胱甘肽(GSH)、吩嗪甲酯硫酸盐(PMS)、还原型辅酶(NADH)、菲咯嗪(Ferrozine) 均购自Sigma公司,分析纯;总抗氧化能力试剂盒购于南京建成试剂公司;邻苯二甲醛、β-巯基乙醇、氢氧化钠、乙醇、磷酸二氢钠、磷酸氢二钠、铁氰化钾国药集团化学试剂公司,均为分析纯。
T25匀浆机德国IKA公司;GM200刀式研磨仪德国Retsch;RE-52AA旋转蒸发仪上海亚荣生化仪器厂;ES2030冷冻干燥机日本Hitachi公司;Spectral Max M2e多功能酶标仪美国伯腾仪器有限公司;Avanti J-E高速冷冻离心机美国Beckman Coulter公司。
1.2实验方法
1.2.1样品处理火腿按照传统加工工艺加工,包括腌制、浸泡、洗刷、整形、晒腿、成熟和后熟等过程。随机选取后熟结束的火腿六块,取股二头肌编号,在分析测试前于-20℃冰柜保存。
1.2.2粗肽的提取磷酸盐法参照王娟等[7]的方法进行。具体操作为:取后熟结束的成品股二头肌25g,绞碎后加入100mL磷酸缓冲液(pH7.0),冰浴匀浆4次(22000r/min,每次10s)。匀浆液于4℃条件下静置2h后离心(4℃,12000×g,20min)。离心完毕后,取上清液加入三倍体积40%乙醇(V∶V),放置12h后再次离心(4℃,12000×g,20min),所得上清液用1mol/L氢氧化钠调节至pH7.0。上清液经冷冻干燥后置于-20℃保存备用。此方法所得粗肽称为金华火腿粗肽P。
盐酸法参照Zhu等[10]的方法并有所修改。具体操作为:取后熟结束的成品股二头肌25g,绞碎后加入100mL 0.01mol/L HCl,冰浴匀浆4次(22000r/min,每次10s)。匀浆液在4℃,12000×g条件下离心20min。所得上清液用双层滤纸过滤后加入三倍体积乙醇,4℃条件下静止2h后,在4℃,12000×g条件下离心20min。取上清液于40℃条件下旋转蒸发,所得浓缩液于冷冻干燥机中干燥后置于-20℃保存备用。此方法所得粗肽液称为金华火腿粗肽液H。
1.2.3肽含量的测定参照Church等[11]的方法并稍作修改。邻苯二甲醛混合液的配制:取40mg邻苯二甲醛(溶于1mL甲醇),25mL 100mmol/L硼砂,2.5mL 20%(w/w)SDS和100μL β-巯基乙醇,用去离子水调至总体积为50mL。取100μL样品(包含5~100μg多肽)和2mL邻苯二甲醛混合液混匀,室温下孵育两分钟后340nm下测定吸光值。
1.2.4DPPH自由基清除率的测定参照You等[12]的方法并稍作修改。分别配制质量浓度为1、2、3、4、5mg/mL的P和H粗肽液,以相应质量浓度的GSH为对照。具体方法如下,将DPPH溶于95%乙醇中,配制成0.2mmol/L的溶液。样品组为0.5mL DPPH溶液与0.5mL肽液混合,振荡混匀,室温放置30min后,在517nm波长处测定样品吸光度值,记为A1;对照组为0.5mL DPPH溶液与0.5mL 95%乙醇混合,在517nm波长处测定样品吸光度值,记为A2;空白组为0.5mL肽液与0.5mL 95%乙醇混合,在517nm波长处测定样品吸光度值,记为A0。DPPH自由基的清除率按式(1)进行计算。

1.2.5还原力的测定还原力的测定采用铁氰化钾还原体系,参照Escudero等[13]的方法并稍作修改。配制质量浓度为1、2、3、4、5mg/mL的P和H粗肽液,以相应质量浓度的GSH为对照。具体方法如下,取0.5mL肽液、0.5mL 0.2mol/L磷酸缓冲液(pH6.6)和0.5mL 1%(w/v)铁氰化钾溶液混合,于50℃恒温水浴锅中保温20min后快速冷却。加入0.5mL 10%(w/v)醋酸,充分混匀,3000r/min离心10min。取0.5mL上清液,加0.5mL蒸馏水和0.1mL 0.1%(w/v)氯化铁,充分混匀静置10min后,在波长700nm处测定其吸光度。
1.2.6超氧阴离子自由基清除率的测定清除超氧阴离子自由基采用硝基四氮唑蓝还原法,参照Liu等[14]的方法并稍作修改。具体方法如下,用50mmol/L的Tris-HCl(pH8.0)缓冲液将粗肽配制成质量浓度为1、2、3、4、5mg/mL的P和H粗肽液,以相应质量浓度的GSH为对照。取1.5mL肽液,依次加入0.5mL 300μmol/L NBT(以pH8.0的Tris-HCl缓冲液配制),0.5mL 468μmol/L NADH(以pH8.0的Tris-HCl缓冲液配制)和0.5mL 60μmol/L PMS(以pH8.0的Tris-HCl缓冲液配制),立即混匀,并于25℃水浴5min后,560nm波长处测定吸光值。以缓冲液代替样品作为空白对照。超氧阴离子自由基的清除率按式(2)进行计算。

式中,A1—添加抗氧化肽吸光度值;A0—空白吸光度值。
1.2.7螯合金属离子能力的测定参考Xie等[15]的方法并稍作修改。具体方法为,配制质量浓度为1、2、3、4、5mg/mL的P和H粗肽液,以相应质量浓度的GSH为对照。取1mL待测溶液,加入0.05mL浓度为2mmol/L的FeCl2,充分混匀后加入0.2mL浓度为5mmol/L的菲咯嗪试剂,混匀。室温静置10min,在562nm波长处测定吸光度值为A1。以去离子水代替样品作为空白管,所测吸光度值为A0。Fe2+螯合率按式(3)进行计算。
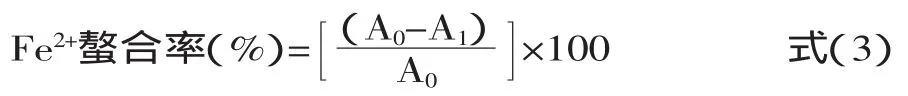
1.2.8总抗氧化能力的测定按试剂盒说明书上方法测定总抗氧化能力。
1.2.9数据统计分析实验重复6次,采用SPSSStatistics 17.0软件进行统计分析,用One-Way ANOVA方法进行方差分析,采用Duncan’s multiple range test进行多重比较,显著水平设为p<0.05。
2 结果与分析
2.1金华火腿粗肽液肽含量

表1 两种方法提取后金华火腿粗肽液肽含量Table 1 Peptide contents of Jinhua ham extracts from two extraction methods
表1列出了磷酸盐法和盐酸法提取金华火腿粗肽液肽含量的结果。由表1可知,P肽含量显著高于H肽含量(p<0.05)。磷酸提取法所得肽含量比Zhu[10]用盐酸提取法所得金华火腿提取液肽含量高11倍,说明盐酸方法提取可能对金华火腿多肽的分离不完全,磷酸盐方法提取金华火腿粗肽优于盐酸方法。
2.2金华火腿粗肽液清除DPPH自由基的能力
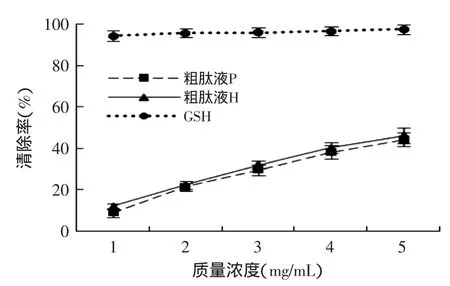
图1 不同浓度抗氧化提取物清除DPPH自由基的能力Fig.1 The effect of different concentrations of antioxidant extracts on the DPPH radical scavenging activities
图1列出了粗肽液P、粗肽液H和GSH对DPPH自由基清除能力的实验结果。如图1所示,用两种方法提取得到的粗肽液都有清除DPPH自由基的能力,但低于GSH的清除能力(p<0.05),且P与H清除DPPH自由基的能力差异不显著。随着肽浓度的增加,粗肽液清除DPPH自由基的能力显著增加(p<0.05)。在质量浓度为1mg/mL时,粗肽液P的清除率约为8.9%,H的清除率为11.9%,而浓度达到5mg/mL时,DPPH自由基清除率分别达到了44.2%和46.0%。金华火腿中所含肽大多为5~16个氨基酸组成,具有一定的疏水性,因此随着浓度的增加,对DPPH自由基的亲和能力逐渐增加[16]。在一定质量浓度范围内,两种提取方法对DPPH自由基清除能力影响差异不显著,且都具有较高的DPPH自由基清除率。
2.3金华火腿粗肽液清除超氧阴离子自由基的能力
粗肽液P、粗肽液H和GSH对超氧阴离子自由基清除能力的实验结果如图2所示。超氧阴离子自由基本身并不活泼,但却是机体产生自由基的根源,它既可以作为还原剂又可以作为氧化剂,还可以作为亲核物和配体参与反应,导致机体氧化损伤[17]。由图2所示,用两种方法提取得到的粗肽液都有超氧阴离子清除能力,但低于GSH的清除能力(p<0.05)。在质量浓度小于5mg/mL时,H和P的超氧阴离子清除能力差异不显著(p>0.05)。在质量浓度为5mg/mL时,P(74.9%)显著低于H(80.9%),分别达到GSH(94.4%)超氧阴离子自由基清除率的79%和86%(p<0.05)。研究表明一些侧链有氨基或羧基的特定氨基酸(如Lys、Asp和Glu)具有清除自由基的作用,能够增强肽的抗氧化性[18]。金华火腿中有较高含量的谷氨酸和赖氨酸[19],因此随着浓度的增加,其清除超氧阴离子自由基的能力逐步增加。在低质量浓度范围内,两种提取方式所得金华火腿粗肽液对超氧阴离子自由基清除能力差异不显著,都有较高的清除率。
2.4金华火腿粗肽液的还原力
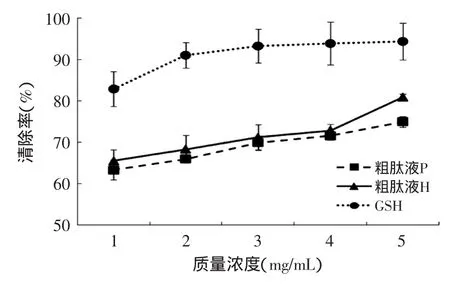
图2 不同浓度抗氧化提取物清除超氧阴离子自由基的能力Fig.2 The effect of different concentrations of antioxidant extracts on the superoxide anion radical scavenging activities
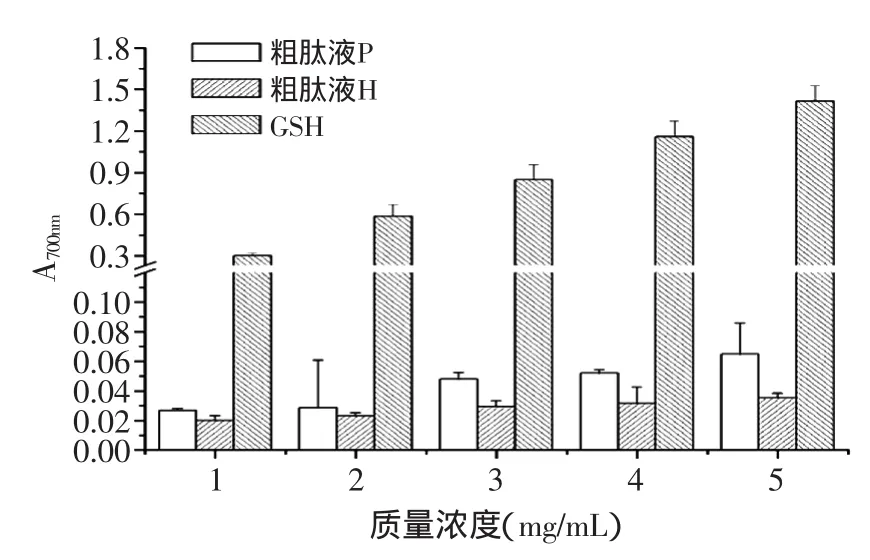
图3 不同浓度抗氧化提取物的还原力Fig.3 The effect of different concentrations of antioxidant extracts on reducing power
图3列出了粗肽液P、粗肽液H和GSH还原力的实验结果。由图3所示,GSH还原力最强,极显著高于金华火腿粗肽提取液P和H(p<0.01)。三种抗氧化物质还原力随着质量浓度的增大逐渐增加,并存在明显的剂量效应关系。在质量浓度低于2mg/mL时,金华火腿提取液P还原力和H无显著差异。当质量浓度达到3mg/mL时,金华火腿提取液P还原力显著高于金华火腿提取液H(p<0.05);在4mg/mL时,P的还原力极显著高于H(p<0.01);在质量浓度达到5mg/mL时,P还原力是H的1.8倍。还原力在一定程度上代表抗氧化物质提供电子的能力,还原力强的物质是优良的电子供体。一般自由基的清除是通过抗氧化物提供电子并生成稳定的物质而实现的,因此抗氧化物质提供电子能力的强弱能够反映其抗氧化能力的强弱[20]。所以,在质量浓度较高的范围内,P还原力比H高。
2.5金华火腿粗肽液螯合Fe2+的能力
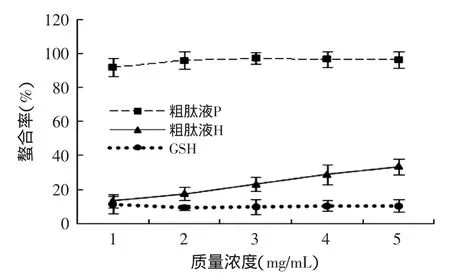
图4 不同浓度抗氧化提取物螯合Fe2+的能力Fig.4 The effect of different concentrations of antioxidant extracts on the Fe2+-chelating ability
粗肽液P、粗肽液H和GSH螯合Fe2+能力的实验结果如图4所示。有研究表明过渡金属(Fe2+和Cu2+)是产生自由基的媒介,可以催化活性氧的产生,如羟自由基和超氧阴离子自由基[21]。抗氧化剂能影响金属离子的催化活性,进而抑制其催化氧化的过程,因而测定其金属离子的螯合能力是评价物质抗氧化活性的有效方法。由图4可知,随着质量浓度的增加,H螯合Fe2+的能力显著增加(p<0.05),由质量浓度为1mg/mL时的13.3%增至质量浓度5mg/mL时的33.5%。P的抗氧化能力随着质量浓度的增加变化不显著,并且粗肽液P表现出很强的Fe2+螯合能力,在质量浓度为1mg/mL时其螯合能力高达92.1%。在质量浓度达到2mg/mL时,P和H都极显著高于GSH(p<0.01)。与GSH相比,金华火腿粗肽液具有极强的金属离子螯合能力,这可能与其中含有大量的酸性氨基酸和中性氨基酸有关,其侧链中包含的氨基和羧基能够与Fe2+紧密结合,从而减少Fe2+的含量,抑制了自由基的产生。这一特点对于其发挥抗氧化作用起着至关重要的作用[22]。
2.6金华火腿粗肽液的总抗氧化能力
图5列出了粗肽液P、粗肽液H和GSH总抗氧化能力的实验结果。物质的总抗氧化能力是其清除不同种类自由基,或是其不同活性成分清除不同自由基的总和。目前用于测定物质体外抗氧化能力的方法大多是针对某一种自由基而言,无法全面反映其总抗氧化能力[23]。由图5可知,P总抗氧化能力高于H,但显著低于GSH(p<0.05),随着质量浓度的增加,P总抗氧化能力显著增加(p<0.05)。在质量浓度为1mg/mL时,P(0.7U/mL)极显著(p<0.01)高于H(0.1U/mL),达到GSH(1.6U/mL)总抗氧化能力的48%。因此,P的总抗氧化能力比H高。
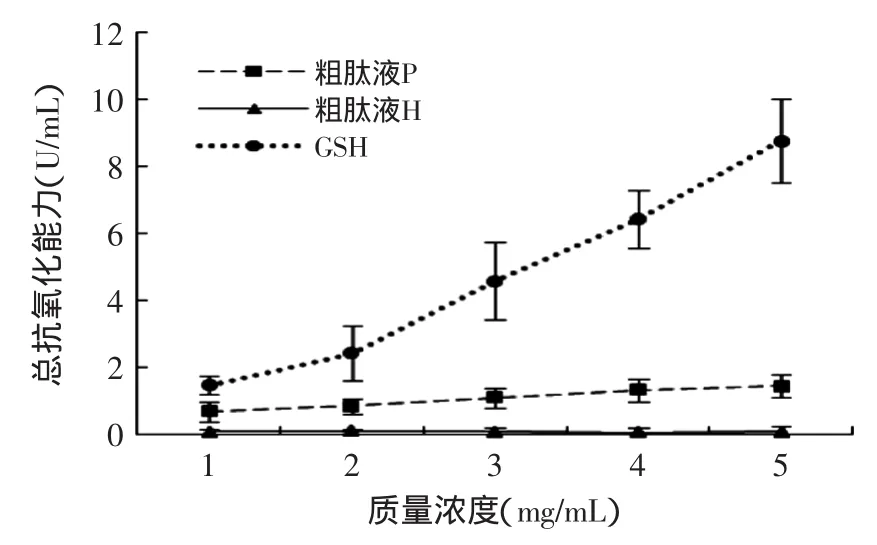
图5 不同浓度抗氧化提取物的总抗氧化能力Fig.5 The effect of different concentrations of antioxidant extracts on T-AOC
3 结论
磷酸盐提取的金华火腿粗肽液多肽含量显著(p<0.05)高于盐酸提取的金华火腿粗肽液,其抗氧化活性随着质量浓度的增加而增加,清除自由基能力与盐酸提取的金华火腿粗肽液相当,而还原力,螯合Fe2+能力和总抗氧化能力显著高于盐酸提取的金华火腿粗肽液(p<0.05)。盐酸所提供的强酸性环境,会对抗氧化肽活性造成不可逆的损伤,而磷酸盐在平衡渗透压、维持离子强度和调节pH方面都有更好作用,这可能是磷酸盐提取的金华火腿粗肽液的抗氧化能力优于盐酸提取的金华火腿粗肽液的主要原因。因此,磷酸盐提取法更适合于金华火腿中抗氧化肽的提取。
[1]方承辉,Bulklry G B.氧自由基在人体疾病过程中的作用[J].国际外科学杂志,1984,2:7.
[2]陈慧婵,裴斐,杨文建,等.金针菇,香菇和蛹虫草对小鼠体内抗氧化酶活性的影响[J].食品科学,2014,35(1):219-223.
[3]贾韶千.银杏抗氧化肽的制备,结构鉴定及活性研究[D].南京:南京林业大学,2011.
[4]张莹,祖元刚.迷迭香抗氧化剂的高效分离与抗氧化活性研究[D].哈尔滨:东北林业大学,2008.
[5]赵改名,周光宏,柳艳霞,等.肌肉非蛋白氮和游离氨基酸在金华火腿加工过程中的变化[J].食品科学,2006,27(2):33-37.
[6]Escudero E,Aristoy M C,Nishimura H,et al.Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J].Meat science,2012,91(3):306-311.
[7]王娟,赵改名,张建威,等.金华火腿中小肽的分离纯化及结构研究[J].食品科学,2012,33(9):16-20.
[8]Zhu CZ,Zhang WG,Kang ZL,et al.Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat science,2014,96(2):783-789.
[9]励建荣.意大利和西班牙火腿生产技术与金华火腿之对比及其启发[J].中国调味品,2009(2):36-39.
[10]Zhu C Z,Zhang W G,Zhou G H,et al.Isolation and identification of antioxidant peptides from Jinhua ham[J].Journal of agricultural and food chemistry,2013,61(6):1265-1271.[11]Church F C,Swaisgood H E,Porder D H,et al. SpectrophotometricAssayUsingo-Phthaldialdehydefor Determination of Proteolysis in Milk and Isolated Milk Proteins[J].Journal of Dairy Science,1983,66(6):1219-1227.
[12]You L,Zhao M,Regenstein J M,et al.Purification and identification of antioxidative peptides from loach(Misgurnus anguillicaudatus)proteinhydrolysatebyconsecutive chromatography and electrospray ionization-mass spectrometry[J].Food research international,2010,43(4):1167-1173.
[13]Escudero E,Mora L,Fraser P D,et al.Identification of novel antioxidant peptides generated in Spanish dry-cured ham[J].Food chemistry,2013,138(2):1282-1288.
[14]Liu F,Ooiv E C,Chang S T.Free radical scavenging activities of mushroom polysaccharide extracts[J].Life Sciences,1997,60(10):763-771.
[15]Xie Z,Huang J,Xu X,et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chemistry,2008,111(2):370-376.
[16]祝超智,张万刚,徐幸莲,等.金华火腿粗肽液的体外抗氧化活性[J].肉类研究,2013(6):5-9.
[17]Wiriyaphan C,Chitsomboon B,Yongsawadigul J.Antioxidant activity of protein hydrolysates derived from threadfin bream surimi byproducts[J].Food Chemistry,2012,132(1):104-111.
[18]沈浥.乳清蛋白抗氧化肽的制备及其活性研究[D].无锡:江南大学,2009.
[19]赵改名.肌肉蛋白水解酶在金华火腿加工过程中作用的研究[D].南京:南京农业大学,2004.
[20]Ferreira I C F R,Baptista P,Villas-Boas M,et al.Freeradical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal:Individual cap and stipe activity[J].Food Chemistry,2007,100(4):1511-1516.
[21]李庆祥,周井炎.几种过渡金属配合物产生活性氧的能力[J].武汉化工学院学报,2000,22(2):6-7.
[22]Najafian L,Babji A S.A review of fish-derived antioxidant and antimicrobial peptides:their production,assessment,and applications[J].Peptides,2012,33(1):178-185.
[23]Liu Q,Kong B,Li G,et al.Hepatoprotective and antioxidant effectsofporcineplasmaproteinhydrolysatesoncarbon tetrachloride-induced liver damage in rats[J].Food and Chemical Toxicology,2011,49(6):1316-1321.
Effect of extraction methods on the antioxidant activity of crude peptides from Jinhua ham
HU Ya-ya,XING Lu-juan,ZHOU Guang-hong,ZHANG Wan-gang*
(Key Laboratory of Meat Products Processing and Quality Control,Ministry of Education,Nanjing Agricultural University,Nanjing 210095,China)
Crude peptides were extracted by two solutions from Jinhua ham and evaluated for antioxidant activity by radical scavenging,metal ion chelating,reducing power and the total antioxidant capacity(T-AOC)with GSH as control.The results showed that the crude peptide extract from Jinhua ham using PBS as solution(crude peptide P)presented higher peptide content than crude peptide extract using HCl as solution(crude peptide H).The DPPH radical scavenging capacity and the superoxide anion radical scavenging activities of crude peptide P did not differ significantly from that of crude peptide H below 5mg/mL.In addition,the crude peptide P showed higher metal ion chelating activity than crude peptide H and GSH,which presented higher reducing power than crude peptide H at 4mg/mL(p<0.05).Total antioxidant capacity of crude peptide P reached 48%of GSH at 1mg/mL,which was significantly higher than crude peptide H(p<0.05).In conclusion,crude peptide P had higher antioxidant activity than crude peptide H.
Jinhua ham;antioxidant peptide;DPPH radical scavenging ratio
TS251.1
A
1002-0306(2015)14-0115-05
10.13386/j.issn1002-0306.2015.14.014
2014-12-05
胡亚亚(1990-),男,硕士研究生,研究方向:肉品加工与质量控制。
张万刚(1977-),男,教授,研究方向:畜产品加工与质量控制。
南京农业大学人才引进项目(804085);“十二五”国家科技支撑计划项目(2012BAD28B03)。
