沙眼衣原体临床株对利福平的体外敏感性及rpoB基因耐药突变检测
2015-11-07江勇杨丽娜刘原君侯淑萍齐蔓莉刘全忠
江勇 杨丽娜 刘原君 侯淑萍 齐蔓莉 刘全忠
沙眼衣原体临床株对利福平的体外敏感性及rpoB基因耐药突变检测
江勇 杨丽娜 刘原君 侯淑萍 齐蔓莉 刘全忠
目的 检测沙眼衣原体临床株对利福平的体外敏感性,探讨rpoB基因突变与临床耐药的关系。方法 采用微量细胞培养法确定利福平对52株沙眼衣原体临床株的最低抑菌浓度。扩增所有临床株以及标准株rpoB基因,然后进行单链构象多态性分析。并随机选取两株临床株进行测序。结果 52株临床菌株中未检出耐药株,利福平的最低抑菌浓度是0.004~0.030 mg/L。SSCP和测序均未发现rpoB耐药突变。结论 利福平治疗沙眼衣原体失败患者未检测到rpoB基因突变,利福平治疗失败与多种因素有关。
沙眼衣原体;利福平;微生物敏感性试验;抗药性,微生物;DNA突变分析;基因,rpoB
沙眼衣原体(Chlamydia trachomatis,Ct)感染治疗失败与耐药的报告日渐增多[1]。有学者认为对利福平耐药的产生主要与rpoB基因的点突变有关[2]。为监测近年天津市Ct对利福平的体外敏感性,我们检测52例Ct临床分离株的体外敏感性,采用单链构象多态性分析(SSCP)方法研究rpoB突变。
一、资料和方法
1.资料:2005年4月至2008年3月,52株Ct临床株分离自天津市性传播疾病研究所门诊收集的沙眼衣原体尿道炎或宫颈炎患者尿道或宫颈口分泌物,其中36例患者用利福平治疗失败,16例患者未接受利福平治疗。采样标准:直接免疫荧光检测到衣原体原体或乳胶免疫层析法检测到目的条带。男性有不同程度的尿道炎症状,女性有阴道异常分泌物;非妊娠期妇女;拭子标本淋球菌、支原体检测阴性;涂片在油镜下平均每视野中多形核白细胞数>5个;就诊前2周内未用抗菌药物。
McCoy细胞来自中国医学科学院皮肤病研究所。利福平标准品来自中国药品生物制品检定所。
2.沙眼衣原体细胞培养:参照以往改进的方法分离沙眼衣原体[3]。
3.体外药物敏感性测定:预先确定能引起90%以上细胞感染的Ct接种量。抗菌药工作浓度参照文献[3],设6个倍比稀释浓度:0.03、0.015、0.008、0.004、0.002、0.001 mg/L。将McCoy细胞接种于96孔板孵育24 h,形成致密单层细胞。按接种量加入Ct,32℃,1 100×g,离心1 h后置于5%C02,37℃温箱中孵育2 h。弃液,每孔加入含不同浓度抗菌药的感染液(含胎牛血清、庆大霉素、万古霉素、两性霉素B、放线菌酮的MEM液)[3],同时设阴性对照(加药,不接种沙眼衣原体)和阳性对照(接种沙眼衣原体,不加药)。孵育48 h,甲醇固定后碘染色,显微镜下观察未见Ct包涵体的最低浓度为最小抑菌浓度(MIC)。
4.rpoB基因单链构象多态性分析及测序:蛋白酶K法制备基因组DNA。上游引物:5′-GCGAATGGGCGATGAGAAG A-3′,下游引物5′-CCGTACTTGTGTCGGCTTCA-3′[1]。95℃预变性10 min;95℃变性40 s;52℃退火40 s;72℃延伸60 s;35个循环后,72℃延伸10 min。预期目的片段656 bp。取6 μl PCR产物,加入6 μl普通10X上样缓冲液,混匀。95℃水浴中变性10 min,取出标本立即冰浴,并置于-20℃5 min。8%聚丙烯酰胺凝胶电泳,4℃,80 V电泳6 h,溴化乙锭染色,紫外线透射反射分析仪下观察、拍照,电泳较慢的为突变株。同时随机选择2株(MIC分别是0.03和0.008 mg/L)PCR产物送上海英骏生物技术有限公司测序。
二、结果
1.药敏试验:临床分离株52株传代至感染率>90%,进行利福平体外药敏试验,结果MIC值0.004~0.030 mg/L,其中2株、9株、25株、16株MIC值分别是0.004、0.008、0.015、0.030 mg/L。所有MIC值均低于血药浓度或组织药物浓度。
2.rpoB基因突变分析:完成52例临床株及E型标准株rpoB扩增,目的片段656 bp。SSCP检测未发现突变株。见图1,2。测序结果显示,与E型标准株比较,2株临床株rpoB基因273位无C→T突变(Ala522→Val),284位也无C→T突变(His526→Tyr)。

图1 rpoB基因扩增产物琼脂糖凝胶电泳图 1:阴性对照;2~4:临床株,扩增产物656 bp;5:E型标准株;M:标准参照物
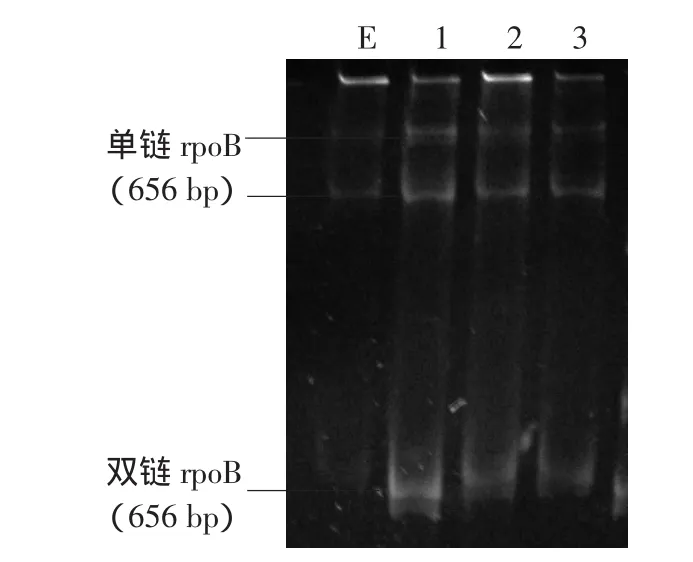
图2 rpoB单链构象多态性分析聚丙烯酰胺凝胶电泳图 E:E型标准株;1~3:不同临床株。各临床株与E型标准株电泳后的2条单链均在同一水平,表明基因序列相同
三、讨论
利福平为利福霉素类半合成广谱抗菌药,对多种病原体均有抗菌活性,对宿主细胞内外的病原体均有明显的杀菌作用。因为不良反应,利福平在临床中不作为治疗非淋病尿道炎的一线药物。利福平的峰值血药浓度为7~9 mg/L,远大于我们测定的MIC值(0.004~0.030 mg/L),显示了较高的抗衣原体活性。但是,41例样本(78.85%)测定值高于文献报道值0.007 5 mg/L[4]。利福平与其他抗生素联合也有不错的效果。研究表明,单纯阿奇霉素不能将沙眼衣原体从宿主细胞中清除,从而形成持续感染,可以检测到Ct的脂多糖和rRNA。但阿奇霉素与利福平联合时无耐药,且较早抑制rRNA的合成[4]。
利福平通过与衣原体的RNA聚合酶(RNAP)的β亚单位rpoB结合发挥作用。rpoB基因核心区的核苷酸改变引起结合力下降。rpoB主要有3个部位的基因簇Ⅰ~Ⅲ易发生核苷酸变化,对应的氨基酸位置分别是507-533,560-572,687。其中90%的核苷酸改变位于基因簇Ⅰ。基因簇Ⅰ的核苷酸改变与耐药有关。2003年,Dreses-Werringloer等[2]检测5株利福平耐药突变株的rpoB的核苷酸序列。其中,3株变异株(最小抑菌浓度4 mg/L)在基因簇Ⅰ区522位密码子GCA突变成GTA,相应的丙氨酸被缬氨酸所取代;另外2株高水平耐药的变异株(最小抑菌浓度64~256 mg/L)在基因簇Ⅰ区526位密码子CAC突变成TAC,相应的组氨酸被酪氨酸所取代。作者推测还有其他耐药机制,因为发生His526→Tyr突变的不同沙眼衣原体株,利福平MIC值可相差4倍。Kutlin等[5]研究2株利福平耐药沙眼衣原体的rpoB基因,测序发现其中1株发生His526→Tyr突变,然而另1株无突变,因此首次提出沙眼衣原体耐受利福平与rpoB基因突变无关。我们采用U.Dreses-Werringloer等的方法,扩增rpoB中心区的基因簇Ⅰ、Ⅱ,然后通过SSCP检测rpoB基因突变株。SSCP方法及测序结果均未发现突变,与药敏试验无耐药株一致。
因此,不良反应较少的利福霉素类药物,既能杀灭细胞外的衣原体,又能避免衣原体持续感染,可能将成为治疗衣原体感染的理想选择。利福平可以作为临床二线用药治疗沙眼衣原体感染,虽然MIC值有所提高,但是远远没有达到体外耐药的水平。临床利福平治疗沙眼衣原体失败患者未检测到rpoB基因突变,利福平治疗失败与多种因素有关。
[1]Mpiga P,Ravaoarinoro M.Chlamydia trachomatispersistence:an update[J].Microbiol Res,2006,161(1):9-19.
[2]Dreses-Werringloer U,Padubrin I,Köhler L,et al.Detection of nucleotide variability in rpoB in both rifampin-sensitive and rifampin-resistant strains ofChlamydia trachomatis[J].Antimicrob Agents Chemother,2003,47(7):2316-2318.
[3]江勇,杨丽娜,齐蔓莉,等.提高沙眼衣原体临床株培养阳性率的探讨[J].中国麻风皮肤病杂志,2008,24(9):706-708.
[4]Dreses-Werringloer U,Padubrin I,Zeidler H,et al.Effects of azithromycin and rifampin onChlamydia trachomatisinfectionin vitro[J].Antimicrob Agents Chemother,2001,45(11):3001-3008.
[5]Kutlin A,Kohlhoff S,Roblin P,et al.Emergence of resistance to rifampin and rifalazil inChlamydophila pneumoniaeand Chlamydia trachomatis[J].AntimicrobAgentsChemother,2005,49(3):903-907.
In vitroactivity of rifampin against and rpoB mutations inChlamydia trachomatisclinical isolates
Jiang Yong, Yang Lina,Liu Yuanjun,Hou Shuping,Qi Manli,Liu Quanzhong*.*Department of Dermatology and Venereology,General Hospital of Tianjin Medical University,Tianjin 300052,China
< class="emphasis_italic">Corresponding author:Liu Quanzhong,Email:liuquanzhong@medmail.com.cn
Liu Quanzhong,Email:liuquanzhong@medmail.com.cn
ObjectiveTo evaluate the susceptibility ofChlamydia trachomatisclinical isolates to rifampin,and assess the relationship between rpoB mutations and antibiotic resistance in them.MethodsA microculture method was used to determine the minimal inhibitory concentration(MIC)of rifampin in 52Chlamydia trachomatisclinical isolates. The rpoB gene was amplified from all the clinical isolates and a standard strain ofChlamydia trachomatisfollowed by single-strand conformation polymorphism(SSCP)analysis.Sequencing of PCR products was carried out for two clinical isolates.ResultsNo rifampin-resistant strain was found among these clinical isolates.The MIC of rifampin varied from 0.004 to 0.030 mg/L.Neither SSCP analysis nor sequencing showed rpoB mutations.ConclusionsNo rpoB mutations were found inChlamydia trachomatisisolates from patients unresponsive to rifampin.The unresponsiveness to rifampin may be attributed to multiple factors.
Chlamydia trachomatis;Rifampin;Microbial sensitivity tests;Drug resistance,microbial;DNA mutational analysis;Genes,rpoB
10.3760/cma.j.issn.0412-4030.2015.10.018
国家自然科学基金(30872285)
300052天津医科大学总医院皮肤性病科[江勇(现在天津医科大学第二医院皮肤性病科,300211)、刘原君、侯淑萍、齐蔓莉、刘全忠)];天津医科大学第二医院皮肤性病科(杨丽娜)
刘全忠,Email:liuquanzhong@medmail.com.cn
2014-12-31)
(本文编辑:尚淑贤)
