皮肤鳞状细胞癌组织中SFRP1基因启动子甲基化研究
2015-11-07梁俊琴伊力努尔哈力甫邹云敏罗东袁虎普雄明
梁俊琴 伊力努尔·哈力甫 邹云敏 罗东 袁虎 普雄明
皮肤鳞状细胞癌组织中SFRP1基因启动子甲基化研究
梁俊琴 伊力努尔·哈力甫 邹云敏 罗东 袁虎 普雄明
目的 探讨SFRP1与皮肤鳞状细胞癌(鳞癌)临床病理的关系及其在鳞癌发生发展中的可能作用机制。方法 用MassARRAY质谱仪EpiTYPER甲基化方法检测鳞癌组织,癌旁组织和正常皮肤组织各40例样本中SFRP1基因启动子甲基化状态。结果 共完成SFRP1基因启动子2个片段17个CpG位点1951个CpG单位(1951/2255,86.52%)的甲基化评估,鳞癌与癌旁组织相比、癌旁组织与正常组织相比分别检测出10个CpG位点(10/17,58.82%),5个CpG位点(5/17,29.41%)甲基化率差异有统计学意义(P<0.05)。检测到SFRP1基因启动子3个位点在不同组织病理级别差异有统计学意义(P<0.05),其甲基化率鳞癌Ⅲ级>鳞癌Ⅱ级>鳞癌Ⅰ级。结论 SFRP1在皮肤鳞癌中呈现高甲基化率,可能参与了鳞癌的发生发展过程。
癌,鳞状细胞;DNA甲基化;信号传导;SFRP1;基因启动子
皮肤鳞状细胞癌(鳞癌)是常见的皮肤肿瘤之一。研究表明,鳞癌发病除了与紫外线照射尤其是长波紫外线、放射性损伤、人类乳头瘤病毒(HPV)感染、炎症病变长期溃疡、癌基因突变等因素相关之外,还与一些遗传及表观遗传因素有关,越来越多的分子信号转导途径在恶性肿瘤中的作用受到关注[1]。Wnt信号通路是生物进化中具有高度同源性,相对保守的信号通路,也是细胞发育和调节蛋白质生长的一个关键途径[2]。我们用EpiTYPER甲基化方法检测40例皮肤鳞癌,癌旁组织和正常皮肤组织中Wnt信号通路抑制因子SFRP1基因启动子甲基化状态,探讨其可能的作用机制,为皮肤鳞癌表观遗传学发病机制提供一定依据。
对象与方法
一、对象
7例(17.50%);未见Ⅳ级。其中男23例,女17例,年龄45.3~93.1.0岁,平均年龄(63.86±4.14)岁,病程6~203个月,平均(23.41±1.28)个月;②癌旁组织组:上述患者取皮肤鳞癌癌旁组织1~2 cm;③正常对照组:40例正常人取自整形科手术切除正常皮肤,两组年龄和性别差异无统计学意义(均P>0.05),具有可比性。本研究通过医院伦理委员会批准,患者均签署知情同意书。
二、主要材料与仪器
DNA提取盒(德国 Qiagen公司);EZ DNA Bisulfite Treatment试剂盒和MassCleavetm Reagent试剂盒 (日本 TaKaRa公司);Nanodispenser、MassARRAY质谱仪(美国Sequenom公司)。
三、方法
1.基因组DNA的提取及浓度纯度检测:将组织蜡块切成5~10 μm薄片,取10~15片放入微量离心管中,按照DNA提取盒操作步骤进行提取。用超微量紫外分光光度计检测记录DNA浓度、A260/A230的比值和A260/A280的比值。A260/A280的比值在1.6~1.9之间表明核酸样品无蛋白质污染,为合格样本;<1.6说明样品中有蛋白质的污染。DNA浓度>20 ng/μl为合格样本。
2.引物设计:软件进行引物设计得到SFRP1基因CpG岛可扩增片段,选择其中2段作为目的片段。分别标记为SFRP1_1、SFRP1_2。SFRP1_1引物序列:5′-CATGTGTGCCTGAGTGATGGACTTGGTAT TTACACCAGCCACGCTGATAAGTGCACATGTGTTT TTAATGTTTTGGCTTTCCACACCACAAACACACAG ATGTGCTGTCGCCCGGGCTAGGACTTGAGTAGGGT TTTTCTATTTAAATATATATTATATATTTAAAAAAG TGTCCTCCCAGAGCTAATACCGTTGCTAGCAGCTC TTCCTGCCGCCACACCGGGCAAAGTCCACCCACTG CCCCAGTGTTGAGGGCCACCATGGGCGGCCCCAC CTGGAGAGGTGCTGCTC-3′。SFRP1_2引物序列:5′-AGTTTGGGAGGCCAAGGCAGGAGCATCACCTGA GGTCAGGAGTTCGAGACCAGCCTGGCTAACATGG TGAAACCCCGTCTCTACTAAAAATACAAAAAATTA GCGGGGGCATGGTGGCACGCGGCTGTAATCCCAG CTACTCGGGAGGCTGAGGCAGGAGAATCGCTTGA ACCCGGGAGGCGGAGGTTGCAGTCAGCGGAGATA GCGCCATTGCACTCCAGCTTAGGCAACAAGAGCG AAACTGTCTCAAAAAAAAAAAGTCTTCATAATTTC ATGGGTTTGCAAGTATGATCCAGGCTCC-3′。
3.EpiTYPER甲基化检测步骤:①将样本加入CT转化剂等按照步骤进行基因组DNA亚硫酸氢盐处理;②按照反应条件,将准备好的配置碱基特异性酶切混合物混匀,离心后放置到384反应中按照条件循环进行PCR扩增反应;③从PCR仪中取出样品进行虾碱性磷酸酶处理,PCR扩增产物(SAP纯化)后进行片段化及树脂交换;④将所有准备好的样本放入MassArray点样仪,逐一点样,点好样本的芯片放入MassArray质谱仪进行质谱检测,在数据服务器上通过EpiTYPER数据软件进行分析。
四、统计学处理
EpiTYPER软件对SFRP1基因启动子甲基化质谱分析;运用SPSS17.0软件计算皮肤鳞癌,癌旁组织及正常组织组织中SFRP1各CpG单位平均甲基化率及标准误差。皮肤鳞癌组与癌旁组织比较采用配对秩和检验,两组与正常对照组的比较采用Mann-WhitneyU检验,P<0.05为差异有统计学意义。
结果
一、3组样本中SFRP1各CpG单位甲基化率比较结果
在鳞癌与正常组织比较中检测到,除了CpG2_8、CpG 2_11、CpG 2_12三个位点之外,其余14个CpG位点(14/17,82.35%)在皮肤鳞癌的SFRP1基因CpG位点甲基化率高于正常对照组,差异有统计学意义(P<0.05)。皮肤鳞癌与癌旁组织相比较有10个(10/17,58.82%)CpG位点甲基化率差异具有统计学意义(P<0.05),10个CpG位点分别为CpG 1_2、CpG 1_5、CpG 1_6、CpG 1_7、CpG 2_1、CpG 2_2、CpG 2_3、CpG 2_4.5、CpG 2_6、CpG 2_12,皮肤鳞癌SFRP1基因甲基化率高于癌旁组织。癌旁组织与正常组织中有5个(5/17,29.41%)甲基化CpG位点差异有统计意义(均P<0.05),分别是CpG 1_6、CpG 2_1、CpG 2_2、CpG 2_4.5、CpG 2_6。这5个CpG位点甲基化率在癌旁组织高于正常对照组织,结果见表1,2。
二、SFRP1各CpG位点甲基化率在皮肤鳞癌不同组织病理分级的比较
SFRP1共2个CpG片段17个CpG位点591个(86.91%)CpG单位的甲基化率与皮肤鳞癌病理分级比较,结果见表3,其中3个SFRP1 CpG位点,分别是CpG 1_5、CpG 1_7、CpG 2_8,在不同病理级别差异有统计学意义(P<0.05),其位点甲基化率鳞癌Ⅲ级>Ⅱ级>Ⅰ级。
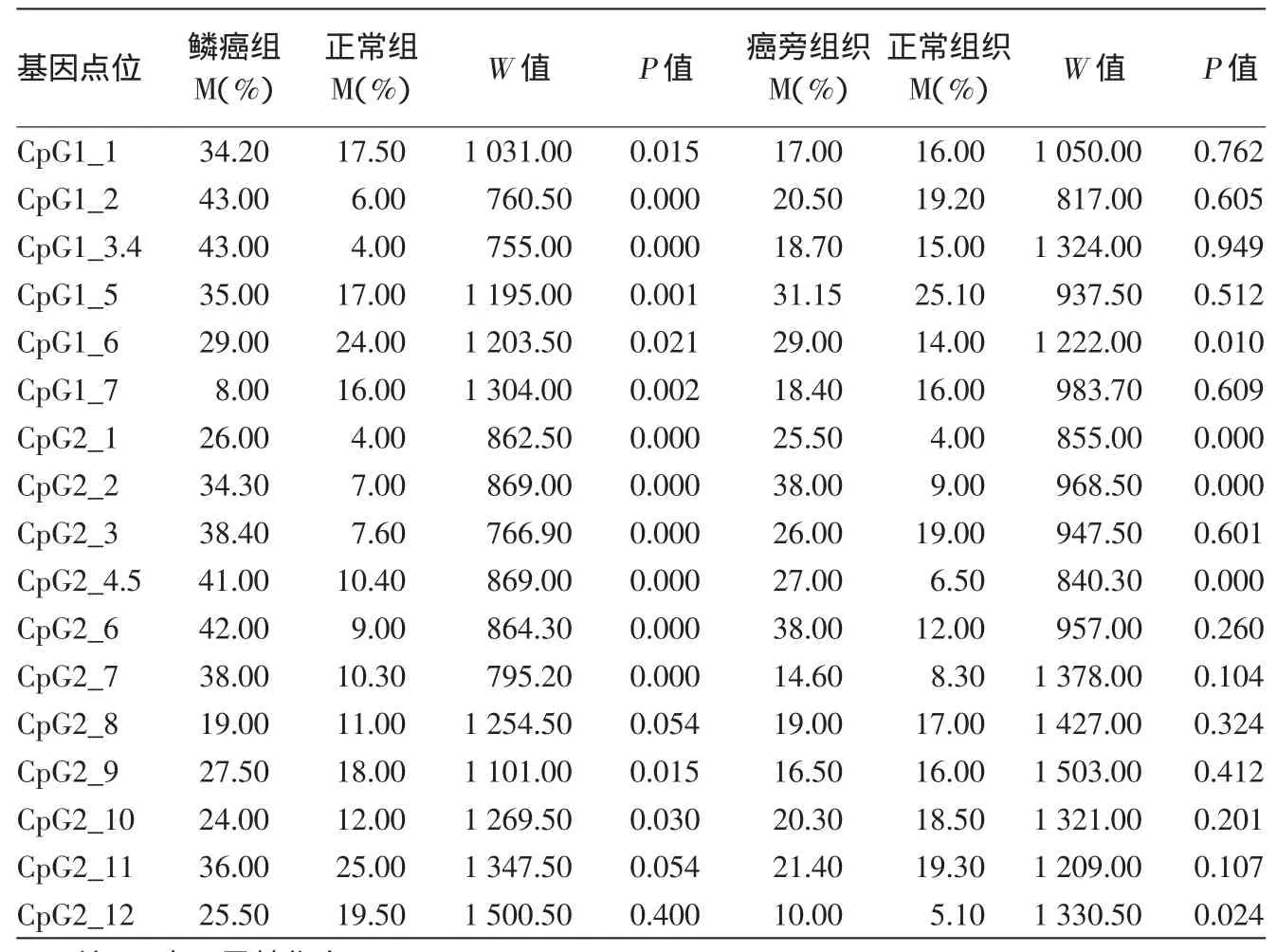
表1 皮肤鳞状细胞癌(鳞癌)组织、癌旁组织与正常皮肤组织中SFRP1各CpG位点甲基化率比较
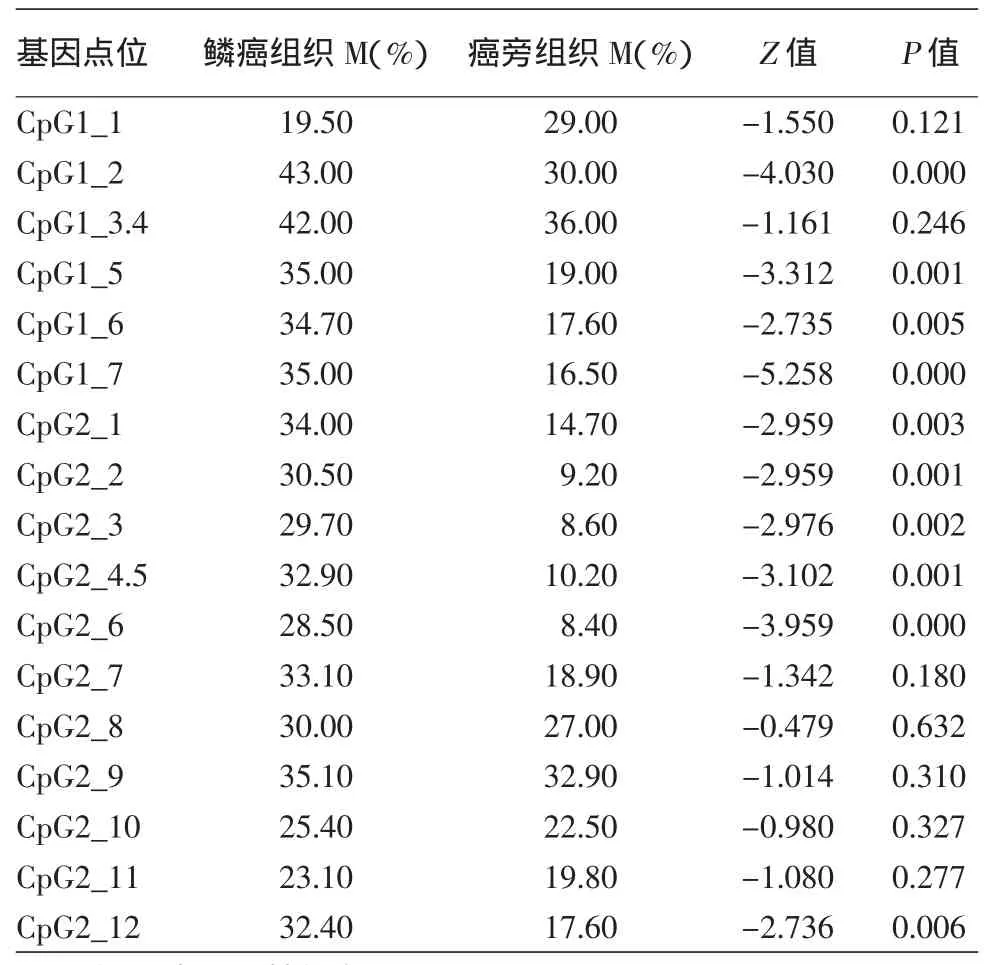
表2 皮肤鳞状细胞癌(鳞癌)组织与癌旁组织中SFRP1各CpG位点甲基化率比较
三、SFRP1各CpG位点甲基化的受试者工作特征曲线
运用 SPSS17.0软件绘制SFRP1的2个CpG片段17个CpG位点1951个(1951/2255,86.52%)CpG单位甲基化率的ROC曲线,判断各位点甲基化检测对皮肤鳞癌诊断识别能力的比较。SFRP1 CpG 1_1-4位点甲基化ROC曲线最靠左上角,提示该CpG位点高甲基化率检测皮肤鳞癌识别能力最高。
讨论
皮肤鳞癌的发生是一个多因素参与的、多环节的复杂过程,涉及遗传、感染、物理、化学、免疫等多种因素,其最终导致不可调控的细胞异常增殖而诱发肿瘤[4]。研究显示,肿瘤发病研究热点包含遗传学机制和表观遗传学两大机制[5]。肿瘤细胞DNA甲基化主要表现形式有基因总体甲基化水平降低和某些特定区域的甲基化水平增高,总体水平的基因低甲基化常发生在高度重复序列和中度重复序列,这种低甲基化状态使染色体不稳定,使对应的CpG岛甲基化增强,相关的细胞周期调控基因,DNA相关修复基因表达沉默,诱发肿瘤[6]。EI-Naggar等[7]研究中,通过蛋白质、DNA、RNA 3个水平上检测头颈部鳞癌细胞系和46例原发性头面颈部肿瘤组织p16基因甲基化状态,结果显示,6例在exon1和exon2发现甲基化。Rosas等[8]用甲基化特异的聚合酶链反应(MSP)法同时检测了p16、O6-甲基鸟苷-DNA-甲基转移酶(MGMT)、死亡相关蛋白激酶(DAP-K)基因在30例头颈部鳞癌组织中的甲基化状态,发现56%患者中至少有1个基因发生异常甲基化。本实验研究皮肤鳞癌组织中Wnt信号通路的抑制因子SFRP1,基因启动子区呈现高甲基化状态,在不同的皮肤鳞癌病理级别中表现不同。
Wnt信号通路是生物进化中具有高度同源性,相对保守的信号通路,也是细胞发育和调节蛋白质生长的一个关键途径。鳞状细胞癌细胞的生长和存活依赖于Wnt信号通路[9]。Wnt信号通路抑制因子分泌型卷曲相关蛋白(secreted frizzled related protein,SFRP)也是一种分泌型糖蛋白家族,由SFRP基因编码,约有300个氨基酸残基,包括一个同源的N-末端CRD和一个C-末端。SFRP1基因是分泌型糖蛋白家族之一,定位于染色体8p12-11.1与卷曲蛋白受体(Fz)的结构上极为相似,具有同源的配体抑制区,它可通过竞争性抑制Fz受体而抑制Wnt通路[10]。SFRP1基因甲基化后激活Wnt信号通路,导致其通路中的核心蛋白β联蛋白在细胞质中累积并转移到细胞核内与相关转录因子结合,从而参与皮肤鳞癌的发生发展[11]。本研究观察皮肤鳞癌组织、癌旁组织、正常皮肤组织中共120个样本,检测SFRP1基因2个CpG片段17个CpG位点1951个CpG单位的甲基化率。在皮肤鳞癌与正常组织比较除了CpG2_8、CpG 2_11、CpG 2_12三个位点之外,检测到其余14位点在皮肤鳞癌的SFRP1基因甲基化率高于正常组。皮肤鳞癌与癌旁组织相比有10个CpG位点(10/17,58.82%)甲基化率,这些位点在皮肤鳞癌甲基化率高于癌旁组织。癌旁组织与正常组织相比,检测出5个CpG位点(5/17,29.41%)癌旁组织的甲基化率高于正常对照组织。SFRP1基因启动子CpG位点甲基化率鳞癌Ⅲ级>Ⅱ级>Ⅰ级。SFRP1基因启动子高甲基化引起基因失活导致其染色质结构异常,使SFRP蛋白表达减少或缺失并对细胞异常增生的抑制能力减弱。同时SFRP通过抑制Wnt信号通路的传导,在细胞凋亡、胚胎发育、提供肿瘤标记物与抗肿瘤中发挥作用,其具体机制尚需进一步研究。
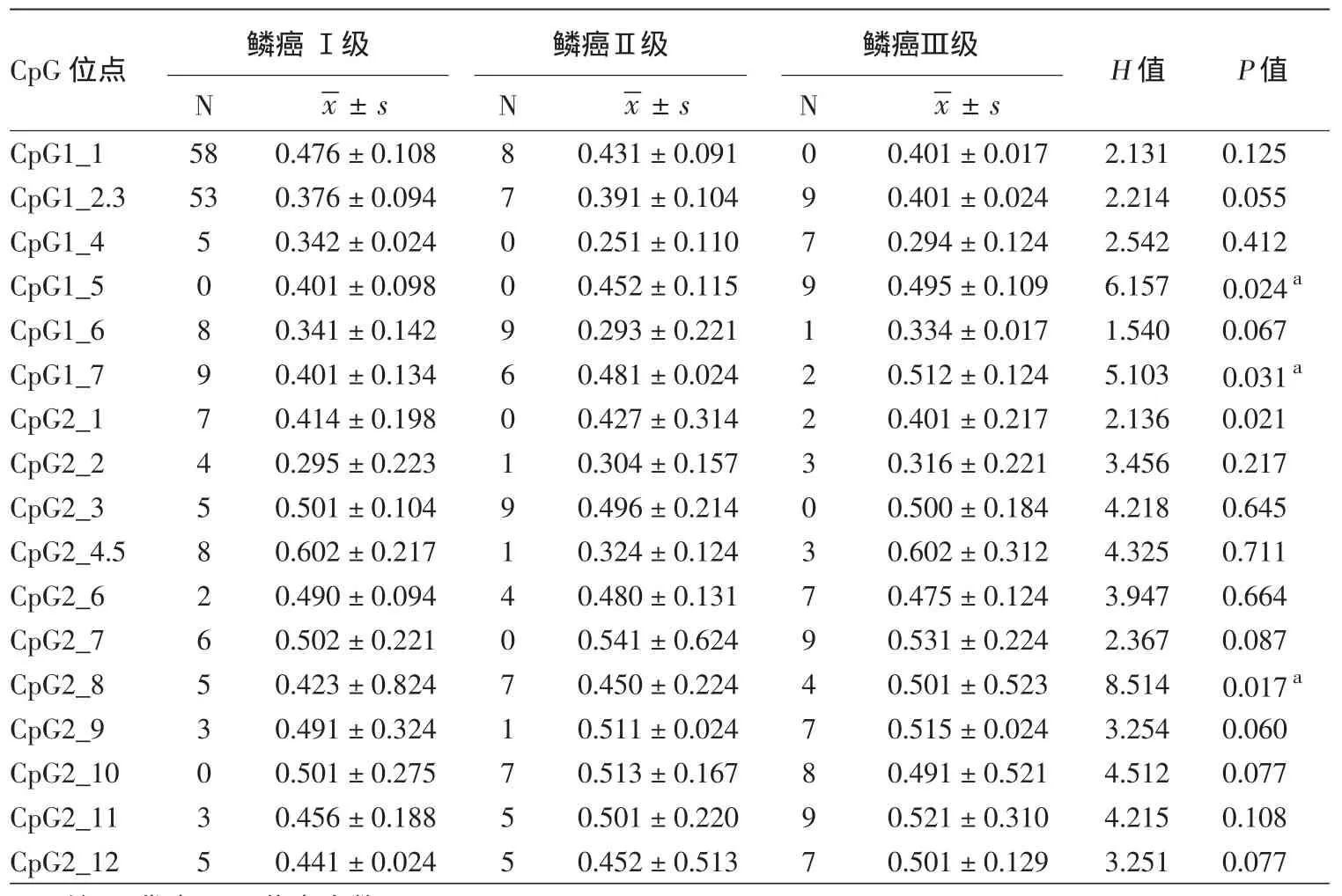
表3 不同皮肤鳞状细胞癌(鳞癌)组织病理级别中SFRP1甲基化状态比较
[1]曹一鑫,冯新,王建力,等.荷人皮肤鳞状细胞癌裸鼠移植瘤模型中干扰血管内皮生长因子的实验研究[J].中华皮肤科杂志,2012,45(8): 569-573.
[2]Psyrri A,Kotoula V, Fountzilas E.Prognostic significance of the Wnt pathway in squamous cell laryngeal cancer[J].Oral Oncol,2014,50(4): 298-305.
[3]赵辨.中国临床皮肤病学[M].江苏:江苏科学技术出版社,2010:1527-1529.
[4]刘曦霖,简强,苗叶,等. Rab23对鳞状细胞癌Sa3细胞增殖的抑制作用及相关机制[J].中华皮肤科杂志,2014,47(7):499-502.
[5]许力凡,张记,田志强.表观遗传学与肿瘤干细胞[J].遗传学报,2013,35(9):1049-1057.
[6]蒋艳玲,赵明,梁功平,等.1,25-二羟维生素D3对HaCaT细胞增殖活性及基因组DNA和增殖相关基因启动子甲基化水平的影响[J].中华皮肤科杂志,2013,46(2):881-886.
[7]EI-Naggar AK,Lai S,Clayman G,et al.Methylation,a major mechanismof p16/CDKN2 gene inactivation in head and neck squamous carcinomav[J].AmJ Pathol,1997,15(1):1767-1774.
[8]Rosas SLB,Koch W,Carvalho MGC,et al.Promoter hypermethylation patterns of p16,O6-methylguanine-DNA-ethyltransferase, and death-associated protein kinase in tumors and saliva of head andNeck cancer patients[J].Cancer,2001,61:939-942.
[9]李聪颖,沈征宇,王蓓青,等.HaCaT细胞ADAR1基因沉默对Wnt11表达和A375细胞酪氨酸酶活性的影响[J].中华皮肤科杂志,2013,46(12):877-880.
[10]Surana R,Sikka S,Cai W,et al.Secreted frizzled related proteins: Implications in cancers[J].Biochim Biophys Acta,2014,1845(1): 53-65.
[11]Shin H,Kim JH,LeeYS,et al.Change in gene expression profiles ofsecreted frizzled-related proteins(SFRPs)by sodium butyrate in gastric cancers:induction of promoter demethylation and histone modification causing inhibition of Wnt signaling[J].Int J Oncol, 2012,40(5):1533-1542.
Methylation of SFRP1 gene promoter in cutaneous squamous cell carcinoma tissue
Liang Junqin*,Yilinuer·Halifu, Zou Yunmin,Luo Dong,Yuan Hu,Pu Xiongming.*Xinjiang Medical University,Urumqi 830002,China
< class="emphasis_italic">Corresponding author:Pu Xiongming,Email:puxiongming@163.com
Pu Xiongming,Email:puxiongming@163.com
ObjectiveTo investigate the relationship between SFRP1 gene and clinicopathologic features of cutaneous squamous cell carcinoma(CSCC),and to explore the possible mechanism of action of SFRP1 in the occurrence and development of CSCC.MethodsCSCC and paracarcinomatous tissue specimens were obtained from 40 patients with CSCC,and normal skin tissue specimens from 40 healthy human controls.The EpiTYPER assay was conducted to evaluate the methylation status of SFRP1 gene promoter in all the specimens with a MassARRAY mass spectrometer.ResultsTotally,the methylation status of 1951(86.52%,1951/2255)CpG motifs were evaluated in 17 CpG loci in 2 fragments of the SFRP1 gene promoter.The methylation rate significantly differed in 10(10/17,58.82%)CpG loci between the CSCC and paracarcinomatous tissue specimens,and in 5(5/17,29.41%)CpG loci between the paracarcinomatous and normal tissue specimens(allP<0.05).Furthermore,significant differences were observed in the methylation rates of three CpG loci(CpG 1_5,CpG 1_7,CpG 2_8)in the SFRP1 gene promoter between tissue specimens from different pathological grades of CSCC(P<0.05),and their methylation rates sequentially decreased from gradeⅢto gradeⅡandⅠ.ConclusionThe frequency of methylation is high in the SFRP1 gene promoter in patients with CSCC,and the SFRP1 gene may participate in the occurrence and development of CSCC.
Carcinoma,squamous cell;DNA methylation;Signal transduction;SFRP1;Gene promoter
10.3760/cma.j.issn.0412-4030.2015.10.014
新疆维吾尔自治区自然科学基金(2015211C911)
830002乌鲁木齐,新疆医科大学(梁俊琴);新疆维吾尔自治区人民医院皮肤性病科(梁俊琴、伊力努尔、邹云敏、罗东、袁虎、普雄明)
普雄明,Email:puxiongming@163.com
2015-06-01)
(本文编辑:吴晓初)
