宽谱中波紫外线对人表皮黑素细胞非经典Wnt通路的作用研究
2015-11-07王辉林彤王千秋
王辉 林彤 王千秋
宽谱中波紫外线对人表皮黑素细胞非经典Wnt通路的作用研究
王辉 林彤 王千秋
目的 探讨宽谱中波紫外线(BB-UVB)照射对黑素细胞增殖率、酪氨酸酶活性、黑素含量的影响。方法 分别用0、10、20、30、40、50、100、200、300 mJ/cm2BB-UVB照射原代培养的黑素细胞,采用CCK8法测定黑素细胞增殖率、多巴比色法测定酪氨酸酶活性、NaOH溶解法测定黑素含量。分别用0、30、50、100 mJ/cm2BB-UVB照射黑素细胞,实时荧光定量PCR检测非经典Wnt通路相关基因mRNA的表达。100 mJ/cm2BB-UVB照射黑素细胞,用Western印迹检测作用前后非经典Wnt通路相关基因蛋白的表达。多组间比较采用单因素方差分析,两组间比较采用独立样本t检验。结果 与对照组相比,10~300 mJ/cm2BB-UVB照射后,细胞增殖率均逐渐降低,BB-UVB剂量>100 mJ/cm2时细胞存活率<50%,同时,10~100 mJ/cm2BB-UVB照射后酪氨酸酶活性逐渐增加,100 mJ/cm2BB-UVB组黑素含量明显增加,差异有统计学意义(均P<0.05)。30、50、100 mJ/cm2BB-UVB照射后,WIF-1 mRNA的表达均较对照组逐渐减少,JNK、MITF、RAC1、TYR的表达均较对照组逐渐升高,而30、50 mJ/cm2BB-UVB组WNT5A mRNA表达量均较对照组降低,100 mJ/cm2BB-UVB组WNT5A mRNA表达量则明显升高(P<0.05)。100 mJ/cm2BB-UVB照射后,WIF-1蛋白的表达量较对照组降低,WNT5A、JNK、MITF、RAC1、TYR蛋白表达较对照组升高(P<0.05)。结论 紫外线照射降低黑素细胞增殖率,提高黑素细胞酪氨酸酶活性和黑素含量。WIF-1基因可能抑制黑素生成。WIF-1基因表达降低可能通过非经典通路Wnt蛋白的综合作用激活JNK/MITF/TYR通路,最终促进黑素合成。
黑素细胞;紫外线;Wnt信号通路;细胞增殖;黑素合成
Wnt信号通路包括经典通路和非经典通路,主要由Wnt配体蛋白、细胞膜上受体、胞质内信号转导和核内转录调控等部分组成,与肿瘤、骨质疏松、衰老、退化障碍等多种疾病有关[1]。经典通路主要通过调节细胞质中β连环蛋白的水平调节黑素细胞黑素合成与树突形成[2]。非经典通路也参与了黑素合成的调节,但其作用的具体调节机制仍不清楚[3]。波长为275~320 nm的中波紫外线是紫外线生物学效应最活跃的部分,促进上皮细胞生长、黑素生成及抑制变态反应,但该作用产生的具体机制亦不清楚。我们用宽谱中波紫外线(BB-UVB)照射黑素细胞,观察黑素细胞增殖、黑素合成变化及非经典Wnt通路中黑素细胞黑素生成相关基因的表达,初步探讨非经典Wnt信号通路相关基因在紫外线诱导的黑素生成中的作用。
资料与方法
一、主要试剂与仪器
Medium254黑素细胞培养基、HMGS添加剂、左旋多巴(L-Dopa)、分离酶(Protease typeⅨ)(美国Sigma公司),完全1640培养基(美国Gibco公司),胰蛋白酶(美国Amresco公司),CCK-8试剂盒、BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),Wnt5A/RAC1小鼠单克隆抗体、WIF-1/MITF/ JNK兔单克隆抗体、TYR兔多克隆抗体(英国Abcam公司),Tripure Isolation Reagent(瑞士Roche公司)。一步法RT-PCR试剂盒(日本TaKaRa公司)。SS-04B型宽谱中波紫外线光疗仪、BB-UVB辐照度监视器(上海希格玛高技术有限公司)。
二、黑素细胞原代培养
取小儿包皮环切术后标本,新鲜培养基浸泡,送至实验室。碘伏浸泡10 min后用生理氯化钠溶液冲洗3次。去除皮下组织,剪成10 mm×20 mm细条,置于0.5%分离酶中4℃过夜或37℃3~4 h。眼科镊轻轻分离表真皮,表皮用生理氯化钠溶液洗2次,置于0.1%胰酶与0.02%EDTA 1∶1混合液中37℃孵育10min,加入完全1640培养基中止消化,200目滤器过滤,收集过滤液置入离心管内300×g离心10 min,弃上清后重悬,以106个/ml细胞种入25 cm2无菌培养瓶内,37℃、5%CO2孵箱内孵育,差速黏附法获取纯化的黑素细胞[4]。每2~3天换液,取第2~5代细胞进行实验。
三、黑素细胞活力测定
采用CCK8法,用胰酶将步骤1中细胞消化下来,96孔板中,每个孔种5 000个细胞。种板第2天去除培养基,用37℃预热的PBS洗1次,分别用10、20、30、40、50、100、200、300 mJ/cm2BB-UVB照射,以未接受BB-UVB照射为对照组。照射光源采用SS-04B型宽谱中波紫外线光疗仪,细胞距紫外光源15 cm,用BB-UVB辐照度监示器标定辐照度,UVB剂量=UVB辐照度[mJ/(cm2·s)]×时间(s)。BB-UVB照射后每个孔加入培养基100 μl,培养48 h后,每个孔加入CCK8溶液10 μl,放入细胞培养箱中培养约2 h后,于酶标仪490 nm波长下测吸光度值。细胞增殖率(%)=[(实验组吸光度值-空白对照组吸光度值)/(对照组吸光度值-空白对照吸光度值)]×100%。
四、多巴比色法检测黑素细胞酪氨酸酶活性、NaOH溶解法测定黑素含量
将细胞接种于6 cm培养皿中,待细胞生长至80%融合时,去除培养基,用已在37℃水浴锅中预热过的PBS洗1次,去除PBS,分别用10、20、30、40、50、100、200、300 mJ/cm2BB-UVB照射,时间分别为7 s、14 s、21 s、28 s、35 s、70 s、140 s、210 s。以未接受BB-UVB照射的细胞为对照组。BB-UVB处理后,加入培养基培养,48 h后用胰酶消化细胞,加入培养基和胰酶后,将细胞均匀转移至微量离心管中,300×g、4℃离心5 min。离心后去除培养基,用PBS洗2次,离心去上清液备用。
将上述细胞加入到200 μl的0.1%Triton-X100中重悬,放在冰上将细胞裂解30 min,将裂解液一分为二,其中一个加入等体积的1 g/L L-Dopa 37℃反应4 h,于酶标仪490 nm波长处测吸光度值;另一部分裂解液,4℃、3 600×g离心10 min,对于上清液采用BCA试剂盒做蛋白定量,而沉淀则用1 mol/L NaOH重悬,50℃反应1 h,于酶标仪490 nm波长处测吸光度值。各实验组及对照组测得吸光度值后分别除以上清液蛋白含量为平均吸光度值。细胞酪氨酸酶活性(或细胞黑素含量)(%)=[(实验组平均吸光度值-空白对照组吸光度)/(对照组平均吸光度值-空白对照组吸光度值)]×100%。
五、实时RT-PCR检测非经典Wnt通路中黑素细胞黑素生成相关基因mRNA的表达
将细胞接种于6 cm培养皿中,待细胞生长至80%融合时,去除培养基,用已在37℃水浴锅中预热过的PBS洗1次,去除PBS,分别用30、50、100mJ/cm2BB-UVB照射,以未接受BB-UVB照射的细胞为对照组。BB-UVB处理后加入培养基培养,48 h后吸去培养基,按照Tripure总RNA提取试剂盒说明书抽提细胞总RNA。分别设计各目的基因的特异性引物,引物序列见表1。按反转录试剂盒说明书合成反转录脱氧核糖核苷酸(cDNA),按qPCR试剂盒说明书扩增目的条带。采用Thermal cycler软件包计算Ct值,分析荧光强度。mRNA相对表达量采用2-△△Ct表示。

表1 实时RT-PCR扩增引物序列
六、Western印迹测定黑素细胞蛋白表达
将细胞接种于6 cm培养皿中,待细胞生长至80%融合时,去除培养基,用已在37℃水浴锅中预热过的PBS洗1次,去除PBS,用100 mJ/cm2BBUVB照射,以未接受BB-UVB照射的细胞为对照组。BB-UVB处理后加入培养基培养,48 h后吸去培养基,按细胞全蛋白提取试剂盒方法提取细胞总蛋白,蛋白样品加热变性后经电泳、转膜、与一抗、二抗孵育,ECL发光法压片显色。采用Quantity One灰度分析软件对所得条带进行灰度分析,根据目的条带与内参条带的比值计算相对灰度值。
七、统计分析
结果
一、不同剂量BB-UVB照射对黑素细胞增殖、酪氨酸酶活性、黑素含量的影响
10、20、30、40、50、100、200、300 mJ/cm2BB-UVB照射原代培养的黑素细胞,培养48 h后进行测定。结果显示,与对照组相比,10~300 mJ/cm2BB-UVB组细胞增殖率均降低,10~100 mJ/cm2BB-UVB组酪氨酸酶活性均增加,100 mJ/cm2BB-UVB组黑素含量明显增加,差异有统计学意义(均P<0.05)。当BB-UVB剂量>100 mJ/cm2时,细胞的增殖率已<50%,培养皿中的黑素细胞大量漂浮、死亡,存活细胞很少,如此时再检测酪氨酸酶活性和黑素含量误差较大,遂未再检测200 mJ/cm2、300 mJ/cm2时酪氨酸酶活性和黑素的生成量。见表2。
表2 不同剂量BB-UVB照射后黑素细胞增殖率、酪氨酸酶活性、黑素含量(±s)
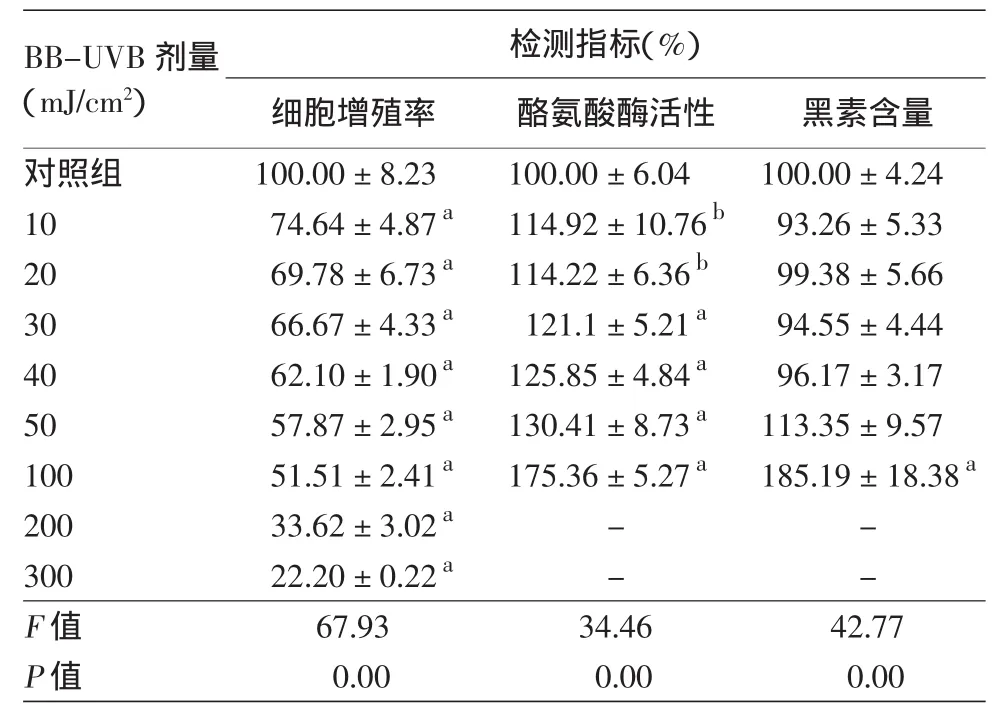
表2 不同剂量BB-UVB照射后黑素细胞增殖率、酪氨酸酶活性、黑素含量(±s)
注:n=3。与对照组比较,a:P<0.05,b:P<0.01
BB-UVB剂量(mJ/cm2)检测指标(%)细胞增殖率 酪氨酸酶活性 黑素含量对照组 100.00±8.23 100.00±6.04 100.00±4.24 10 74.64±4.87a 114.92±10.76b 93.26±5.33 20 69.78±6.73a 114.22±6.36b 99.38±5.66 30 66.67±4.33a 121.1±5.21a 94.55±4.44 40 62.10±1.90a 125.85±4.84a 96.17±3.17 50 57.87±2.95a 130.41±8.73a 113.35±9.57 100 51.51±2.41a 175.36±5.27a 185.19±18.38a 200 33.62±3.02a - -300 22.20±0.22a - -F值 67.93 34.46 42.77 P值 0.00 0.00 0.00
二、不同剂量BB-UVB照射后Wnt非经典通路基因mRNA表达的变化
不同剂量BB-UVB照射后,各组WIF-1、WNT5A、JNK、MITF、RAC1、TYR mRNA表达量差异均有统计学意义(F值分别为 150.44、322.67、130.70、259.57、310.11、40.35,均P<0.01)。两两比较结果显示,30、50、100 mJ/cm2BB-UVB照射后,WIF-1 mRNA表达量均较对照组降低,JNK、MITF、RAC1、TYR mRNA表达量均较对照组升高,差异有统计学意义(均P<0.05)。而30、50 mJ/cm2BB-UVB照射后WNT5A mRNA表达量均较对照组降低,100 mJ/cm2BB-UVB照射后WNT5A mRNA表达量较对照组升高,差异有统计学意义(均P<0.05)。见图1。

图1 不同剂量BB-UVB照射后非经典通路各基因mRNA相对表达量 1A~1F:分别为不同剂量BB-UVB照射后WIF-1、WNT5A、JNK、MITF、RAC1、TYR mRNA相对表达量
三、100 mJ/cm2BB-UVB照射后Wnt非经典通路基因蛋白表达变化
100 mJ/cm2BB-UVB照射黑素细胞后,48 h测定各组基因蛋白水平的表达变化。将对照组蛋白表达量设为1,各基因100 mJ/cm2BB-UVB照射组蛋白表达水平如图2所示。

图2 100 mJ/cm2BB-UVB照射后Wnt非经典通路基因蛋白电泳图

图3 100 mJ/cm2BB-UVB照射前后黑素细胞树突变化(倒置显微镜,×100) 紫外线照射前原代培养的黑素细胞,生长较密集,树突以2~3个为主
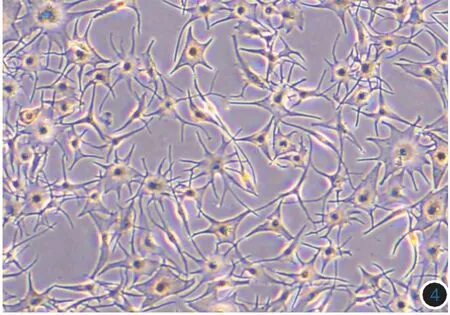
图4 100 mJ/cm2紫外线照射后48 h,黑素细胞数目减少,体积增大,树突明显增多
四、100 mJ/cm2BB-UVB照射后细胞树突变化
如图3所示,紫外线照射前黑素细胞生长较密集,树突以2~3个为主。100mJ/cm2BB-UVB照射后48h黑素细胞数目减少,体积增大,树突明显增多,见图4。
讨论
本研究中黑素细胞经不同剂量BB-UVB照射后,随着照射剂量的升高,细胞增殖率明显降低,可能与黑素细胞在UVB照射后可生成嘧啶二聚体及活性氧类,导致细胞死亡有关。有研究[5]检测1.25、2.5、5、10、25、50、100 mJ/cm2BB-UVB作用后黑素细胞的活力变化发现,小剂量(1.25 mJ/cm2)BB-UVB照射后细胞少量增殖,2.5 mJ/cm2以上BB-UVB照射后细胞活力开始降低,25 mJ/cm2BB-UVB照射后细胞活力为对照组的60%。不同研究所得毒性剂量的不同,可能与细胞活力测定方法不同、原代细胞来源个体差异、紫外线照射方式(UVB照射间隔时间)不同有关。本研究显示,<100 mJ/cm2BB-UVB照射后,细胞存活率在50%以上,100 mJ/cm2BBUVB照射后黑素细胞酪氨酸酶活性增加,黑素细胞黑素含量较对照明显增加,所以我们选用30、50、100 mJ/cm2BB-UVB照射黑素细胞,观察目的基因mRNA的变化,同时选择该范围内酪氨酸酶活性和黑素含量升高最明显的BB-UVB剂量,即采用100 mJ/cm2BB-UVB照射黑素细胞后检测目的基因蛋白含量的变化。
WIF-1属于分泌型卷曲相关蛋白(sFRP)家族,通过直接与Wnt分子结合,抑制Wnt信号的经典和非经典途径。Kim等[6]发现黄褐斑皮损WIF-1的表达明显降低,将WIF-1基因沉默后,酪氨酸酶的表达升高,黑素小体生成增多,推测WIF-1可能抑制了黑素的生成。Park等[7]对黄褐斑患者皮损区基因的表达进行检测,发现皮损区WIF-1的表达升高,WIF-1可能促进黑素合成。本研究用30 mJ/cm2BB-UVB照射后,WIF-1的mRNA表达低于对照组,TYR基因mRNA表达高于对照组,随着紫外线剂量升高,WIF-1的mRNA表达降低,TYR基因mRNA表达逐渐升高。在蛋白水平上,100 mJ/cm2BB-UVB照射后,WIF-1蛋白生成量小于对照组,TYR蛋白的表达高于对照组,所以正常状态下WIF-1基因产物可能通过对经典途径和非经典途径的综合作用对黑素细胞酪氨酸酶基因有抑制作用,进而抑制黑素的生成,紫外线照射后抑制作用降低,黑素合成增多。
WNT5A是非经典通路重要的胞外调控因子。Zhang等[8]研究认为,WNT5A不仅能抑制黑素细胞的增殖,还能通过下调色素形成相关基因的表达减少黑色素的合成,且这种作用是通过调节细胞内JNK的表达实现的。而在Park等[7]的研究中,黄褐斑皮损中WNT5A的表达也是上调的。本研究中30、50 mJ/cm2BB-UVB照射黑素细胞后,WNT5A mRNA表达量低于对照组,而在BB-UVB剂量上升至100 mJ/cm2时,WNT5A的mRNA及蛋白的表达量均明显升高,与下游JNK及MITF、TYR等基因的表达趋势不一致。推测原因可能有以下两点:①WNT5A对下游基因的调控可能以综合作用为主,也就是说该基因对下游基因的调控可能不是单向的,而是通过对下游数个通路如Ca2+通路、JNK通路甚至经典通路的综合作用实现的[9];②JNK的表达也受上游多个非经典通路因子的综合作用。低剂量紫外线照射可能以Wnt非经典通路的其他基因对JNK的调控作用为主,当BB-UVB的剂量增大至100 mJ/cm2时,WNT5A对JNK/MITF/TYR通路发挥促进作用。
Rho家族小GTP酶尤其是RHOA,RAC1和CDC42在黑素细胞细胞骨架和树突形成方面起重要作用[10]。RAC1可以增强c-Jun氨基末端激酶(JNK)的磷酸激酶活性,调节细胞板状伪足的形成,使黑素细胞树突增多[11-12]。本研究结果显示,随紫外线剂量的升高,RAC1基因的mRNA表达增多,100 mJ/cm2BB-UVB照射后蛋白的表达同步升高。在图3中可以看到,100 mJ/cm2BB-UVB照射黑素细胞48 h后,细胞存活量较前减少,但存活细胞的树突明显增多,说明RAC1基因参与了黑素细胞树突形成的调控,RAC1基因的表达增多促进黑素细胞树突增多,因此,在紫外线照射黑素细胞后,黑素细胞黑素生成能力增加的同时黑素小体转运能力甚至黏附功能同步提高。
MITF作为黑素细胞黑素生成最重要的转录因子,一方面可以诱导酪氨酸酶基因家族在黑素细胞中的特异性表达,另一方面参与外界刺激对黑素细胞黑素生成的调控。MITF调控酪氨酸酶相关蛋白家族的表达,而TYR的表达和活性决定着黑素生成的速度和产量,是影响黑素生成最核心的调节酶。本实验中随着BB-UVB剂量的增加,JNK、MITF、TYR的mRNA表达逐渐增多,且Western印迹显示,100mJ/cm2BB-UVB照射后,JNK、MITF、TYR蛋白的表达均高于对照组,提示上游通路的各因子可能通过激活JNK/MITF/TYR通路最终促进酪氨酸酶的表达及黑素生成。
[1]Maruotti N,Corrado A,Neve A,et al.Systemic effects of Wnt signaling[J].J Cell Physiol,2013,228(7):1428-1432.
[2]王辉,王千秋,林彤.Wnt通路及抑制因子对黑素细胞调控作用的研究进展[J].国际皮肤性病学杂志,2015,41(2):125-128.
[3]LimX,NusseR.Wntsignalinginskindevelopment,homeostasis,and disease[J].Cold Spring Harb Perspect Biol,2013,5(2):a008029.
[4]赵志国,丁克云,金城,等.人表皮成黑素细胞培养条件的初步探讨[J].中华皮肤科杂志,2009,42(1):49-51.
[5]Cho TH,Lee JW,Lee MH.Evaluating the cytotoxic doses of narrowband and broadband UVB in human keratinocytes, melanocytes,and fibroblasts[J].Photodermatol Photoimmunol Photomed,2008,24(3):110-114.
[6]Kim JY,Lee TR,Lee AY.Reduced WIF-1 expression stimulates skin hyperpigmentation in patients with melasma[J].J Invest Dermatol,2013,133(1):191-200.
[7]Park TJ,Kim M,Kim H,et al.Wnt inhibitory factor(WIF)-1 promotes melanogenesis in normal human melanocytes[J].Pigment Cell Melanoma Res,2014,27(1):72-81.
[8]Zhang J,Li Y,Wu Y,et al.Wnt5a inhibits the proliferation and melanogenesis of melanocytes[J].Int J Med Sci,2013,10(6): 699-706.
[9]Topol L,Jiang X,Choi H,et al.Wnt-5a inhibits the canonical Wnt pathway by promoting GSK-3-independent beta-catenin degradation[J].J Cell Biol,2003,162(5):899-908.
[10]Jackson TA,Koterwas DM,Morgan MA,et al.Fibroblast growth factors regulate prolactin transcription via an atypical Racdependent signaling pathway[J].Mol Endocrinol,2003,17(10): 1921-1930.
[11]Yamauchi J,Miyamoto Y,Sanbe A,et al.JNK phosphorylation of paxillin,acting through the Rac1 and Cdc42 signaling cascade, mediates neurite extension in N1E-115 cells[J].Exp Cell Res, 2006,312(15):2954-2961.
[12]Sigal YJ,Quintero OA,Cheney RE,et al.Cdc42 and ARP2/3-independent regulation of filopodia by an integral membrane lipidphosphatase-relatedprotein[J].JCellSci,2007,120(Pt2):340-352.
Effects of broadband ultraviolet B on non-canonical Wnt pathways in human epidermal melanocytes
Wang Hui, Lin Tong,Wang Qianqiu.Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
< class="emphasis_italic">Corresponding authors:Lin Tong,Email:ddlin@hotmail.com;Wang Qianqiu,Email:wangqq@ncstdlc.org
s:Lin Tong,Email:ddlin@hotmail.com;Wang Qianqiu,Email:wangqq@ncstdlc.org
ObjectiveTo investigate the effects of broadband ultraviolet B(BB-UVB)on the proliferation of, tyrosinase activity and melanogenesis in melanocytes.MethodsMelanocytes isolated from human foreskin were subjected to primary culture.Some cultured primary melanocytes were irradiated with BB-UVB at 10,20,30,40,50,100, 200 and 300 mJ/cm2.Then,CCK-8 assay was performed to evaluate the proliferative activity of melanocytes,dopa oxidation assay to estimate the activity of tyrosinase,and sodium hydroxide(NaOH)-lysis method was used to determine melanin content.Real-time fluorescence-based quantitative PCR was conducted to measure the mRNA expressions of genes involved in non-canonical Wnt pathways in melanocytes after irradiation with BB-UVB at 30,50 and 100 mJ/cm2. Western blot was carried out to determine the expressions of proteins involved in non-canonical Wnt pathways in melanocytes before and after irradiation with BB-UVB of 100 mJ/cm2.The melanocytes receiving no treatment served as the control group.Statistical analysis was carried out by one-way analysis of variance followed by least significant difference(LSD)-ttest for multiple group comparisons and by the independent samplettest for two-group comparisons.ResultsAfter irradiation with BB-UVB at 10-300 mJ/cm2,the proliferative activity of melanocytes was gradually reduced compared with the control group(allP<0.05),and the survival rate of melanocytes was less than 50%when the irradiation dose of BB-UVB was higher than 100 mJ/cm2.Furthermore,tyrosinase activity gradually increased in melanocytes after irradiation with BB-UVB at 10-100 mJ/cm2compared with the control group,and the increase was statistically significant at the radiation dose of 100 mJ/cm2(P<0.05).Compared with the control group,the WIF-1 mRNA expression level decreased,while c-Jun N-terminal kinase(JNK),microphthalmia-associated transcription factor(MITF),Ras-related C3 botulinum toxin substrate1(RAC1)and tyrosinase(TYR)mRNA expression levels increased in melanocytes after irradiation with BB-UVB at 30,50 and 100 mJ/cm2(allP<0.05);the WNT5A mRNA expression significantly decreased in melanocytes irradiated with 30 and 50 mJ/cm2BB-UVB,but increased in those irradiated with 100 mJ/cm2BB-UVB(allP<0.05).The radiation with 100 mJ/cm2BB-UVB significantly decreased the expression ofWIF-1 protein,but enhanced the expressions of WNT5A,JNK,MITF,RAC1 and TYR proteins in melanocytes compared with the control group(allP<0.05).ConclusionsBB-UVB can decelerate the proliferation of,elevate tyrosinase activity and melanin level in,melanocytes.The WIF-1 gene may inhibit melanogenesis,and the decrease in its expression may promote melanogenesis by activating the JNK/MITF/TYR pathway through the combined effects of proteins involved in non-canonical Wnt pathways.
Melanocytes;Ultraviolet rays;Wnt signaling pathway;Cell proliferation;Melanin synthesis
10.3760/cma.j.issn.0412-4030.2015.10.007
江苏省自然科学基金(BK2012507)
210042南京,中国医学科学院北京协和医学院皮肤病研究所
林彤,Email:ddlin@hotmail.com;王千秋,Email:wangqq@ncstdlc.org
2015-04-27)
(本文编辑:吴晓初)
