太空飞行对大肠杆菌生物学性状影响的研究
2015-11-07张学林刘长庭中国人民解放军总医院南楼呼吸科北京00853中国航天员训练中心医监医保研究室北京00094
张学林,谢 琼,刘长庭*(.中国人民解放军总医院南楼呼吸科,北京00853;.中国航天员训练中心医监医保研究室,北京00094)
太空飞行对大肠杆菌生物学性状影响的研究
张学林1,谢琼2,刘长庭1*
(1.中国人民解放军总医院南楼呼吸科,北京100853;2.中国航天员训练中心医监医保研究室,北京100094)
为探讨空间环境对大肠杆菌生物学性状的影响,通过神舟十号飞船将大肠杆菌送至外太空(太空组),地面设立同步温度对照组,返回后进行菌落计数,观察太空飞行对细菌繁殖的影响;进行亚胺培南敏感性检测,了解耐药性变化;进行生长曲线测定,了解飞行后的生长速率。结果发现太空组细菌量为7.9×1010cfu/mL,对照组为28.5×1010cfu/mL;太空组平均抑菌圈直径为15.57±1.2 mm;对照组为13.4±1.15 mm;两组菌的生长曲线没有明显差异。研究表明大肠杆菌在太空飞行环境中生长受抑制,且对亚胺培南耐药性降低。
大肠杆菌;太空飞行;亚胺培南;耐药;生长
1 引言
随着现代医学的发展、各种有创检查和介入治疗手段的增加,以及抗生素的广泛应用,使得导致临床病原菌的种类及耐药性都在发生变化,以往很少引起感染的条件致病菌(也称机会性致病菌)如大肠埃希氏菌等所致的医院内感染近年来显著增加[1-4]。大肠杆菌所致的感染中以泌尿道感染、呼吸道感染、菌血症等最为常见。近年来,随着抗生素尤其是第三代头孢菌素等抗菌药物的大量使用,大肠杆菌中的产超广谱β-内酰氨酶(extended-spectrumβ-lactamases,ESBLs)菌株日益增多,并且在此基础上还进一步出现了多重耐药(multidrug-resistant,MDR)菌株、广泛耐药(extensively drug-resistant,XDR)菌株和全耐药(pandrug-resistant,PDR)菌株[4-6]。这些产ESBLs的高耐药菌株不仅对青霉素类、头孢菌素类抗生素耐药,而且对氟喹诺酮类、氨基糖苷类、磺胺类抗生素存在严重的交叉耐药。此外,它们还能通过接合等形式在同种或异种细菌间传播耐药基因,从而造成医院严重的交叉感染,给临床感染性疾病的治疗带来极大困难[7-8]。深入探寻这些高度耐药菌株中新的耐药机制,对于临床合理制定针对耐药菌的抗感染治疗方案,以及迅速针对含新耐药基因的可能引起广泛传播的耐药菌株采取防控措施显得尤为重要。
在载人航天活动中,一些正常定植的细菌会随着航天员或航空部件进入太空,并在太空舱内形成微生物群区。据报道[9],自和平号空间站升空15年来,该空间站内生长了234种微生物。一些机会性致病菌,如大肠杆菌曾在航天员身上或空间站中被检出。因此载人航天事业对航天医学与保障提出了重大挑战。同时空间环境具有地面环境中所不存在的一些特殊环境因素,包括微重力、高真空、极度温差、弱磁场和粒子辐射等,这些因素可加速诱导空间环境微生物产生基因突变和调控网络的变化,进而对微生物的生物学性状和功能产生一系列复杂的影响。2006年在亚特兰蒂斯号航天器进行的空间实验发现,用航天器搭载的沙门氏菌感染小鼠,实验组较地面对照组相比,小鼠的死亡时间提前,死亡率增高,半数致死剂量(LD50)降低[10]。经空间飞行后,肺炎克雷伯菌对磺胺类药物的耐药性发生明显改变[11],而空间站来源的金黄色葡萄球菌对苯唑西林、红霉素和氯霉素的最低抑菌浓度有一定的增加[12]。另有研究发现,蜡状芽孢杆菌在碳源利用上发生了明显改变[13]。因此,探索空间环境下微生物变异对于载人航天事业的发展具有重要的意义。
本研究借助神舟十号飞船,将一株从肺部感染老年患者痰标本中分离的大肠杆菌送入太空(飞船的升空时间为2013年6月11日,返回地球时间为2013年6月26日),观察该菌太空飞行前后的耐药性等表型的变化,探索太空环境对大肠杆菌的影响,为人类如何利用太空环境进行感染性疾病的防控研究提供理论基础。
2 材料和方法
2.1菌株与培养
大肠杆菌为肺部感染老年患者痰标本的分离培养菌,并经解放军总医院微生物科采用bioMérieux-Vitek系统鉴定。细菌置于脑心浸液半固体培养基中培养,其配方为脑心浸液肉汤(BHI)+0.6%低熔点琼脂糖(Invitrogen)。细菌分为以下两组:太空组,细菌随神舟十号飞船进入太空飞行15天(样品装载飞船约2天后发射升空),舱内温度为21℃;地面对照组,细菌置于21℃孵箱中静止培养15天。抗生素敏感试验以及生长曲线测定等培养温度为37℃。
2.2抗生素敏感实验
将菌株接种至MH肉汤培养基,37℃,180~200 rpm振荡培养7~8 h后,调整菌悬液浓度至0.5麦氏单位,此时相当于细菌浓度达到108CFU/mL,将菌液用棉签均匀涂布至MH固体平板表面;室温放置3~5min,将药敏纸片贴至平板上,37℃静止培养16 h,游标卡尺量取抑菌环直径大小。
2.3细菌菌落总数检测
菌株从太空返回地面后,立即对实验组和对照组样本进行梯度稀释(101,102,103,104,105,106,107,108,109倍)并涂布平板,培养16 h后,挑取平板菌落数在30~300之间的平板进行平板克隆计数,比较两组菌的菌落数。该实验重复3次。
2.4生长曲线测定
细菌置于含500 mL脑心浸液肉汤的三角烧瓶中,37℃振荡培养,培养0.5 h,1 h,2 h,4 h,6 h,8 h,10 h,12 h,14 h,16 h后,分别取1 m l混悬液用分光光度计(Thermo,USA)测定波长在600 nm处的吸光度值,并以纯脑心浸液肉汤调零,实验重复3次。
2.5统计分析
采用SPSS17.0软件进行数据处理,计量数据以x±s表示,两组独立样本采用t检验,当P<0.05时认为差异具有统计学意义。
3 结果
3.1太空飞行前后大肠杆菌耐药性检测
细菌从患者痰液中分离培养后,首先进行身份鉴定及耐药性检测,药物敏感试验结果按照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准进行判读[14],发现该菌对抗生素亚胺培南耐药,如图1所示。太空组细菌返回地面后,将太空飞行组和地面静止培养组各随机挑取100个克隆,分别进行抗生素敏感试验,测量亚胺培南对大肠杆菌的抑菌圈直径,如表1所示,地面对照组的平均抑菌圈直径为13.4±1.15 mm;太空飞行组的平均抑菌圈直径为15.57±1.2mm,较对照组增加了2.17mm(p<0.05)。说明太空飞行后大肠杆菌对亚胺培南呈现变敏感的趋势。

图1 亚胺培南对分离的大肠杆菌抑菌效果Fig.1 Inhibition zone of Im ipenem in disc diffusion test for Escherichia coli
注:大肠杆菌临床分离纯化后进行药物敏感性试验,亚胺培南的抑菌环直径点13.5 mm;根据2013年CLSI标准,含10 mg亚胺培南的药物制片对大肠杆菌的抑菌圈直径d<19 mm可判定为该菌对亚胺培南耐药。

表1 亚胺培南对地面组和太空组大肠杆菌的抑菌环直径统计结果Table 1 Inhibition diameters of Im ipenem in disc diffusion test for two groups of Escherichia coli
3.2太空飞行后大肠杆菌菌落数降低
为了解太空环境对大肠杆菌生长的影响,在太空组细菌返回地面后,立即进行梯度稀释并平板计数,结果显示该菌地面组的菌落数为(28.5±4.3)×1010cfu/mL;太空组的菌落数为(7.9±2.5)×1010cfu/mL(如图2所示)。太空环境下大肠杆菌的菌落总数为地面组的27.7%。说明太空飞行环境中大肠杆菌生长繁殖变缓慢。
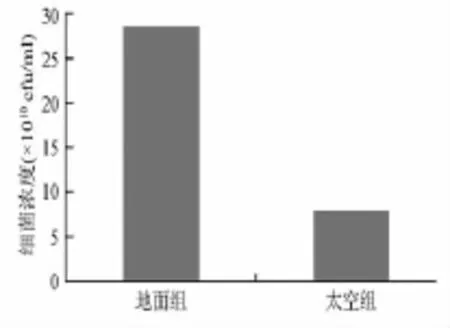
图2 太空飞行后大肠杆菌菌落数和地面对照组的比较Fig.2 Escherichia coli after space flight and that of the ground control
3.3太空飞行前后细菌生长速率比较
为更进一步说明太空因素对大肠杆菌生长的影响,我们将地面组和太空组大肠杆菌取等量样本用于生长曲线测定,在细菌培养0.5 h,1 h,2 h,4 h,6 h,8 h,10 h,12 h,14 h,16 h这10个时间点,对菌悬液进行OD600值检测,并绘制生长曲线,我们发现两组大肠杆菌的生长速率无明显改变(图3)。
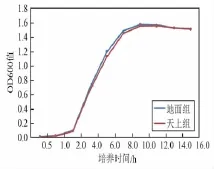
图3 地面组和天上组大肠杆菌生长曲线比较Fig.3 Escherichia coli in space fligh t and ground control groups
4 讨论
太空环境存在着极端的物理条件,通常,这些影响都不利于微生物的生存和生长[15-16]。有研究显示,飞船内的微生物较地面生长缓慢[17]。说明太空环境对细菌的生存和生长是一个严峻的考验。本研究中发现经太空飞行后,大肠杆菌的繁殖量仅为地面的27.7%,考虑是太空环境因素下大肠杆菌产生过多的次级代谢产物抑制细菌生长繁殖。但是两组菌的生长曲线没有明显差异,一方面是由于细菌菌落计数反应的是样本在飞行刚刚结束时的繁殖状态,而生长曲线反应的是大肠杆菌返回后经地面培养的状态,细菌在地面经加入大量培养基培养,太空中所产生的次级代谢产物被稀释,大大减弱了其抑制生长繁殖的作用;另一方面考虑是由于本次飞行任务时间较短,细菌产生的变异遗传稳定性差,以至大肠杆菌脱离太空环境后迅速发生突变回复,也说明了短暂的太空飞行对生命体产生的影响具有可回复性。
当面对恶劣的环境,细菌通过不断改变自身形式来适应环境的变化,在此过程中,细菌的变异过程会加速,变异类型也会更丰富。多项研究表明微重力环境可影响大肠杆菌的耐药性。通过对礼炮7空间站上法国航天员Chrien JL的共生菌丛中分离出的大肠杆菌的研究发现,与地面对照菌相比,空间站来源的大肠杆菌对多粘菌素E和卡那霉素的最低抑菌浓度显著增加(从4 mg/L到>16 mg/L),即该菌的耐药性增加[18]。另有研究发现,从联盟-7号飞船飞行员中分离出的大肠杆菌出现了四环素耐药性[19]。而本研究的结果为大肠杆菌对亚胺培南耐药性降低,与前述报道的太空环境对细菌耐药性的影响并不一致,说明太空环境对细菌产生的耐药性变异具有多样性,并非所有的细菌在微重力条件下对抗生素敏感性的变化都是一致的,如研究发现鲍曼不动杆菌在低剪切力模拟微重力的环境中对多种抗生素的最低抑菌浓度没有明显的升高[20]。
在本研究中,太空飞行后的大肠杆菌对亚胺培南仍处于耐药性状态,但是相对地面培养的大肠杆菌,其对亚胺培南的耐药性具有降低的趋势。通过进一步探索其影响耐药性的机理,有望为解决地面难以控制的感染问题提供理论基础。同时在人体中大肠杆菌主要定植在肠道内,属于肠道微生物的一部分,该菌能产生具有杀菌作用的大肠杆菌素,还能合成维生素B和K,在正常情况下其代谢活动对人体有益。本研究发现在太空环境中大肠杆菌生长繁殖受到抑制,这种改变对人体的影响目前还不清楚,在未来的研究中,探索太空飞行对肠道微生物的影响,以及肠道微生物的变化将如何影响航天员健康将是一个重要的课题。
5 结论
1)太空飞行过程中大肠杆菌生长较地面缓慢,说明太空飞行环境不利于大肠杆菌生长;
2)太空飞行后,大肠杆菌对亚胺培南的耐药性降低。
[1]Sakoulas G,Moellering R C Jr.Increasing antibiotic resistance amongmethicillin-resistant Staphylococcus aureus strains[J].Clin Infect Dis,2008,46(5):S360-367.
[2]Ptout JD.Multidrug resistant enterobacteriaceae:new threat of an old problem[J].Expert Rev Anti Infect Ther,2008,6:657-669.
[3]刘惠容,林定忠.临床标本耐甲氧西林金黄色葡萄球菌分布及药敏分析[J].中国当代医药,2011,18(10):70-71. Huirong Liu,Dingzhong Lin.Clinical samples ofmethicillinresistant Staphylococcus aureus analysis of distribution and drug sensitivity[J].China Modern Medicine,2011,18(10):70-71.(in Chinese)
[4]Li B,YiY,Wang Q,etal.Analysis of drug resistance determinants in Klebsiella pneumoniae isolates from a tertiary-care hospital in Beijing,China[J].PLoS One,2012,7(7):e42280.
[5]Ko K S,Lee M Y,Song JH,et al.Prevalence and characterization of extended-spectrum beta-lactamase-producing Enterobacteriaceae isolated in Korean hospitals[J].Diagn Microbiol Infect Dis,2008,61(4):453-459.
[6]Kohlenberg A,Schwab F,Rüden H.Wide dissemination of extended-spectrum beta-lactamase(ESBL)-producing Escherichia coli and Klebsiella spp.in acute care and rehabilitation hospitals[J].Epidemiol Infect,2012,140(3):528-534.
[7]Nordmann P,Naas T,Poirel L.Global Spread of carbapenemase-producing enterobacteriaceae[J].Emerg Infect Dis,2011,17(10):1791-1798.
[8]Mokracka J,Koczura R,Pawlowski K,etal.Resistance patterns and integron cassette arrays of the Enterobactercloacae complex strains of human origin[J].Med Microbiol,2011,60(Pt 6):737-774.
[9]Novikova ND.Review of the knowledge ofmicrobial contamination of the Russian manned spacecraft.Microb Ecol 2004;47(2):127-132.
[10]Wilson JW,Ott CM,Quick L,et al.Mediaion composition controls regulatory and virulence response of Salmonella in spaceflight.PLoSONE 2008,3(12):e3923.
[11]Guo Y,Li Y,Su L,et al.Comparative genomic analysis of Klebsiella pneumonia(LCT-KP214)and a mutant strain(LCT-KP289)obtained after spaceflight[J].BMCGenomics,2014,15:589.
[12]Tixador R,Richoilley G,Gasset G,et al.Study ofminimal inhibitory concentration of antibiotics on bacteria cultured in vitro in space[J].Aviat Space Environ Med,1985,56(8):748-751.
[13]Longxiang Su,Lisha Zhou,Jinwen Liu,et al.Phenotypic,genomic,transcriptomic and proteomic changes in Bacillus cereus after a short-term space flight[J].Advances in Space Research,2014,53(4):18-29.
[14]邵海枫,赵旺胜.关于临床细菌耐药性检测的几点思考[J].临床检验杂志,2008,26(5):324-326. Haifeng Shao,Wangsheng Zhao.Some thoughts about the clinical detection of bacterial resistance[J].Chinese Journal of Clinical Laboratory Science,2008,26(5):324-326.(in Chinese)
[15]Horneck G,Bucker H,Reitz G.Long-term survival of bacterial spores in space[J].Adv Space Res,1994,14(10):41-45.
[16]Horneck G,Eschweiler U,Reitz G,et al.Biological responses to space:results of theexperiment“Exobiological Unit”of ERA on EURECA I[J].Adv Space Res,1995,16(8):105-118
[17]Lam K S,Gustavson D R,Pirnik D L,et al.The effect of space flight on the production of actinomycin D by Streptomyces plicatus[J].J Ind Microbiol Biotechnol,2002,29(6):299-302.
[18]Tixador R,Richoilley G,Gasset G,et al.Study ofminimal inhibitory concentration of antibiotics on bacteria cultured in vitro in space[J].Aviat Space Environ Med,1985,56(8):748-751.
[19]Taylor G.R..Space microbiology.Annu.Rev.Microbiol,1974,28:121-137.
[20]Hensley D M.Maintenance of antimicrobial susceptibility of acinetobacter baumannii in modeled microgravity[J].Clin Lab Sci,2010,23(2):84-88.工业出版社,2001:195,350,390. Shen Xianyun,Xue Yueying.Aerospace gravitational physiology and Medical[M].Beijing:National Defence Industry Press,2001:195,350,390.(in Chinese)
Effects of Space Flight on Biological Characteristics of Escherichia Coli
ZHANG Xuelin1,XIE Qiong2,LIU Changting1*
(1.Nanlou respiratory disease department,The 301 hospital,Beijing 100853,China;2.Department ofmedicalmonitoring and medical support,China Astronaut Research and Training Center,Beijing 100094,China)
Tomanifest the effect of space flight on biological characteristic in Escherichia coli,the strain was carried to space by Shenzhou-10 spaceship.The colony forming units(CFU)in both the space flight and ground cultured E.coliwere assessed by plate clone count respectively to calculate the survival rate of space flight E.colisample.Antibiotics sensitivity for space flightand ground cultured E.coliwas analyzed to compare the sensitivity to imipenem.Then the growth curves of the two strains weremeasured.The results show that,after space flight,the CFU of E.coliwas 7.9×1010cfu/mL,while itwas28.5×1010cfu/mL in ground cultured E.coli.The average inhibition zone of imipenem for ground cultured E.coliwas13.4±1.15 mm in diameter,while that of the space flight gruop was 15.57±1.2 mm in diameter.However,the growth curves of the two strains had no significant difference.All data revealed that the growth of E.coliwas inhibited in space flightenvironment,and it could become less resistant to imipenem after space flight.
Escherichia coli;space flight;imipenem;resistant;growth
R856
A
1674-5825(2015)02-0200-04
2014-09-23;
2015-03-05
国家重点基础研究发展计划资助(973计划)(2014CB744400);全军医学科研“十二五”课题重点项目(BWS12J046);科技部重大专项项目(空间新药重大创制)(2015ZX09J15102-003);北京市科技新星项目(z121107002512128)
张学林(1982-),男,博士,主治医师,研究方向为细菌耐药及空间微生物学。E-mail:zhangxl20015@163.com
并列第一作者:谢琼(1971-),女,博士,研究员,研究方向为航天实施医学。E-mail:xieqio@sina.com
刘长庭(1954-),男,硕士,教授,研究方向为空间生命科学。E-mail:changtingliu@sohu.com
