短期低压低氧下莴苣的气体交换、超微结构和抗逆特性
2015-11-07唐永康郭双生中国航天员科研训练中心人因工程重点实验室北京100094
唐永康,高 峰,郭双生(中国航天员科研训练中心人因工程重点实验室,北京100094)
短期低压低氧下莴苣的气体交换、超微结构和抗逆特性
唐永康,高峰*,郭双生
(中国航天员科研训练中心人因工程重点实验室,北京100094)
为探索低压低氧环境中培养植物的可行性,研究了短期低压和低氧对莴苣气体交换、叶片超微结构和抗逆特性的影响。将莴苣植株(25天株龄)在两种总压(101 kPa和30 kPa)和三种氧分压(21 kPa、6 kPa和2 kPa)条件下进行了1小时和24小时平衡处理。发现短期低压和低氧均未影响莴苣植株生物量、根冠比、含水量和大部分矿质养分含量;短期低氧(6 kPa或2 kPa)提高莴苣叶片光合速率,增加可溶性糖和丙二醛的含量,但降低暗呼吸速率,并且2 kPa氧分压导致线粒体变形和蒸腾速率下降;短期低压处理(30 kPa)增加暗呼吸速率和蒸腾速率,减少可溶性糖和丙二醛的含量。研究表明,莴苣可以在短期低压低氧环境中生长,但短期低氧(6 kPa或2 kPa)造成莴苣逆境胁迫,而低压(30 kPa)能够提高其抗逆性。
低压低氧;莴苣;气体交换;超微结构;抗逆
1 引言
在低压环境中培养植物可降低建设空间受控生态生命保障系统(controlled ecological life support system,CELSS)的成本,减少气体的泄漏和消耗[1-3]。植物虽然能够忍受较宽浓度范围的必需气体(如O2和CO2)[3],但面临新的低压大气环境条件,植物的生长特性可能会发生相应的改变和一定程度上的适应。叶片是植物进化过程中对环境变化较敏感且可塑性较大的器官,其结构特征最能体现环境因子的影响或植物对环境的适应[4]。
总压下降时,气体的扩散系数增加[5],CO2和水汽的运动速率加快,导致莴苣叶片净光合速率增加25%[6],菠菜叶片的蒸腾速率显著增加[7]。Gohil等[8]发现,萝卜的蒸腾速率则随CO2分压的增加而减少。但拟南芥叶片蒸腾速率增加却与CO2分压无关。当CO2饱和时,低压对拟南芥的净光合速率没有影响,CO2缺乏时,净光合速率则随总压和氧分压下降而增加[9]。低压环境中,O2分压降低则抑制了光合呼吸酶的活性,小麦的光合速率增加达14.6%[10],而O2分压不变,总压改变时莴苣的光合速率并未发生显著改变[3]。在缺氧条件时,细胞的代谢和功能受到抑制[11],植物叶片的气体交换也会受到明显抑制[12]。
如上所述,低压低氧环境中植物气体交换受多种环境因素的影响。Corey等[6]认为低压会促进植物叶片的光合作用和蒸腾作用,而Iwabuchi和Kurata[13]则认为低压下植物叶片的光合和蒸腾速率并没有明显变化。Richards等[9]报道拟南芥暗呼吸速率随总压下降而增加,而He等[3]的研究结果则相反。出现上述矛盾的原因在于不同的研究报道的植物种类和环境条件不同所致。因此,本研究的目的是通过精确控制低压低氧环境条件,研究植物在短期低压低氧环境中的气体交换、叶片超微结构和抗逆特性,探索低压低氧环境中培养植物的可行性。
2 材料与方法
2.1试验设计
采用莴苣(Lactuca sativa L.cv.Rome)作为试验材料,在低压植物栽培装置中开展低压低氧试验研究。该装置能精确测量和控制密闭环境中大气温度、湿度、总压、氧分压和二氧化碳分压,主要用于开展不同总压、氧分压和二氧化碳分压条件下的植物培养试验,101 kPa≥总压≥10 kPa,培养面积约0.4 m2。该装置的具体技术参数见Tang等[14]。
试验设两个总压(pt)梯度(101 kPa、30 kPa)和三个氧分压[p(O2)]梯度(21 kPa、6 kPa、2 kPa),共计6个处理(101/21,101/6,101/2,30/21,30/6和30/2),每个处理重复4次。其它大气环境参数均一致:二氧化碳分压p(CO2)为0.05±0.005 kPa,大气温度为24±0.5℃,大气相对湿度为60±5%,循环风速0.8 m·s-1,光照强度325μmol·m-2·s-1(灯正下方10 cm处测量),光周期24小时(光)。
2.2试验方法
2.2.1植物培养
在培养箱中的多孔陶瓷颗粒中萌发并培养莴苣(24℃,60%RH),三叶期时(播种后第15天)转移至低压植物培养装置中,采用改良型Hoagland营养液在常压常氧条件下培养。每个培养盒体积7 L,种植18株生长一致的莴苣幼苗(9孔,每孔2株),每个低压舱放置7个培养盒。每3天更换1次营养液,并通过气泵为每个培养盒通入装置内部空气。试验期间采用高锰酸钾连续吸收植物产生的乙烯气体。
2.2.2气体交换试验
待莴苣幼苗在常压常氧环境中培养10天后(播种第25天),开始短期低压低氧气体交换试验。
1)在两舱相同位置的4个培养盒的同一位置各选取2穴植株,放置在盛有等量营养液、大小一致并包裹黑色塑料布的三角瓶中,称量初始重量后放入舱内继续培养,以便测量植株蒸腾速率。
2)关闭舱门,根据不同处理调节装置内的总压和氧分压。平衡1小时后,开始测量不同处理植株群体净光合速率。当舱内二氧化碳分压超过传感器测量下限时测量结束(从0.105 kPa开始二氧化碳吸收)。关闭培养灯30分钟后开始进行暗呼吸测试。试验期间数据每10秒自动记录。
3)平衡1小时处理测量结束后,开始测量平衡24小时平衡后的光合速率、蒸腾速率和暗呼吸速率,方法同上。以上测量结束后,用高纯氮气恢复舱内为常压环境条件,打开舱门,采集样品并进行相关分析测试,称量用于蒸腾测试的植株最终重量。
4)待莴苣植株在常压常氧条件下平衡生长24小时之后,进行第二次两种平衡时间条件下(1小时和24小时)的光合速率、蒸腾速率和暗呼吸速率测试。
2.2.3测试指标及方法
1)净光合速率和暗呼吸速率:根据密闭空间二氧化碳的净吸收速率或释放速率来分别计算[8,15];
2)蒸腾速率:主要通过称重法计算一定时间内不同处理下植株的水分损失速率;
3)叶肉细胞超微结构:取莴苣中部完全展开叶片,通过固定、脱水、包埋、切片和染色等过程后,在透射电子显微镜(型号JEM-1230,JEOL Co.,日本)下进行观察和照相[16];
4)叶绿素含量:取植株叶片用液氮冷冻,经过48小时冷干,用丙酮浸提,采用分光光度比色法测定[17];
5)丙二醛(MDA)含量:取植株叶片用石英砂和三氯乙酸研磨、定容、离心,取上清液与硫代巴比妥酸反应后测定样品在450、532、600 nm波长下的吸光度[17];
6)营养元素含量:包括N、P、K、Ca、Mg、Fe和Zn[18]。
2.3统计分析
本试验中每个处理中的群体净光合速率和暗呼吸速率分别测量2次(n=2),其它测试项目均设4个重复(n=4)。所有数据均进行方差分析,并采用SAS 9.2(SAS Inc.,Cary,NC)统计软件对不同处理的平均值进行多重比较(LSD,P= 0.05),以P<0.05和P<0.01作为统计学显著和极显著意义。
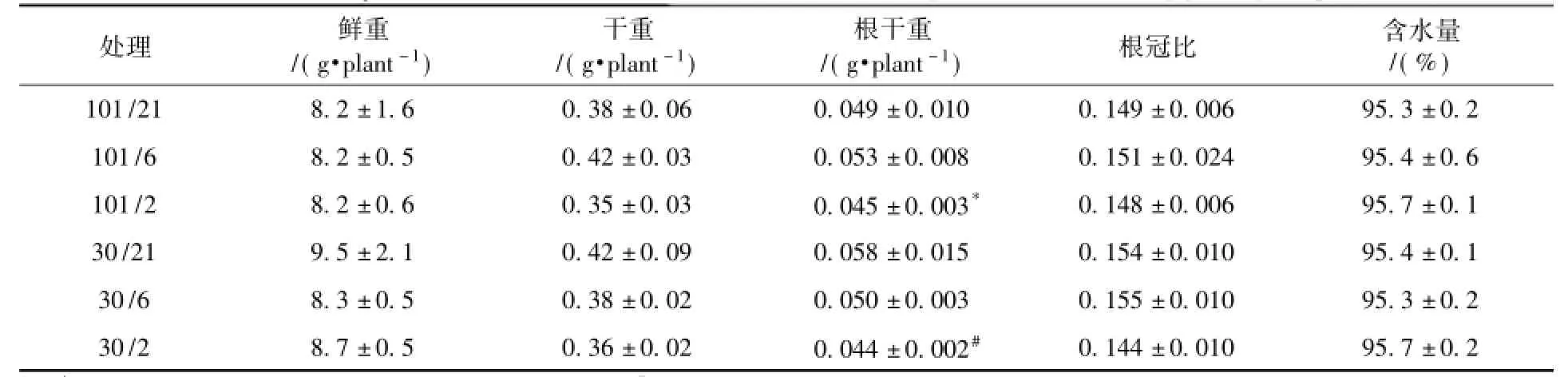
表1 短期低压环境条件下莴苣植株的生物量、根冠比及含水量(n=4)Table1 Biomass yield,root/shoot ratio and RWC of lettuce plants at different ptand p(O2)(n=4)
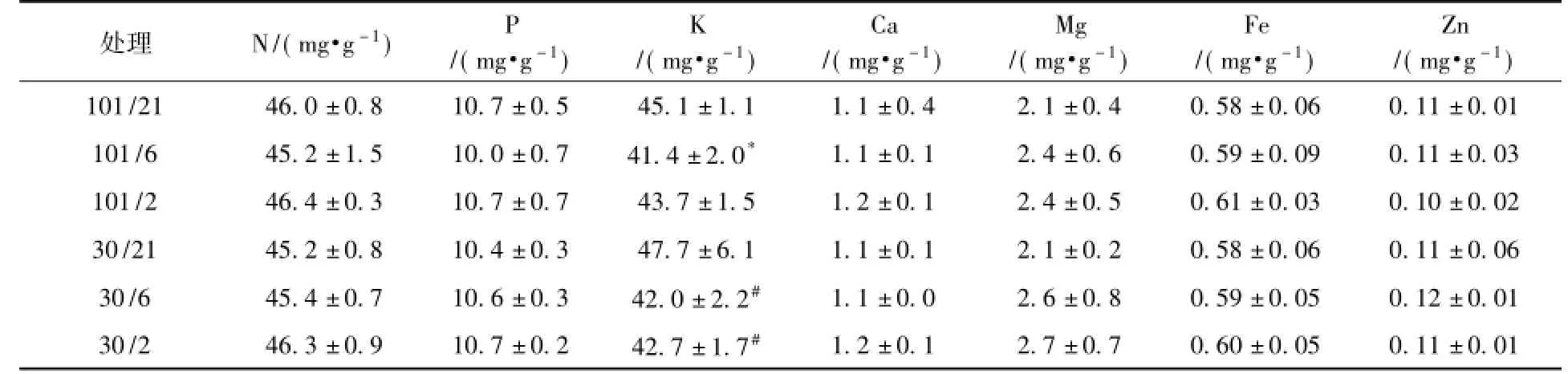
表2 短期低压环境条件下莴苣植株的矿质养分含量(n=4)Table 2 M ineral concentration of lettuce p lants at different ptand p(O2)(n=4)
3 结果与分析
3.1植株生长
经过24小时的低压低氧气体交换测量后,不同处理下莴苣植株生长差异不显著,无明显萎蔫或生长受到抑制的现象。低氧条件下(6 kPa或2 kPa),两种总压环境(101 kPa和30 kPa)中的莴苣根系干重略有下降(表1)。统计结果表明,24 h处理后,两种总压和三种氧分压对莴苣植株的总鲜重、总干重、根冠比和含水量均无显著性影响。在所测的7种矿质养分的含量中,除莴苣植株中K含量(表2)随氧分压下降而降低外,而其余6种矿质养分含量均不受两种总压和三种氧分压变化的影响。这表明短期低压低氧处理不影响莴苣植株大部分矿质养分的含量。
3.2气体交换
当平衡时间为1 h时(图1 a),在0.105 kPa~0.07 kPa二氧化碳分压范围内,不同处理间平均净光合速率差异不显著;在0.07 kPa~0.02 kPa二氧化碳分压范围内,净光合速率随氧分压下降(6 kPa或2 kPa)而增加,但相同氧分压时总压降低对净光合速率的影响不显著;在0.02 kPa二氧化碳分压以下,不同处理间的光合速率变化差异逐渐减少。当平衡时间为24 h时(图1 b),不同处理的净光合速率变化曲线与平衡时间为1 h时的曲线相似,但不同处理间的差异进一步减小。以上结果表明,低氧促进莴苣植株光合作用,但随着处理时间增加,其作用程度减弱,而总压降低并不影响莴苣的净光合速率。
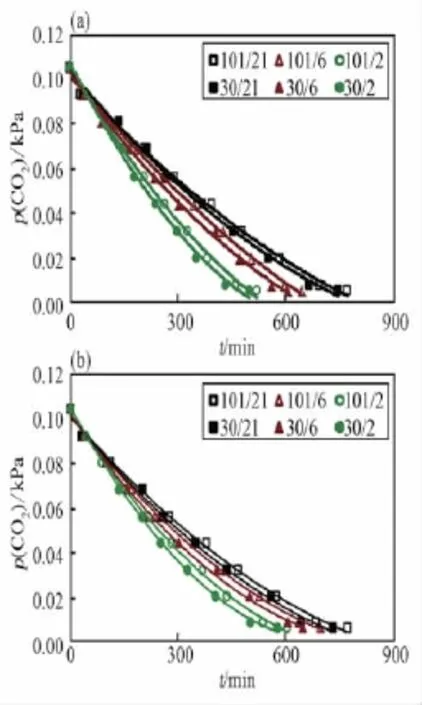
图1 低压植物培养装置内莴苣植株的二氧化碳吸收曲线Fig.1 CO2drawdown curves of lettuce p lants grown in the LPPCF
暗呼吸测量是从二氧化碳分压0.02 kPa开始到0.07 kPa结束。当平衡时间为1 h时(图2 a),在相同总压条件下(101 kPa或30 kPa),氧分压降低到6 kPa时,莴苣的暗呼吸速率有所下降,在2 kPa氧分压时差异扩大,这主要是由于氧分压过低抑制植物呼吸所致。在相同氧分压条件下(21 kPa、6 kPa或2 kPa),30 kPa总压增加了莴苣植株的暗呼吸速率。当平衡时间为24 h时(图2 b),莴苣植株的暗呼吸速率随总压和氧分压的变化趋势与平衡时间为1 h相比没有显著差异。
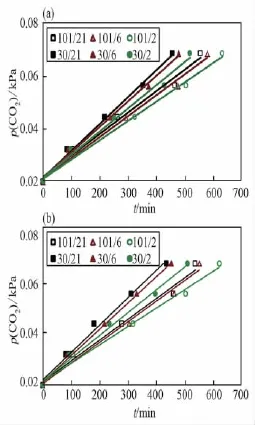
图2 低压植物培养装置内莴苣植株的暗呼吸Fig.2 Dark respiration of lettuce p lants grown in the LPPCF
常压环境下(101 kPa),当氧分压降低到6 kPa时,蒸腾速率无显著改变(图3),但与21 kPa氧分压相比,2 kPa氧分压却显著降低了蒸腾速率达27.0%。低压环境中(30 kPa),21 kPa、6 kPa和2 kPa氧分压下的蒸腾速率较常压(101 kPa)同一条件下分别显著增加47.0%、44.6%和27.0%。因此,总压下降显著提高莴苣的蒸腾速率,而过低氧分压(2 kPa)也显著降低莴苣的蒸腾速率。
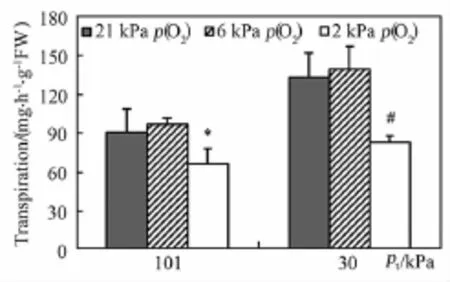
图3 不同总压和氧分压下莴苣的蒸腾速率(n=4)Fig.3 Transp iration of lettuce p lants under short-term hypobaric and hypoxic conditions
3.3超微结构
常压条件下,当氧分压从21 kPa降低到6 kPa或2 kPa时(图4 b,c),叶绿体超微结构完整,类囊体膜数量稳定,基粒片层堆叠清晰,叶绿体基质中无明显的淀粉粒沉积。但随氧分压下降,线粒体变形,呈条状。在低压环境中(30 kPa),与常压条件下(图4 a)相似,21 kPa氧分压下叶绿体超微结构完整(图4 d),叶绿体基粒片层清晰。随氧分压下降,叶绿体超微结构并没有发生显著改变(图4 e),但线粒体变形(图4 f)。以上结果表明,短期低压(30 kPa)并未对叶绿体和线粒体超微结构产生显著影响,但短期低氧(2 kPa)导致线粒体外形发生改变。
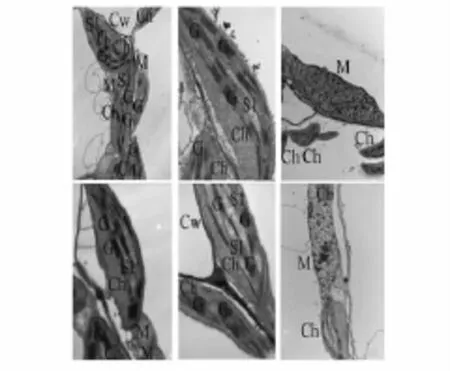
图4 短期低压环境下莴苣植株叶肉细胞超微结构Fig.4 Mesophyll ultrastructure of lettuce leaves undershort-term hypobaric and hypoxic conditions
3.4抗逆特性
总压降低和氧分压下降对莴苣植株叶绿素a和b的含量以及类胡萝卜素的含量均无显著性影响(表3)。低氧(6 kPa或2 kPa)却显著降低了两种总压条件下莴苣叶片中叶绿素a/b值(P<0.0001),而30 kPa低压并无显著性影响。莴苣叶片中可溶性糖和丙二醛的含量同样随着氧分压下降而显著增加,而相同氧分压下,低压(30 kPa)却显著降低叶片中可溶性糖和丙二醛含量(P<0.05和P<0.0001)。以上结果表明,短期低氧导致莴苣植株出现低氧胁迫,可溶性糖和丙二醛含量显著增加,而低压一定程度上缓解了低氧对植物的伤害。
4 讨论
4.1短期低压低氧对莴苣生长的影响
Richards等[9]认为,短期低压(24 h,10 kPa~75 kPa)不会对拟南芥的生长造成可见的胁迫反应。本研究表明,24小时低压低氧处理并未导致莴苣植株的生物量、根冠比、含水量和大部分矿质养分含量发生改变(表1、2)。但从叶片的结构和生理特性可以看出(表3),莴苣植株其实已经遭受了低氧逆境胁迫,包括线粒体变形、可溶性糖和丙二醛含量增加等。随着低压低氧处理时间延长,低氧逆境胁迫对莴苣植株生长的抑制作用会更加明显。
另外,低氧提高了莴苣的净光合速率(见3.2),这并不能推导出低氧促进莴苣的生长。实际上,各处理间莴苣的生物量和养分含量却并无显著性差异(表1、2)。这主要是因为低压低氧处理时间较短,短期的莴苣叶片气体交换增加或结构改变(线粒体变形)并不能迅速促进或抑制莴苣生长。即使在无低氧胁迫的低压环境中(如21 kPa>p(O2)>12 kPa),虽然植株的光合速率增加,碳的固定增加,但短期低压对植物的影响并不会给植物带来长期效应,还会因适应低压环境带来相应的负担,最终导致长期低压对植物的生长并没有显著差异[13,19]。
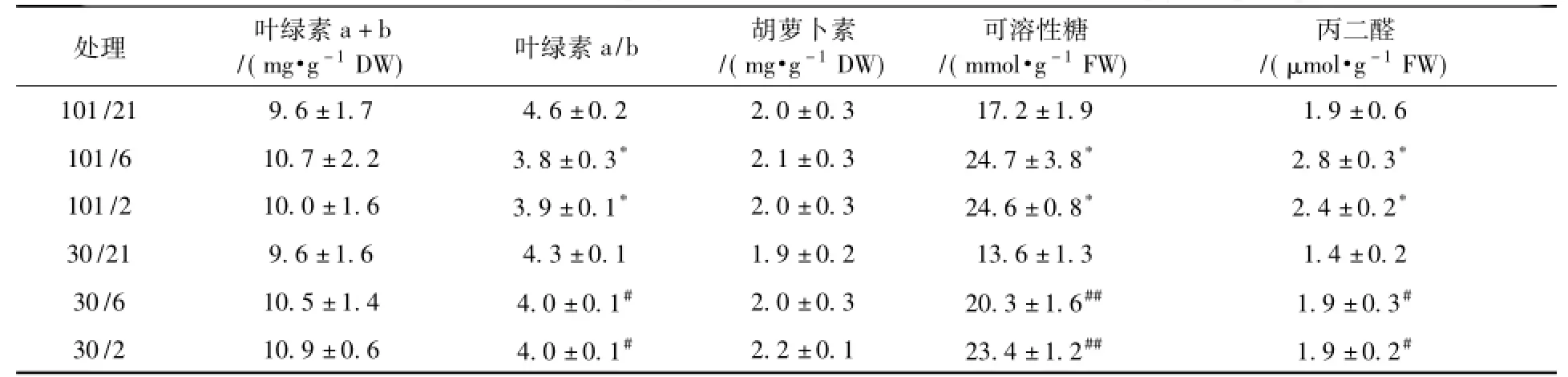
表3 短期低压环境条件下莴苣植株的色素和丙二醛含量(n=4)Table 3 The concentration of chlorophyll,carotenoid and MDA at different ptand p(O2)(n=4)
4.2短期低压低氧对莴苣气体交换的影响
拟南芥光合速率随总压降低(10~101 kPa)而显著增加[9]。本研究则表明,氧分压降低明显提高了莴苣的光合速率,但总压降低(30 kPa)却没有显著的作用(图1)。主要原因是总压降低导致氧分压下降,引起Rubisco(核酮糖-1,5-二磷酸羧化酶/加氧酶)的平衡偏向羧化方向,同时也打破了植物的呼吸代谢平衡,降低了植物的光呼吸,从而增加了植物的净光合速率[6,19,20]。因此,氧分压是影响低压环境中莴苣光合速率的主要因素[3]。
本文中二氧化碳分压和处理时间对莴苣光合速率的影响与Richards等[9]的研究结果相似,即二氧化碳缺乏时(<0.07 kPa),低氧显著影响叶片光合速率,而二氧化碳饱和时(>0.07 kPa)的影响则较小。Corey等[6]认为,低二氧化碳分压条件下(如41 Pa),低氧对光呼吸的抑制作用强于高二氧化碳分压(如81 kPa),并且随处理时间增加,氧分压降低的作用差异逐渐减小。
低压(30 kPa)增加了相同氧分压下莴苣的暗呼吸速率,这与低压提高气体的扩散速率相关,如萝卜[8]和拟南芥[9]的暗呼吸速率同样随总压下降而增加。但也有研究表明,莴苣的暗呼吸速率随总压下降而降低[3,6],如拟南芥和萝卜试验处理时间均为短期(≤7 d),而莴苣处理达30 d,本研究处理时间则为1 h和24 h。
植物的蒸腾速率随总压下降呈线性增加[21],如菠菜叶片在10 kPa短期处理下,平均蒸腾速率是常压的3倍[22],本文图3的结果也说明了这一点。Richards等[9]认为,拟南芥在低压环境中的蒸腾速率增加与CO2是否缺乏和低压处理时间长短无关,而萝卜的蒸腾速率则随CO2分压(0.04~0.18 kPa)的增加而减少,与总压无关[8]。这种差异主要与不同植物种类对环境的适应性有关,如菠菜叶片在长期低压环境中气孔长度和宽度均显著减少,其蒸腾速率在低压下无显著性变化[13]。此外,低氧(2 kPa)却显著降低了莴苣植株的蒸腾速率(图3),低氧抑制莴苣根系生长,限制了根系统对水分的吸收是造成其蒸腾速率下降的主要原因。
4.3短期低压低氧对超微结构和生理特性的影响
植物叶片对环境变化较敏感,其结构特征是环境因子的体现或植物对环境的适应[4]。本文中,24小时低压处理后,虽然低压低氧均没有显著改变叶绿体超微结构,但低氧(2 kPa)却改变了莴苣叶肉细胞中线粒体超微结构(图4 c)。这可能是由于低氧胁迫使呼吸代谢受到抑制所致。在长期低氧环境中(25 d,p(O2)=2.5 kPa),拟南芥叶肉细胞中的线粒体甚至变形为长条状[23]。而总压降低(30 kPa)却没有改变线粒体的超微结构(图4 f)。
低氧(6 kPa或2 kPa)显著增加叶片中可溶性糖和丙二醛的含量(表3)。低氧胁迫下,光呼吸受到抑制,碳水化合物的运输和利用受阻,从而导致可溶性糖增加,如拟南芥叶片中的可溶性糖在2.5 kPa氧分压下同样显著增加[24]。另外,30 kPa低压减少相同氧分压(6 kPa或2 kPa)下莴苣叶片中可溶性糖和丙二醛的含量,即低压一定程度上缓解了莴苣所遭受的低氧逆境。主要原因在于莴苣植株在低压环境中获得了更多的氧气,从而减轻了低氧胁迫的伤害。
5 结论
短期低压和低氧不影响莴苣植株生长和大部分矿质养分含量。短期低氧(6 kPa或2 kPa)促进莴苣的光合作用,增加可溶性糖和丙二醛的含量,但降低暗呼吸速率,改变线粒体形状,降低蒸腾速率。短期低压(30 kPa)不影响叶片光合速率、叶绿体超微结构和光合色素含量,但增加暗呼吸速率和蒸腾速率,减少可溶性糖和丙二醛的含量。
因此,莴苣可以在短期低压低氧环境中生长,但长期生长时,需要提高氧分压(>6 kPa)防止低氧逆境胁迫。30 kPa低压环境有利于提高莴苣植株的低氧逆境胁迫抵抗力。以上研究结论为将来在空间低压环境中培养植物提供了很好的借鉴作用。
[1]Nangalia V,Habershon J.System benefit of a hypobarichypoxicspacecraft environment[C]//International Conferenceon Environmental Systems(ICES)Technical PaperSeries,Warrendale:Society of Automotive Engineering(SAE)International,2004:2004-01-2483.
[2]Paul AL,Ferl RJ.The biology of low atmosphericpressure-implications for exploration mission design andadvanced life support[J].Gravitational and Space BiologyBulletin,2006,19(2):3-18.
[3]He CJ,Davies Jr FT,Lacey RE.Separating the effects of hypobaria and hypoxia on lettuce:growth and gas exchange[J]. Physiologia Plantarum,2007,131(2):226-240.
[4]李芳兰,包维楷.植物叶片形态解剖结构对环境变化的响应与适应[J].植物学通报,2005,22(B08):118-127. Li FL,Bao WK.Responses of themorphological and anatomical structure ofthep lant leaf to environmental change[J].Chinese Bulletin of Botany,2005,22(B08):118-127.(in Chinese)
[5]JostW.Diffusion in Solids,Liquids,Gases[M].Academic Press,New York,1960:18-25.
[6]Corey KA,Bates ME,Admas SL.Carbon dioxide exchange of lettuce plants under hypobaric condition[J].Advances in Space Research,1996,18(1):265-272.
[7]Chamberlain CAP,Graham GT,Dixon MA.Analysis ofplant water relations under variable pressures:technicalchallenge[C]//International Conference on EnvironmentalSystems(ICES)Technical Paper Series,Warrendale:Society of Automotive Engineering(SAE)International,2002:2002-01-2382.
[8]Gohil HL,Bucklin RA,Correll MJ.The effects of CO2on growth and transpiration of radish(Raphanussativus)in hypobaria[J].Advances in Space Research,2010,45(7):823-831.
[9]Richards JT,Corey KA,Paul AL,et al.Exposure of Arabidopsis thaliana to hypobaric environments:implications for low-pressure bioregenerative life support system for human exploration missions and terraforming on Mars[J].Astrobiology,2006,6(6),851-866.
[10]Corey KA,Barta DJ,Wheeler RM.Toward Martian agriculture:responses of plants to hypobaria[J].Life Support and Biosphere Science,2002,8(2),103-114.
[11]汪天,王素平,郭世荣,等.植物低氧胁迫伤害与适应机理的研究进展[J].西北植物学报,2006,26(4):847-853. Wang T,Wang SP,Guo SR,et al.Research advances about hypoxia-stress damage and hypoxia-stress-adaptingmechanism in p lants[J].Acta Botanica Boreali Occidentalia Sinica,2006,26(4):847-853.(in Chinese)
[12]Geigenberger P.Response of plantmetabolism to too little oxygen[J].Current Opinion in Plant Biology,2003,6(3):247-256.
[13]Iwabuchi K,Kurata K.Short-term and long-term effects of low total pressure on gas exchange rates of spinach[J].Advances in Space Research,2003,1(31):241-244.
[14]Tang YK,Guo SS,Dong WP,et al.Effects of long-term low atmospheric pressure on gas exchange and growth of lettuce[J].Advances in Space Research,2010,46(6):751-760.
[15]He CJ,Davies FT Jr,Lacey RE.Hypobaricconditions affectgas exchange,ethylene evolution and growth of lettuce for advanced life support systems(ALS)[J].Habitation,2006,11(1):49-61.
[16]王雪英,赵琦,焦雨歆.4种北极被子植物叶片显微结构和超微结构研究[J].西北植物学报,2008,28(10):1989-1996. Wang XY,Zhao Q,Jiao YX.Microstructure and ultrastructure of four arctic angiosperm plant leaves[J].Acta Botanica Boreali Occidentalia Sinica,2008,28(10):1989-1996.(in Chinese)
[17]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:72-75. Zou Qi.The experimental guide for Plant Physiology[M]. Beijing:China Agriculture Press,2000:72-75.(in Chinese)
[18]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2008:257-279. Bao SD.Analysisof Soil Agri-Chemistry[M].Beijing:China Agricultrural Press,2008:257-279.(in Chinese)
[19]Goto E,AraiY,Omasa K.Growth and developmentof higher plants under hypobaric conditions[C]//International Conference on Environmental Systems(ICES)Technical Paper Series.Warrendale:Society of Automotive Engineering(SAE)International,2002:2002-01-2439.
[20]Fukazawa T,Tochihara Y,Tamura T.Water vapour permeability resistance of micro porousmembranes under hypobaric conditons at a constant temperature[C]//Proceedings of the Textile Institute 83rd World Conference(83rd TIWC),Shanghai,2004.
[21]许大全.光合作用学[M].北京:科学出版社,2013:244-245. Xu DQ.Photosyntheology[M].Beijing:Science Press,2013:244-245.(in Chinese)
[22]Chamberlain CAP.The water status of sweet pepper in response to reduced atmosphere pressures[D].Guelph:University of Guelph,2004.
[23]Ramonell KM,Kuang A,Porterfield DM,et al.Influence of atmospheric oxygen on leaf structure and starch deposition in Arabidopsis thaliana[J].Plant,Cell&Environment,2001,24(4):419-428.
[24]Porterfiled DM,CrispiML,Musgrave ME.Changes in solube sugar,starch and alcolhol dehydrogenase in Arabikopsisthalinana exposed to N2 diluted atmospheres[J].Plant and Cell Physiology,1997,38(12):1354-1358.
The Gas Exchange,Ultrastructure and Stress Resistance of Lettuce Plants under Short-Term Hypobaric and Hypoxic Conditions
TANG Yongkang,GAO Feng*,GUO Shuangsheng
(National Key Laboratory of Human Factors Engineering,China Astronaut Research and Training Center,Beijing 100094,China)
To investigate the possibility of plants cultivation at hypobaria and hypoxia,the gas exchange,ultrastructure and stress resistance of lettucewere conducted under short-term hypobaric and hypoxic conditions.The gas exchange and growth of 25-day old lettuce(Lactuca sativa L.var.Rome)seedlingswere tested after 1-h or 24-h equilibration under two levels of total atmospheric pressure(101kPa and 30kPa)and three levels of oxygen partial pressure(21 kPa,6 kPa and 2 kPa).The results showed that the biomass,ratio of root/shoot,water contentandmineral contentsof lettuce plantswere notaffected by the changes of total atmospheric pressure and oxygen partial pressure;Under the same total pressure conditions(101 kPa or30 kPa),hypoxia(6 kPa or2 kPa)resulted in the increases ofphotosynthesis rate,soluble sugar and malondialdehyde and the reduction of dark respiration of lettuce leaves.The change ofmitochondrion ultrastructure and the decrease of transpiration were found at2 kPa oxygen partial pressure;Under the same oxygen partial pressure conditions,photosynthesis rate,the chloroplast ultrastructure,the contents of chlorophyll and carotenoid of lettuce leaves were not affected by short-term hypobaric treatment(30 kPa),but the rates of dark respiration and transpiration increased and the contents of soluble sugarandmalondialdehyde in lettuce leavesdecreased.Lettuce can grow under short-term hypobaric and hypoxic conditions.Short-term hypoxia(6 kPa or 2 kPa)resulted in hypoxic stress and hypobaria(30 kPa)enhanced the stress resistance of lettuce.
hypobariac and hypoxia;lettuce;gas exchange;ultrastructure;stress resistance
V419+.9
A
1674-5825(2015)02-0193-07
2014-10-13;
2015-02-18
中国航天医学工程预先研究项目(2012SY54A0304)
唐永康(1974-),男,博士,助理研究员,研究方向为长期载人航天环控生保技术。E-mail:yktang@126.com
高峰(1969-),男,硕士研究生,研究员,研究方向为环境控制与生命保障。E-mail:gf117@sina.com
