BPI-BD3融合抗菌肽修饰C3H10T1/2细胞对小鼠感染创面愈合的影响
2015-11-05张欣然刘翠钱智勇徐红梅郭希民郭红延
张欣然,刘翠,钱智勇,徐红梅,郭希民,郭红延
创伤、烧伤等常导致组织细胞坏死,皮肤的防御功能遭到破坏,创面感染是其最常见的并发症及导致愈合延迟的主要原因[1]。金黄色葡萄球菌是创面感染最常见的病原体,可分泌大量蛋白酶和毒力因子,溶解中性粒细胞,使创面愈合延迟[2]。已有大量研究表明,间充质干细胞可以通过趋化、分化参与创伤组织的修复[3-4]。人β防御素3(human beta defensins 3,hBD3)与杀菌性/通透性增加蛋白(bactericidal/permeability increasing protein,BPI)均为内源性抗菌肽,对革兰阳性菌、革兰阴性菌、真菌均有较强的杀伤作用[5-6]。前期研究结果表明,基因重组的rhBD3-BPI融合蛋白具有强烈的抗菌作用和内毒素中和活性[7]。本研究利用重组腺病毒载体pAdxsi-BPI-BD3转染鼠胚胎间充质干细胞C3H10T1/2,使其能够分泌具有活性的内源性抗菌肽BPI-BD3,并在动物模型中进行验证,以期为大面积创伤、烧伤后感染的防治提供一种新的途径和方法。
1 材料与方法
1.1 实验动物、菌株和主要试剂 KM小鼠30只,雌雄各半,体重30±3g(由军事医学科学院实验动物中心提供)。重组腺病毒载体pAdxsi-BPI-BD3、金黄色葡萄球菌(ATCC 25923)、C3H10T1/2细胞(由军事医学科学院基础医学研究所全军干细胞重点实验室保存);胎牛血清(FBS)、α-MEM培养基、胰酶(美国Gibco公司);预染蛋白分子质量标准品、BCA蛋白定量Kit(Thermo公司,美国);兔抗人BPI、兔抗人hBD3(美国Santa Cruz公司);β-actin(美国Cell Signaling Technology公司);辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);ECL发光试剂盒、蛋白浓缩试剂盒(北京普利莱试剂公司);创面塑料圈自行制备;血常规分析仪(日本Sysmex公司)荧光倒置显微镜、普通光学显微镜(日本Olympus公司);切片机(德国Leica公司)。
1.2 重组腺病毒pAdxsi-BPI-BD3转染C3H10T1/2细胞的初步研究
1.2.1 C3H10T1/2细胞的转染 于转染前1d将C3H10T1/2细胞按5×105个接种于75cm2培养瓶,当细胞长至50%~60%融合时,以pAdxsi-BPI-BD3转染C3H10T1/2细胞,并以未转染的C3H10T1/2为对照,37℃、5%的CO2培养箱中培养6h后更换含10%FBS的α-MEM,置于37℃、5%CO2培养箱中培养72h。
1.2.2 RT-PCR法检测重组腺病毒转染C3H10T1/2细胞后的表达 转染72h后,弃上清收集细胞,Trizol法提取总RNA,反转录为cDNA,以BPIBD3为目的基因,进行PCR反应。参照文献[5]设计BPI-BD3引物,BPI-BD3上游引物为:5'-GCAAATGGCATTCTGACATCC-3';下游引物P5:5'-GACTGGTTCCAATTGACAAGC-3',扩增产物为750bp。PCR反应条件:94℃预变性5min;94℃ 20s、51℃ 20s、72℃ 20s,35个循环。PCR反应产物行1.5%琼脂糖凝胶电泳,凝胶成像系统观察并拍照。
1.2.3 Western blotting法检测重组质粒转染C3H10T1/2细胞后的表达 转染72h后收集细胞培养上清。按蛋白浓缩试剂盒说明对细胞上清蛋白进行浓缩,BCA法测蛋白浓度,变性后行SDSPAGE电泳,半干转法转膜,加入5%脱脂奶粉室温封闭2h后,分别滴加BD3、BPI兔抗人多克隆抗体(1:200),并以β-actin(1:1000)为对照,4℃封闭过夜,TBST洗膜,再以辣根过氧化酶标记的二抗封闭2h;ECL发光试剂盒显色,扫描分析实验结果。
1.3 感染创面模型制备及指标观察
1.3.1 感染模型制备及分组 参照文献[8]制备金黄色葡萄球菌感染模型,小鼠背部备皮,打孔器在其背部制作一直径1cm的圆形皮肤全层缺损创面,以3-0线间断缝合塑料圈于创缘外4~5mm处深部肌肉,取对数生长期的金黄色葡萄球菌菌液0.1ml(1×109cfu/ml)均匀涂抹于整个创面,无菌纱布及绷带包扎。30只KM小鼠随机均分为3组:T组注射pAdxsi-BPI-BD3转染的C3H10T1/2细胞;C组注射正常的C3H10T1/2细胞;N组注射等量PBS。接受细胞注射的小鼠于创伤后4h内在无菌条件下通过尾静脉注射细胞,浓度5×106个/ml,注射量200μl。
1.3.2 一般情况观察 术后动物分笼饲养,每周更换2次纱布,观察其活动、进食、创面大小、感染程度和有无化脓等。
1.3.3 痂下菌量测量 伤后3、7d,无菌条件下取痂下组织100mg后置玻璃匀浆器中研磨,加入无菌PBS后混匀,取10μl用PBS行10倍倍比稀释后,取10μl分别涂布于LB琼脂培养基中,于37℃孵育过夜后,选取目的菌进行细菌计数。该小鼠每克组织的菌落数(个/g)=计数菌落数×稀释倍数×1000。
1.3.4 创面愈合速度 以创面残留百分比进行计算。分别于致伤后0、3、7、10、14d对创面进行照相,并将图片输入计算机,运用Image J图像分析软件测量创面面积,计算残留面积百分比(残留面积百分比=残留面积/原始面积×100%),并进行统计学分析。痂皮脱落和上皮完全形成时,视为伤口愈合。尽管毛发未长好时,也视其残余面积为零。
1.3.5 常规HE染色观察 于创伤后3、7、14d,每组分别取创缘与正常交界处组织,用4%多聚甲醛固定,随后用石蜡将创面组织标本包埋、切片,片厚4μm。常规HE染色,光镜下观察创面皮肤动态愈合、毛囊再生、炎性浸润情况。
1.4 统计学处理 采用SPSS 17.0统计软件分析进行分析。计量资料以s表示,多组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 重组腺病毒pAdxsi-BPI-BD3转染C3H10T1/2细胞后的初步鉴定 RT-PCR结果表明,pAdxsi-BPIBD3转染后72h,获得与目的基因BPI-BD3长度一致的产物,大小750bp,而未转染pAdxsi-BPI-BD3的细胞,其BPI-BD3表达为阴性(图1A)。Western blotting检测结果显示,BPI-BD3融合蛋白在C3H10T1/2细胞中成功表达(图1B)。

图1 C3H10T1/2细胞BPI-BD3表达检测Fig.1 Expression of BPI-BD3 in C3H10T1/2 cells
2.2 整体情况观察 致伤后3d,注射PBS组(N组)、正常C3H10T1/2组(C组)和转染腺病毒组(T组)创面残留面积大体观察没有明显变化,创缘红肿,伴有渗出,创面呈感染征象;N组、C组有明显的痂下脓肿,T组感染较轻。7d后,T组创缘红肿基本消退,残留面积明显缩小,感染程度减轻;N组、C组仍可见红肿,并有液体渗出。14d后,T组创面基本愈合,尽管毛发未长好,一旦结痂脱落,上皮形成,就视为伤口愈合;而N组、C组仍有明显的创面,但C组创面残留面积小于N组(图2)。
2.3 痂下细菌计数 伤后3、7d时,无菌条件下取痂下组织100mg,稀释后进行细菌培养,菌落计数后显示,3d时,T组痂下菌量明显低于N组、C组(P<0.05),7d时,各组菌量均下降,但T组菌量仍明显低于N组、C组(P<0.05,图3)。
2.4 创面愈合速度 通过比较各组不同时点残留面积百分比来分析各组创面愈合速度,结果显示,伤后3d,N组、C组和T组创面残留面积差异无统计学意义(P>0.05),7、14d后,T组残留面积百分比明显小于N组、C组(P<0.05,图4)。

图2 感染后各组创面大体情况Fig.2 Representative pictures of wound healing after infection
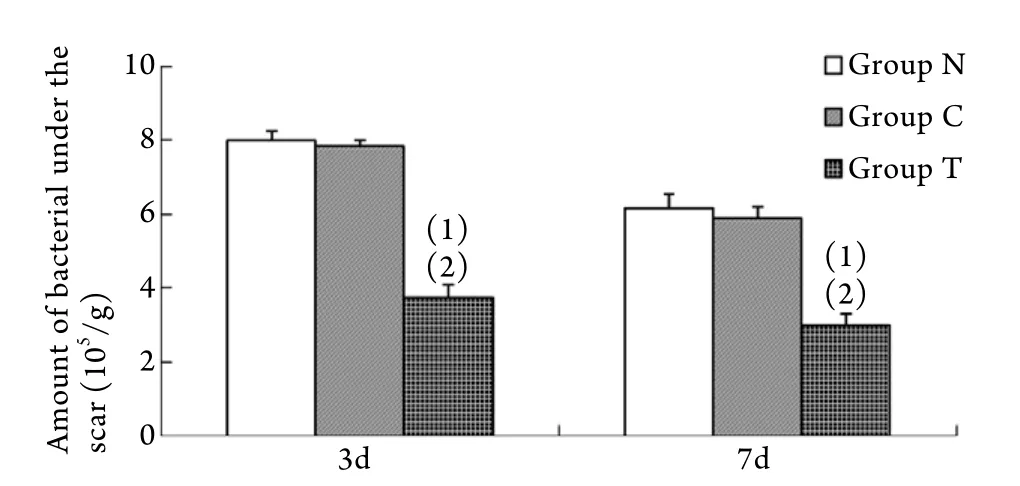
图3 各组伤后不同时间点痂下细菌计数的比较Fig.3 Comparison of bacterial count under the scar at different time point of each group

图4 各组伤后不同时间点残留面积百分比比较Fig.4 Comparison of percentage of residual wound area at different time point of each group
2.5 皮肤创面组织的病理学观察 感染7d后,N组与C组表面仍可见由细胞碎片、渗出物和细菌等构成的坏死层,坏死层下有大量炎细胞浸润,液体渗出,而T组炎症较轻,且创缘开始有新生表皮向创面移行生长。感染14d后,T组新生上皮进一步增多,创面完全被新生的上皮组织覆盖并有再生的皮肤附件产生,C组上皮基本覆盖创面,但无皮肤附件产生,N组上皮仍未连续,修复情况明显较其余两组差(图5)。

图5 创缘组织切片观察(HE ×100)Fig.5 Histopathological examination of wound area (HE×100)
3 讨 论
大面积皮肤创伤或烧伤等会引起局部皮肤全层损伤,并常伴有感染,导致创面愈合延迟。感染可造成修复细胞的数量及功能均显著下降,这是阻碍创面愈合的主要原因[9]。研究表明,每克组织中,任何种类微生物≥106时,与愈合受损密切相关[10]。传统的抗感染方法分为局部应用化学消毒剂[11]及全身应用抗生素,效果均不理想。局部化学消毒剂的有效浓度难以保持,抗生素的应用所面临的问题更为严峻。近年来,细菌耐药性菌株不断出现,使得传统抗生素治疗面临严峻的挑战。在寻找新的抗感染策略过程中,内源性抗生物多肽家族引起了各国学者的极大兴趣,其独特的抗菌机制提示其作为新型抗菌药物应用于临床将发挥重要的作用[12]。
hBD3作为一种内源性抗菌肽,在人体皮肤、黏膜中广泛存在。当这些部位受到炎症刺激时,hBD3被大量诱导表达并释放,从而发挥抗感染作用[13]。我们根据hBD3分子量较小,抗革兰阳性菌较强的特点,将hBD3与另一种同样具有抗菌作用的蛋白BPI融合表达。BPI是目前发现的唯一的既能非特异性杀伤革兰阴性菌,又能中和内毒素,同时具有免疫调节作用的抗菌物质[14]。因此我们将BPI较强的抗革兰阴性菌性能与hBD3较强的抗革兰阳性菌性能相结合,使表达产物具有更广泛的抗菌谱和更强的抗菌活性。正常人体中BPI以及hBD3含量较少,通过分离提纯获得生物活性较高的抗菌肽有一定的技术难度,同时化学合成成本高,使用剂量大,费用昂贵。因此,我们设想可利用转基因等细胞修饰和改造技术,寻找一种即能高表达BPI-BD3融合蛋白,又能促进创面愈合的细胞载体,赋予其新的特性并加以利用。
已有大量研究表明,间充质干细胞是良好的种子细胞,能够移行到创伤或炎症部位,向成纤维细胞、肌肉和神经细胞等分化,参与受损组织的再生与重建,分泌有关的细胞因子和生长因子,参与创面愈合[15]。C3H10T1/2作为胚胎间充质干细胞系,可分化为骨、软骨、脂肪等细胞,在剪切力作用下可分化为内皮细胞[16],并且能够迁移至创伤或炎症部位,分泌各种生长因子,促进受损细胞的恢复,发挥免疫调节与抗炎作用[17],是一种良好的修复细胞和(或)外源基因的表达载体。因此,本研究通过BPI-BD3腺病毒表达载体,将BPI-BD3转染至C3H10T1/2细胞中,使其高表达BPI-BD3并用于感染创面,发挥BPI-BD3强大的抗菌效应以及C3H10T1/2的修复作用,以更好地促进创面愈合。
本实验中,我们使用重组腺病毒pAdxsi-BPIBD3转染C3H10T1/2细胞后,RT-PCR可见有750bp的特异片段,表明腺病毒转染细胞C3H10T1/2后,有外源性BPI-BD3的表达。Western blotting结果显示,重组腺病毒载体转染细胞后,BPI-BD3可以分泌蛋白的形式在细胞培养上清中表达,说明腺病毒载体pAdxsi-BPI-BD3转染C3H10T1/2细胞可有效表达目的基因。我们期望重组腺病毒载体修饰的C3H10T1/2细胞应用到动物感染创面时,可持续分泌BPI-BD3,促进肉芽组织形成,提高机体免疫能力,很好地发挥抗菌及促愈效果。
此外,我们进一步制作了小鼠全层皮肤缺损模型,并于伤后即刻在创面上滴加金黄色葡萄球菌液,制成创伤感染模型。将转染BPI-BD3重组腺病毒载体的C3H10T1/2(T组)通过尾静脉注射入小鼠体内,结果显示,T组3、7d痂下菌量明显少于C组、N组,可能与BPI及hBD3调节机体免疫,提高机体防御能力,在创面局部起到杀菌作用有关。3d时,T组和C组创面及残留面积无明显差异,N组可见创面感染现象,各组创面残留面积无明显差异;7、14d时,T组感染较另两组明显较轻,残留面积也明显减少。HE染色同样显示,7d时T组创面就有一薄层上皮覆盖,14d时,创面完全被上皮覆盖并有皮肤附件再生。我们推测BPI-BD3修饰的C3H10T1/2促进创面愈合的机制可能为:①C3H10T1/2具有趋化作用,可趋化至创面,并分化为皮肤组织的各种细胞如成纤维细胞、角质形成细胞和内皮细胞等,参与创面修复[18];②hBD3与BPI强大的抗菌作用,降低了创面的感染程度,促进伤口愈合;③BPI是唯一可中和内毒素,与细菌脂多糖结合的蛋白,在感染性疾病中有重要的临床意义;④BPI-BD3不受盐浓度的影响,使其在微环境改变的情况下仍能保持其抗菌活性;⑤防御素hBD3在参与创面愈合过程中,能促进表皮细胞的增殖,诱导血管内皮生长因子等的表达,促进血管生成[19]。
BPI-BD3修饰的C3H10T1/2细胞促进创面愈合的机制可能是多方面的,本课题组下一阶段将在体内示踪和分化等方面进一步深入研究,并阐明BPIBD3在创缘表面表达量与细胞注射剂量的相关性,从而为大面积创伤、烧伤后感染的预防及治疗提供新的途径和方法。
[1]Qie WB, Zhou HY, Wen JL, et al. Effects of stress on wound healing and its possible mechanism[J]. Med J Chin PLA, 2014,39(7): 586-589. [郄文斌, 周红艳, 温君琳, 等. 应激对创面愈合的影响及可能机制[J]. 解放军医学杂志, 2014, 39(7): 586-589.]
[2]Glik J, Kawecki M, Gaździk T, et al. The impact of the types of microorganisms isolated from blood and wounds on the results of treatment in burn patients with sepsis[J]. Pol Przegl Chir,2012, 84(1): 6-16.
[3]Hocking AM, Gibran NS. Mesenchymal stem cells: paracrine signaling and differentiation during cutaneous wound repair[J].Exp Cell Res, 2010, 316(14): 2213-2219.
[4]Shi M, Liu ZW, Zhang Z, et al. Progress and challenge in the treatment of end-stage liver disease with stem cells[J]. Med J Chin PLA, 2013, 38(8): 685-692. [施明, 刘振文, 张政, 等. 干细胞治疗终末期肝病的进展与挑战[J]. 解放军医学杂志,2013, 38(8): 685-692.]
[5]Kiatsurayanon C, Niyonsaba F, Smithrithee R, et al. Host defense(Antimicrobial) peptide, human beta-defesin-3, improves the function of the epituelial tight-junction barrier in human keratinocytes[J]. J Invest Dermatol, 2014, 134(8): 2163-2173.
[6]Domingues MM, Silva PM, Franquelim HG, et al. Antimicrobial protein rBPI21-induced surface changes on Gram-negative and Gram-positive bacteria[J]. Nanomedicine, 2014, 10(3): 543-551.
[7]Tuo XY, Chai JK, Jiang W, et al. Fusion expression of human β-defensin3 and bactericidal/permeability increasing protein in P. pastoris[J]. J Fourth Mil Med Univ, 2007, 28(7): 648-650. [庹晓晔,柴家科,蒋伟, 等. 人β-防御素3融合细菌膜穿透增加蛋白在毕赤酵母中的表达[J]. 第四军医大学学报, 2007,28(7): 648-650.]
[8]Freitas Dda S, Spencer PJ, Vassão RC, et al. Biochemical and biopharmaceutical properties of PEGylated uricase[J]. Int J Pharm, 2010, 387(1-2): 215-222.
[9]Guo S, Dipietro A. Factors affecting wound healing[J]. J Dent Res, 2010, 89(3): 219-229.
[10]Gurevich I. Efficacy of chemical sterilants/disinfectants: is there a light at the end of the tunnel[J]? Infect Control Hosp Epidemiol, 1993, 14(5): 276-278.
[11]Yeung AT, Gellatly SL, Hancock RE. Multifunctional cationic host defence peptides and their clinical applications[J]. Cell Mol Life Sci, 2011, 68(13): 2161-2176.
[12]Kiatsurayanon C, Niyonsaba F, Smithrithee R, et al. Host defense(Antimicrobial) peptide, human beta-defesin-3, improves the function of the epituelial tight-junction barrier in human keratinocytes[J]. J Invest Dermatol, 2014, 134(8): 2163-2173.
[13]Wong KF, Luk JM. Endotoxin-neutralizing peptides as Gramnegative sepsis therapeutics[J]. Protein Pept Lett, 2009, 16(5):539-542.
[14]Palmer CD, Guinan EC, Levy O. Deficient expression of bactericidal/permeability-increasing protein in immunocompromised hosts: translational potential of replacement therapy[J]. Biochem Soc Trans, 2011, 39(4): 994-999.
[15]Xia Z, Zhang C, Zeng Y, et al. Transplantaion of BMSCs expressing hVEGF165/ hBD3 promotes wound healing in rats with combined radiation-wound injury[J]. Int Wound J, 2014,11(3): 293-303.
[16]Wang H, Riha GM, Yan S, et al. Shear stress induces endothelial differentiation from a murine embryonic mesenchymal progenitor cell line[J]. Arterioscler Thromb Vasc Biol, 2005,25(9): 1817-1823.
[17]Kol A, Foutouhi S, Walker NJ, et al. Gastrointestinal microbes interact with canine adipose-derived mesenchymal stem cells in vitro and enhance immunomodulatory functions[J]. Stem Cells Dev, 2014, 23(16): 1831-1843.
[18]St Clair DK, Oberley TD, Muse KE, et al. Expression of manganese superoxide dismutase promotes cellular differentiation[J]. Free Radic Biol Med, 1994, 16(2): 275-282.
[19]Lande R, Chamilos G, Ganguly D, et al. Cationic antimicrobial peptides in psoriatic skin cooperate to break innate tolerance to self-DNA[J]. Eur J Immunol, 2015, 45(1): 203-213.
