藏药螃蟹甲苯乙醇苷对急性高原肺水肿大鼠的保护作用
2015-11-05栾飞李茂星周保柱曹馨元赵一王先敏
栾飞,李茂星,周保柱,曹馨元,赵一,王先敏
随着青藏铁路的通车、国家西部大开发战略的实施以及国防建设的需要,越来越多的人员进入高原地区。但是高原低压低氧特殊环境导致的急性高原病严重威胁进入高原人群的身体健康,其中约5%可出现高原肺水肿(high altitude pulmonary edema,HAPE),如抢救不及时常危及生命[1]。近年来关于HAPE的研究表明,氧化应激、炎症反应在高原病的发病中发挥了重要作用[2-4]。
藏药螃蟹甲来源于唇形科糙苏属多年生草本植物螃蟹甲(Phlomis younghusbandii Mukerjee)的干燥块根,藏语称“露木尔”,为藏医习用药材,至今已有千余年的使用历史。螃蟹甲生长于青藏高原东缘海拔3100~4800m的干燥山坡、草甸和河滩草地。本课题组前期研究表明,螃蟹甲中含有大量的苯乙醇苷类成分(phenylethanoid glycosides,PhGCs)[5-6],主要包含毛蕊花糖苷和松果菊苷,广泛用于治疗感冒、咳嗽、疮疥肿毒、风湿性关节炎、肺炎、支气管炎等疾病,具有良好的抗炎镇痛活性[7-8]。相关药理研究表明,毛蕊花糖苷与抗高原病有效成分红景天苷具有相似的药理作用,具有抗氧化、抗炎、抗缺氧、免疫调节、心肌保护、恢复毛细血管通透性以及改善记忆力等多种生物功效[9-11]。然而,螃蟹甲PhGCs成分用于预防和治疗HAPE的相关药理作用及机制目前未见报道,本研究模拟高原低压低氧环境,建立实验性HAPE大鼠模型,观察螃蟹甲PhGCs对其是否具有保护作用及潜在机制。
1 材料与方法
1.1 实验动物 雄性Wistar大鼠70只,SPF级,体重180~220g,购于兰州军区兰州总医院动物实验科,实验动物生产许可证号SCXX(军)2012-0020,实验动物使用许可证号SYXK(军)2012-0029,饲养于兰州军区兰州总医院动物实验科,期间以标准饲料喂养,动物自由摄食进水,室温19~24℃。
1.2 药材与试剂 藏药螃蟹甲药材购买于成都荷花池药材市场,经兰州大学药学院马志刚教授鉴定为唇形科糙苏属多年生草本植物螃蟹甲Phlomis Younghusbandii Mukerjee的干燥块根;地塞米松片(浙江仙琚制药股份有限公司, 批号:140208);灭菌注射用水(四川科伦药业股份有限公司,批号:M14110923);Pierce BCA蛋白定量试剂盒(Thermo Scientific,批号:NC13227CH);白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、酶联免疫吸附(enzyme-linked immuno-sorbent assay,ELISA)测定试剂盒为R&D公司产品;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号:20141225)、丙二醛(malondialdehyde,MDA)试剂盒(批号:20141226)、微量还原型谷胱甘肽(reduced glutathione,GSH)试剂盒(批号:20141222)均购自南京建成生物工程研究所;10×PBS磷酸盐缓冲液(批号:20140807)、4%多聚甲醛(批号:20140416)购自北京索莱宝科技有限公司。其他试剂均为国产分析纯。
1.3 实验仪器 模拟高原低压低氧动物实验舱群(贵州风雷航空军械有限责任公司,DYC-9070);全自动荧光酶标仪(SpectraMax® i3);Sigma高速冷冻离心机(美国Sigma公司,3K15);WD-9403F紫外-可见分光光度计(惠普公司,美国);BP210S电子天平(德国Sartorius公司);旋转蒸发仪(上海亚荣生化仪器厂);真空干燥箱(上海一恒科学仪器有限公司,BPZ-6033LC);聚酰胺(20~40目,浙江省台州市路桥四甲生化塑料厂,批号:20111228);DK-8A型电热恒温水槽(上海精宏实验设备有限公司);Harris-80℃冷柜(Harris Manufacturing Co. Ltd);光学显微镜(日本Nikon公司,E200);组织切片机(德国美康公司,HM340E);TB-718E型生物组织自动包埋机(湖北泰雅电子技术有限公司)。
1.4 方法
1.4.1 螃蟹甲苯乙醇苷的制备 称取螃蟹甲药材3.8kg,粉碎后加8倍量水煎煮2次,每次2h,静置过滤,母液缓慢、匀速注入预先处理好的聚酰胺色谱柱中,紫外检测流出液成分(无苯乙醇苷),上样完全后蒸馏水洗脱,至流出液无色后改用75%乙醇洗脱,流出液每100ml收集一份,监测至无PhGCs流出,合并乙醇洗脱物,45℃旋转蒸发浓缩,将浓缩液放置真空干燥箱内,45℃减压干燥,得PhGCs(以毛蕊花糖苷为对照品,在330nm采用外标法测得毛蕊花糖苷含量为76%)。
1.4.2 动物分组及模型建立[12]70只SPF级健康雄性Wistar大鼠在实验室适应7d后,按体重随机分为7组:常压空白组(normoxia control group,NG)、常压+PhGCs组(NG+400mg/kg PhGCs)、缺氧模型组(hypoxia model group,HG)、PhGCs高剂量组(PhGCs-H,400mg/kg PhGCs)、PhGCs中剂量组(PhGCs-M,200mg/kg PhGCs)、PhGCs低剂量组(PhGCs-L,50mg/kg PhGCs)、地塞米松组(Dex,4mg/kg Dex),每组10只。各组均在SPF环境条件下饲养,NG组、HG组给予灭菌注射用水(1.0ml/100g)灌胃,剩余5组按照相应剂量灌胃给药,连续给药3d后,第4天起除NG组及NG+PhGCs组外,其余各组均置于模拟海拔8000m(舱内压力35.9kPa,氧分压7.5kPa)高原环境的人工实验舱中饲养72h,每天上午9:00以10m/s速度下降至4000m(舱内压力62.1kPa,氧分压13.0kPa),实验人员进舱,在舱里灌胃给药,换食水和垫料,连续3d,每天给药完毕后,将舱内高度以10m/s的速度匀速上升到预定海拔8000m,在此期间动物自由摄食及饮水。
1.4.3 动物取材 各缺氧组大鼠完成预定缺氧时间后,将人工实验舱内压力降至4000m的高原环境,实验人员通过缓冲舱进入舱内,先眼眶采血,后断头处死大鼠,小心打开胸腔,暴露肺组织,缓慢分离大鼠完整肺组织,用预冷的生理盐水冲洗肺组织3次,清除残血,然后用滤纸吸干,再将肺组织分为左、右两叶,右叶肺组织用4%多聚甲醛固定,用于HE染色观察,左肺组织上叶用电子天平称湿重后,锡箔纸包裹,用于测定肺组织含水量,左肺组织下叶-80℃低温冰箱保存,用于其他指标的检测。
1.4.4 大鼠肺组织含水量检测 肺组织含水量检测采用干湿比重法。将锡箔纸包裹的肺组织,放入55℃的恒温干燥烘箱中连续烘烤72h后至恒重,然后称干重,达恒重后(两次称量干重误差小于0.002g),再根据Elliot公式计算肺组织含水量:大鼠肺组织含水量(%)=(湿重-干重)/湿重×100%。
1.4.5 大鼠肺组织病理学观察 取右叶肺组织,用4%多聚甲醛溶液固定,固定组织应充分展开,切勿挤压和冷冻,室温固定3d后,切取肺组织块2~4mm3,常规脱水,石蜡包埋、切片、HE染色后,在光学显微镜下观察大鼠肺泡间隔病变、炎症细胞浸润、血管瘀血状况等组织病理学变化。
1.4.6 大鼠血清和肺组织中氧化应激及炎症相关指标的检测 将采集的各组大鼠血样在4℃下,3500r/min离心10min,分装血清,–80℃冰箱冻存,用于血清中TNF-α、IL-1β含量的测定。取低温冰箱保存的大鼠左肺组织下叶,准确称重,按重量(g):体积(ml)=1:9的比例,加入9倍体积预冷的PBS磷酸盐缓冲液,在冰浴中充分匀浆,制备10%的肺组织匀浆液,3500r/min离心10min,分装上清液,–80℃冰箱冻存,用于SOD、MDA、GSH、TNF-α、IL-1β的测定。将标准蛋白样品和待测样品加入一抗包被的96孔板,按ELISA试剂盒说明书步骤操作,最后测定450nm波长处的吸光度(A)值,根据已知浓度标准蛋白的A值绘制标准曲线,计算各待测样品中的TNF-α和IL-1β含量。利用紫外分光光度计采用比色法测定样品中SOD、MDA、GSH等氧化应激指标的变化,具体步骤按照说明书进行操作。
1.5 统计学处理 采用SPSS 16.0软件进行统计分析,计量数据均以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 PhGCs对急性HAPE大鼠肺组织含水量的影响与NG组比较,NG+PhGCs组大鼠肺组织含水量未见明显变化,HG组大鼠肺组织含水量明显增加(P<0.05)。与HG组比较,PhGCs-H组、PhGCs-M组、PhGCs-L组及Dex组大鼠肺组织含水量均明显降低(P<0.05或P<0.01),而PhGCs各剂量组与Dex组比较差异无统计学意义(表1)。
2.2 PhGCs对急性HAPE大鼠肺组织病理改变的影响 HE染色结果显示,NG组及NG+PhGCs组大鼠肺组织结构正常,肺泡腔清晰,各级支气管壁及肺泡间隔无水肿和炎症细胞浸润(图1A、B)。HG组大鼠肺组织变化明显,肺组织正常结构消失,出现弥漫性肺水肿,肺泡间隔及肺泡壁明显增宽,肺泡和间质充血且有大量炎症细胞浸润,肺泡腔出现渗出液(图1C)。PhGCs-H组、PhGCs-M组及PhGCs-L组大鼠肺组织水肿程度减轻,炎症细胞浸润减少,肺泡间隔及肺泡壁增宽较轻,肺间质充血程度明显减轻,且各级支气管和肺泡腔渗出液也不同程度减少,保护作用明显(图1D、E、F)。Dex组大鼠间质肺水肿程度较轻,炎症细胞浸润明显减少,肺泡间隔及肺泡壁增宽明显减轻(图1G)。
表1 PhGCs对急性HAPE大鼠肺组织含水量的影响,n=10)Tab.1 Effect of PhGCs on the lung water content in acute HAPE rats s, n=10)

表1 PhGCs对急性HAPE大鼠肺组织含水量的影响,n=10)Tab.1 Effect of PhGCs on the lung water content in acute HAPE rats s, n=10)
(1)P<0.05 compared with NG group; (2)P<0.05, (3)P<0.01 compared with HG group
Group PhGCs dosage (mg/kg) Lung water content (%)NG 0 75.90±2.36 NG+PhGCs 400 75.13±1.51 HG 0 78.16±1.92(1)PhGCs-H 400 75.92±2.08(2)PhGCs-M 200 76.20±1.95(2)PhGCs-L 50 76.36±1.86(2)Dex 4 75.49±2.04(3)
2.3 PhGCs对急性HAPE大鼠肺组织中SOD、GSH活性及MDA含量的影响 与NG组比较,NG+PhGCs组大鼠肺组织中SOD、GSH活性及MDA含量未见明显变化,HG组大鼠肺组织MDA含量明显升高(P<0.05),SOD、GSH活性明显降低(P<0.01或P<0.05);与HG组比较,PhGCs-H组和Dex组大鼠肺组织MDA含量明显降低(P<0.05或P<0.01),PhGCs-M组、PhGCs-L组和Dex组大鼠肺组织SOD活性均明显升高(P<0.05);PhGCs-M组和Dex组大鼠肺组织GSH活性明显升高,差异有统计学意义(P<0.05或P<0.01,表2)。PhGCs各剂量组及Dex组肺组织中SOD、GSH活性和MDA含量比较,差异均无统计学意义。

图1 光镜下肺组织病理学改变 (HE ×200)Fig.1 Histopathological changes of lung tissue observed under light microscopy (HE ×200)
表2 PhGCs对急性HAPE大鼠肺组织SOD、GSH活性及MDA含量的影响±s, n=10)Tab.2 Effect of PhGCs on the SOD, MDA and GSH of lung tissue in acute HAPE rats±s, n=10)

表2 PhGCs对急性HAPE大鼠肺组织SOD、GSH活性及MDA含量的影响±s, n=10)Tab.2 Effect of PhGCs on the SOD, MDA and GSH of lung tissue in acute HAPE rats±s, n=10)
(1)P<0.05, (2)P<0.01 compared with NG group; (3)P<0.05, (4)P<0.01 compared with HG group
Group Dosage (mg/kg) MDA (nmol/mg prot) SOD (U/mg prot) GSH (μmol/g prot)NG 0 2.07±0.57 7.13±1.25 2.70±0.89 NG+PhGCs 400 2.13±0.69 7.29±0.84 2.59±0.71 HG 0 2.73±0.78(1) 5.66±0.76(2) 2.04±0.41(1)PhGCs-H 400 2.04±0.62(3) 6.71±0.99(3) 2.79±0.50(3)PhGCs-M 200 2.33±0.58 6.65±0.79(3) 2.76±0.85(3)PhGCs-L 50 2.36±0.50 6.51±0.97(3) 2.15±0.56 Dex 4 1.98±0.41(4) 6.28±0.44(3) 2.59±0.21(4)
2.4 PhGCs对急性HAPE大鼠血清中IL-1β、TNF-α含量的影响 与NG组比较,NG+PhGCs组大鼠血清中IL-1β、TNF-α含量未见明显变化,HG组大鼠血清中IL-1β、TNF-α的含量明显升高(P<0.01);与HG组比较,PhGCs-H、PhGCs-M、PhGCs-L组及Dex组大鼠血清中IL-1β、TNF-α的含量明显降低(P<0.05或P<0.01)。PhGCs各剂量组及Dex组血清中IL-1β、TNF-α含量比较差异无统计学意义(表3)。
2.5 PhGCs对急性HAPE大鼠肺组织中IL-1β、TNF-α含量的影响 与NG组比较,NG+PhGCs组大鼠肺组织中IL-1β、TNF-α含量未见明显变化,HG组大鼠肺组织IL-1β、TNF-α含量明显升高(P<0.01或P<0.05)。与HG组比较,PhGCs-H、PhGCs-M、PhGCs-L组及Dex组大鼠肺组织IL-1β含量明显降低(P<0.05或P<0.01),PhGCs-H、PhGCs-M组及Dex组大鼠肺组织TNF-α的含量明显降低(P<0.01)。PhGCs各剂量组及Dex组肺组织中IL-1β、TNF-α含量比较差异无统计学意义(表4)。
表3 PhGCs对急性HAPE大鼠血清中IL-1β、TNF-α含量的影响,n=10)Tab.3 Effect of PhGCs on the IL-1β and TNF-α of serum in acute HAPE rats(±s, n=10)
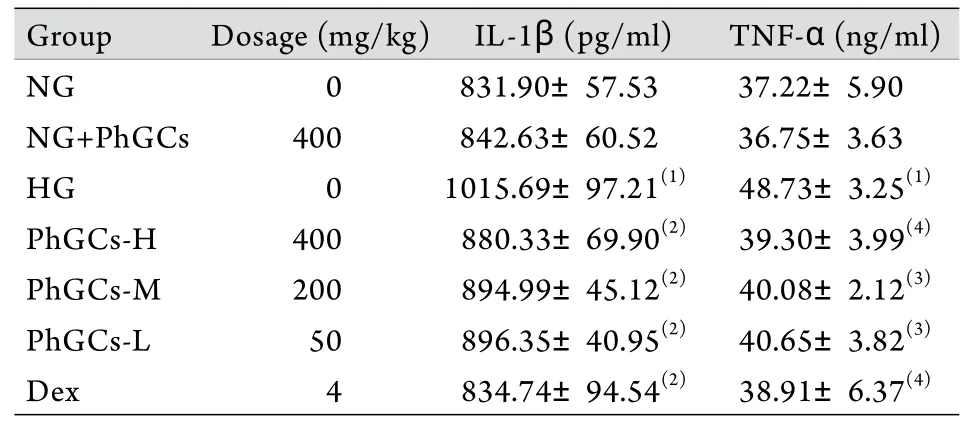
表3 PhGCs对急性HAPE大鼠血清中IL-1β、TNF-α含量的影响,n=10)Tab.3 Effect of PhGCs on the IL-1β and TNF-α of serum in acute HAPE rats(±s, n=10)
(1)P<0.05, (2)P<0.01 compared with NG group; (3)P<0.05, (4)P<0.01 compared with HG group
Group Dosage (mg/kg) IL-1β (pg/ml) TNF-α (ng/ml)NG 0 831.90±57.53 37.22±5.90 NG+PhGCs 400 842.63±60.52 36.75±3.63 HG 0 1015.69±97.21(1) 48.73±3.25(1)PhGCs-H 400 880.33±69.90(2) 39.30±3.99(4)PhGCs-M 200 894.99±45.12(2) 40.08±2.12(3)PhGCs-L 50 896.35±40.95(2) 40.65±3.82(3)Dex 4 834.74±94.54(2) 38.91±6.37(4)
表4 PhGCs对急性HAPE大鼠肺组织中IL-1β、TNF-α含量的影响±s, n=10)Tab.4 Effect of PhGCs on the IL-1β and TNF-α of lung tissue in acute HAPE rats±s, n=10)

表4 PhGCs对急性HAPE大鼠肺组织中IL-1β、TNF-α含量的影响±s, n=10)Tab.4 Effect of PhGCs on the IL-1β and TNF-α of lung tissue in acute HAPE rats±s, n=10)
(1)P<0.05, (2)P<0.01 compared with NG group; (3)P<0.05, (4)P<0.01 compared with HG group
Group Dosage (mg/kg) IL-1β (pg/ml) TNF-α (ng/ml)NG 0 1094.63±47.27 41.68±4.26 NG+PhGCs 400 1025.13±53.12 41.29±1.69 HG 0 1303.07±61.52(2) 49.50±4.21(1)PhGCs-H 400 1126.03±82.67(4) 42.46±1.72(3)PhGCs-M 200 1196.70±71.57(3) 44.09±1.62(3)PhGCs-L 50 1210.82±55.41(3) 47.09±1.44 Dex 4 1097.23±89.30(4) 42.77±1.46(3)
3 讨 论
HAPE的发病机制比较复杂,目前认为可能包括以下因素:缺氧引起肺动脉压增高以及血流动力学改变;炎症介质导致血管内皮受损,气血屏障通透性升高,大量液体进入肺间质;进入肺间质的液体不能被有效吸收,进入肺泡,从而形成肺泡性肺水肿[13]。本实验中,我们采用大型低压氧舱模拟海拔8000m的高原环境,缺氧暴露72h后建立实验性急性HAPE大鼠模型,HE染色观察可见肺组织正常结构消失,出现弥漫性肺水肿,肺泡间隔及肺泡壁明显增厚,肺泡和间质充血且有大量炎症细胞浸润,肺泡腔出现渗出液,肺组织含水量明显增高,说明HAPE大鼠模型制备成功。PhGCs各剂量组大鼠肺组织水肿程度减轻,炎症细胞浸润减少,肺泡间隔及肺泡壁增宽较轻,肺间质充血程度明显减轻,且各级支气管和肺泡腔渗出液也不同程度减少,具有明显的保护作用。
机体缺氧后,自由基损伤导致细胞膜的结构和功能破坏,是肺组织缺氧损伤的主要机制之一。正常情况下,自由基的产生与清除处于一种平衡状态,使氧自由基的生成量不至于达到损伤组织的程度,然而机体清除氧自由基的能力是有限的,氧自由基产生过多时,即可造成组织损伤。机体缺氧时,MDA含量明显升高,SOD、GSH活性明显降低[14]。MDA是氧自由基和生物膜多聚不饱和脂肪酸发生脂质过氧化反应的产物,其产生的量与氧自由基清除的量相平行,测定MDA可反映氧自由基的代谢情况,间接反映出细胞损伤的程度[15]。本实验结果表明,PhGCs可降低缺氧大鼠肺组织中MDA的含量,提高SOD和GSH酶活性,对HAPE大鼠表现出良好的抗氧化作用,推测PhGCs的抗氧化作用可能是通过重建体内自由基产生与清除的平衡,从而起到保护作用。
在高海拔地区,由于肺等组织面对突然的低压低氧应激,可快速产生各种生理反应[16],对抗这种应激发挥代偿机制[17],此过程势必会损伤部分细胞器甚至细胞、组织(如线粒体自由基增多、细胞自噬、神经元轴突受损等),并产生一些细胞因子(如IL-1β、TNF-α等),部分小分子最初发挥保护作用[18],但炎症因子的过表达可引起机体进一步的损伤。TNF-α是全身炎症反应的起始因子,是激活细胞因子级联反应的主要介质,在血液循环中出现最早,并迅速达到高峰,TNF-α一旦释放很快引起次级因子IL-1β的大量产生。机体暴露于高原环境时,肺组织出现水肿并伴有全身性炎症反应[19-21],小鼠短暂性常压缺氧后也可导致多个器官内炎症细胞聚集并伴有血清细胞因子升高,故我们推测,HAPE应该和炎症存在某种关系,相关研究也证明HAPE患者体内IL-1β、TNF-α水平升高[22]。本实验中,HG组大鼠血清和肺组织中IL-1β、TNF-α含量明显升高,主要是因为缺氧刺激和诱导炎症反应,造成以巨噬细胞为主的活性细胞产生大量的IL-1β和TNF-α并释放入血,导致血清和肺组织中IL-1β和TNF-α的含量升高。而PhGCs各剂量组血清和肺组织中IL-1β和TNF-α的含量较HG组明显降低,说明PhGCs的抗炎作用可能是通过降低IL-1β和TNF-α等细胞因子的含量,重建体内炎症反应的平衡来实现的。此外,PhGCs各剂量组肺组织含水量较HG组也明显降低,表明PhGCs对HAPE具有一定的缓解作用。
综上所述,螃蟹甲PhGCs可有效抑制低压低氧诱导的大鼠急性HAPE,其中抗氧化应激和抗炎可能是螃蟹甲PhGCs预防急性HAPE的主要作用,但其具体机制还有待进一步深入研究。
[1]Maggiorini M. Prevention and treatment of high altitude pulmonary edema[J]. Prog Cardiovasc Dis, 2010, 52(6): 500-506.
[2]Tang Y, Wu P, Su J, et al. Effects of Aquaporin-4 on edema formation following intracerebral hemorrhage[J]. Exp Neurol,2010, 223(2): 485-495.
[3]Bailey DM, Evans KA, James PE, et al. Altered free radical metabolism in acute mountain sickness: implications for dynamic cerebral autoregulation and blood-brain barrier function[J]. J Physiol, 2009, 587(Pt 1): 73-85.
[4]Luo YJ, Chen Y, Gao YQ. Study on plasma proteomics in patients with high altitude pulmonary edema (HAPE)[J]. Med J Chin PLA, 2012, 37(1): 31-33. [罗勇军, 陈郁, 高钰琪. 高原肺水肿的血浆蛋白质组学研究[J]. 解放军医学杂志, 2012, 37(1):31-33.]
[5]Li MX, Huang J, Zhang C, et al. Iridoid glycosides and phenylethanoid glycosides from Phlomis younghusbandii roots[J].Chem Nat Comp, 2011, 47(5): 848-849.
[6]Li MX, Zhang C, Wu L, et al. Determination of phenylethanoid glycosides in Phlomis younghusbandii by HPLC[J]. J Pharm Pract, 2011, 29(5): 379-400. [李茂星, 张超, 乌兰, 等. HPLC法测定藏药螃蟹甲中苯乙醇苷类化合物的含量[J]. 药学实践杂志, 2011, 29(5): 379-400.]
[7]Zhang C, Li MX, Shang XF, et al. Analgesic and antiinflammatory activities of Phlomis younghusbandii[J]. West Chin J Pharm Sci, 2011, 26(2): 135-137. [张超, 李茂星, 尚小飞, 等.藏药螃蟹甲的镇痛抗炎作用[J]. 华西药学杂志, 2011, 26(2):135-137.]
[8]Zhao Z, Luo JQ, Zhao YW. Effects of Phlomis younghusbandii water extract on ulcerative colitis in mice[J]. J Logist Univ PAPF(Med Sci), 2013, 22(6): 464-467, 578. [赵智, 罗俊卿, 赵艳威.螃蟹甲水提取物对溃疡性结肠炎小鼠的治疗作用[J]. 武警后勤学院学报(医学版), 2013, 22(6): 464-467, 578.]
[9]Gulinuer M, Liu M, Lu J. Effect of Cistanoside compounds on oxidative stress and immunity[J]. J Chin Pharm Sci, 2001,10(3): 157-160.
[10]Sun ZH. Research progress of pharmacological activity of Herba Cistanchis[J]. J Chifeng Univ (Nat Sci Ed), 2010, 26(2): 70-71.[孙朝晖. 中药肉苁蓉的药理活性研究进展[J]. 赤峰学院学报: 自然科学版, 2010, 26(2): 70-71.]
[11]Liu ZQ, Chen QD, Li Y, et al. Influences of Roucongrong (Herba Cistanchis) on hematopoietic function and immune function in tumor-bearing mice after chemotherapy[J]. J Beijing Univ Tradit Chin Med, 2010, 33(11): 758-761. [刘智勤, 陈鹊汀, 李岩,等.肉苁蓉对化疗荷瘤小鼠造血和免疫功能的影响[J]. 北京中医药大学学报, 2010, 33(11): 758-761.]
[12]Patir H, Sarada SK, Singh S, et al. Quercetin as a prophylactic measure against high altitude cerebral edema[J]. Free Radic Biol Med, 2012, 53(4): 659-668.
[13]Maggiorini M, Melot C, Pierre S, et al. High altitude pulmonary edema is initially caused by an increase in capillary pressure[J].Circulation, 2001, 103(16): 2078-2083.
[14]Imray C, Wright A, Subudhi A, et al. Acute mountain sickness:pathophysiology, prevention, and treatment[J]. Prog Cardiovasc Dis, 2010, 52(6): 467-484.
[15]Madden LA, Sandstrom ME, Lovell RJ, et al. Inducible heat shock protein 70 and its role in preconditioning and exercise[J].Amino Acids, 2008, 34(4): 511-516.
[16]Serrano J, Fernandez AP, Sanchez J, et al. Adrenomedullin expression is up-regulated by acute hypobaric hypoxia in the cerebral cortex of the adult rat[J]. Brain Pathol, 2008, 18(3):434-442.
[17]Grenz A, Eltzschig HK. Mast cells and intestinal injury: a novel link between hypoxia and inflammation[J]. Crit Care Med,2013, 41(9): 2246-2248.
[18]Rosenberger P, Schwab JM, Mirakaj V, et al. Hypoxia-inducible factor-dependent induction of netrin-1 dampens inflammation caused by hypoxia[J]. Nat Immunol, 2009, 10(2): 195-202.
[19]Shukla D, Saxena S, Purushothaman J, et al. Hypoxic preconditioning with cobalt ameliorates hypobaric hypoxia induced pulmonary edema in rat[J]. Eur J Pharmacol, 2011, 656(1-3): 101-109.
[20]Howarth PH, Babu KS, Arshad HS, et al. Tumour necrosis factor (TNF alpha) as a novel therapeutic target in symptomatic corticosteroid dependent asthma[J]. Thorax, 2005, 60(12):1012-1018.
[21]Julian CG, Subudhi AW, Wilson MJ, et al. Acute mountain sickness, inflammation, and permeability: new insights from a blood biomarker study[J]. J Appl Physiol, 2011, 111(2): 392-399.
[22]Sarada SK, Mathew T, Patir H. Prophylactic administration of curcumin abates the incidence of hypobaric hypoxia induced pulmonary edema in rats: a molecular approach[J]. J Pulm Respir Med, 2014, 4(1): 1-12.
