丙二醛氧化对大米蛋白功能性质的影响
2015-11-04蔡勇建吴晓娟林亲录杨滔滔中南林业科技大学食品科学与工程学院稻谷及副产物深加工国家工程实验室湖南长沙40004湖南粮食集团有限责任公司湖南长沙40008
吴 伟,蔡勇建,吴晓娟,李 彤,林亲录,杨滔滔(.中南林业科技大学食品科学与工程学院,稻谷及副产物深加工国家工程实验室,湖南长沙40004;.湖南粮食集团有限责任公司,湖南长沙40008)
丙二醛氧化对大米蛋白功能性质的影响
吴伟1,蔡勇建1,吴晓娟2,李彤1,林亲录1,杨滔滔1
(1.中南林业科技大学食品科学与工程学院,稻谷及副产物深加工国家工程实验室,湖南长沙410004;2.湖南粮食集团有限责任公司,湖南长沙410008)
以新收获籼米为原料制备大米蛋白,采用不同浓度丙二醛氧化大米蛋白,研究丙二醛氧化对大米蛋白功能性质的影响。结果表明:随着丙二醛浓度的增加,氧化大米蛋白的羰基和二硫键含量增加,游离巯基含量下降,表明大米蛋白发生了氧化。当丙二醛浓度从0增加到100 mmol/L时,氧化大米蛋白溶解性从28.88%降低至12.20%,持水性从353.67%降低至132.33%,持油性从89.40%上升至189.40%,起泡能力和泡沫稳定性分别从74.27%和54.06%降低至57.56%和38.01%,乳化性和乳化稳定性分别从55.32 m2/g和97.59 min降低至45.13 m2/g和75.29 min,表明丙二醛氧化对大米蛋白功能性质有负面影响。这一结果为进一步改善大米蛋白功能性质提供了有效基础。
大米蛋白,丙二醛,蛋白质氧化,功能性质
大米作为我国居民膳食中最重要的主食,约含8%~10%大米蛋白。大米蛋白具有过敏性低、生物效价高和氨基酸组成平衡合理等特点,是公认的优质植物蛋白,一直备受食品科学家高度关注。国内外大米蛋白类产品的主要形式包括食品添加剂、蛋白质营养补充剂和生物活性肽等[1-2]。大米蛋白类食品添加剂主要受大米蛋白功能性质的影响,而大米蛋白功能性质又与其结构特征密切相关。影响大米蛋白结构的因素很多,稻谷贮藏过程中的陈化可导致大米蛋白氧化,进而改变大米蛋白结构和功能性质[3]。李彤等[4]在研究陈化对米谷蛋白功能性质影响时发现随籼米贮藏时间的延长,米谷蛋白提取率、溶解性、持水性、乳化性和乳化稳定性逐渐减小,米谷蛋白持油性呈上升趋势,而米谷蛋白起泡性和起泡稳定性呈先上升、后下降趋势,由此可见稻谷陈化导致的大米蛋白氧化可改变大米蛋白功能性质。稻谷贮藏过程中导致大米蛋白氧化的活性氧主要源于脂质自由基和活性脂质氧化产物,目前对于稻谷贮藏过程中脂质自由基和活性脂质氧化产物分别在多大程度上导致大米蛋白氧化还不甚明晰。丙二醛作为一种活性醛类,其含量常用来衡量脂质氧化的程度[5],本文以丙二醛代表脂质次生活性氧化产物,以不同贮藏期籼稻制备大米蛋白羰基含量为参照确定丙二醛添加浓度范围,研究丙二醛氧化对籼米蛋白功能性质的影响,为深入研究稻谷陈化机理以及稻谷陈化过程中大米蛋白氧化对大米蛋白功能性质的影响奠定理论基础。
1 材料与方法
1.1材料与仪器
新收获金优207(籼米) 湖南粮食集团有限责任公司;1,1,3,3-四甲氧基丙烷、5,5’-二硫代二硝基苯甲酸分析纯,美国Sigma-Aldrich公司;其他试剂均为分析纯,购于国药集团上海化学试剂公司。
Sorvall LYNX 6000高速落地离心机美国Thermo Fisher公司;FD5-4冷冻干燥机美国GOLD-SIM公司;SHA-2A冷冻水浴恒温振荡器北京中兴伟业仪器有限公司;FA25高速分散均质机上海弗鲁克流体机械制造有限公司。
1.2实验方法
1.2.1大米蛋白的制备以新收获金优207籼米为原料,磨粉过80目,将米粉以1∶7(w/v)料液比与0.05 mol/L氢氧化钠溶液混合,在40℃条件下搅拌4 h后将悬浮液在4℃条件下8000 r/min离心20 min,取上清液用2 mol/L HCl调pH至4.0,静置20 min后在4℃条件下8000 r/min离心15 min,水洗沉淀三次,取蛋白沉淀分散于去离子水中并用2 mol/L NaOH调pH至7.0。最后在4℃条件下8000 r/min离心30 min除去少量杂质,冷冻干燥得到大米蛋白。在此条件下大米蛋白提取率为83.34%,纯度为85.02%。
1.2.2丙二醛氧化大米蛋白的制备参照Wu等[5]制备丙二醛氧化大豆蛋白的方法制备丙二醛氧化大米蛋白,以常温条件下不同贮藏期(0~18个月)金优207籼稻制备大米蛋白羰基含量为参照,确定丙二醛添加浓度范围。将水解1,1,3,3-四甲氧基丙烷制备的丙二醛储液与10 mg/mL大米蛋白溶液(溶于0.01 mol/L pH7.4的磷酸盐缓冲液中,其中含有0.5 mg/mL NaN3)混合,使得丙二醛浓度分别为0、0.01、0.1、1、10、100 mmol/L,25℃密封避光条件下振荡反应24 h,随后将反应液置于冰浴中使温度迅速下降至4℃以下,随后在4℃超纯水中透析72 h去除未反应的丙二醛,透析过程中每隔6 h更换一次超纯水,最后冷冻干燥得到丙二醛氧化大米蛋白。
1.2.3羰基含量的测定参考Wu等[5]的方法采用2,4-二硝基苯肼比色法测定大米蛋白羰基含量,以22000(mol/L)-1·cm-1消光系数计算每克蛋白质羰基衍生物的摩尔数。
1.2.4游离巯基与二硫键含量的测定参考Wu等[5]的方法采用5,5’-二硫代二硝基苯甲酸比色法测定氧化大米蛋白游离巯基和总巯基含量,以13600(mol/L)-1cm-1消光系数计算每毫克蛋白质巯基摩尔数,总巯基与游离巯基差值的一半即为二硫键含量。
1.2.5溶解性的测定将氧化大米蛋白分散于去离子水中,磁力搅拌2 h后室温条件10000 r/min离心20 min收集上清液。随后采用微量凯氏定氮法测定上清液中可溶解氮含量,蛋白质溶解性表示为可溶解氮与样品中总氮的百分比。
1.2.6持水性的测定参考Mohamed等[6]方法,并作适当的修改,具体操作如下:预先称取离心管的质量m1,再准确称取0.2 g左右氧化大米蛋白(m2)置于预先称重过的离心管中。逐步向离心管中加去离子水(共计6~8 mL),每加一次水就用玻璃棒将样品搅匀,并在管壁上擦干玻璃棒,于3000 r/min离心20 min,倒去上清液,称重质量m3。若无上清液,则应再加水搅拌离心,至离心后有少量上清液为止。按式(1)计算大米蛋白持水性:
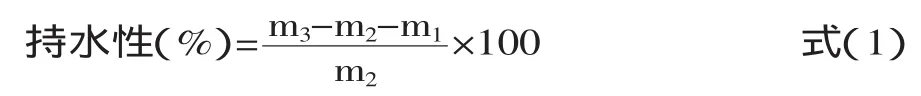
1.2.7持油性的测定参考Mohamed等[6]方法,并作适当的修改,具体操作如下:预先称取离心管的质量M1,再准确称取0.2 g左右氧化大米蛋白(M2)置于预先称重过的离心管中。逐步向离心管中加大豆油4 mL,用玻棒轻轻搅拌,分散至无明显颗粒,再用吸管取2 mL油冲洗玻棒和管壁,3000 r/min离心20 min,吸去上层未吸附油,称重质量M3。按式(2)计算大米蛋白持油性:
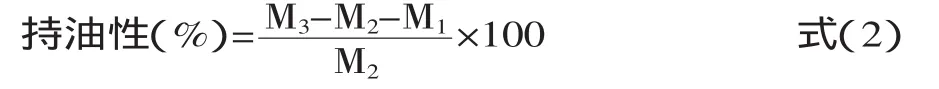
1.2.8起泡能力和泡沫稳定性的测定参考Mohamed等[6]方法,并作适当的修改,具体操作如下:准确称量0.2 g左右氧化大米蛋白置于已加入20 mL 0.05 mol/L pH7.0磷酸盐缓冲液的50 mL烧杯中。使用高速分散均质机以10000 r/min的速度均质30 s,连续3次共计2 min,记录均质后的泡沫体积,记为V0,静置30 min后再次记录泡沫体积,记为V30。按式(3)和(4)分别计算大米蛋白起泡能力和泡沫稳定性:
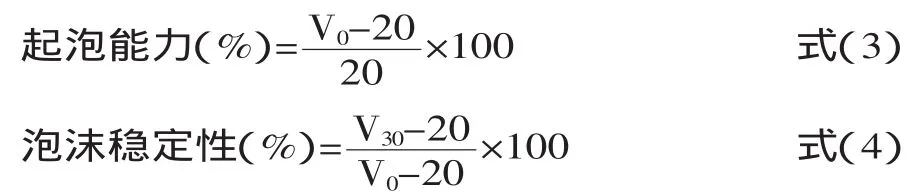
1.2.9乳化性和乳化稳定性的测定参考Molina等[7]方法,并作适当的修改,具体操作如下:将氧化大米蛋白溶解于去离子水中,调整蛋白浓度为1 mg/mL。取1 mg/mL蛋白溶液15 mL与5 mL大豆油混合放入100 mL烧杯中,于10000 r/min均质2 min后立即开始取样。取20 μL大米蛋白-大豆油乳状液与5 mL 0.1%十二烷基硫酸钠均匀混合,以0.1%十二烷基硫酸钠为空白,在500 nm处测定吸光值(记为A0)。乳状液静置30 min后采用相同的方法测定乳状液吸光值(记为A30)。按式(5)和(6)分别计算大米蛋白乳化性和乳化稳定性:
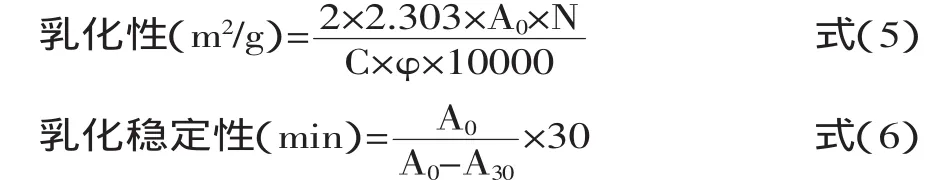
式中:N:稀释倍数,250;C:样品溶解液中蛋白质浓度,0.001 g/mL;φ:油相所占的分数,0.25。1.2.10数据处理所有数据均重复三次,采用Origin Pro 7.5对各实验数据进行统计学分析。
2 结果与分析
2.1丙二醛氧化对大米蛋白氧化程度的影响
目前衡量蛋白质氧化程度最直接的指标是蛋白质羰基含量,氧化大米蛋白羰基含量如表1所示,随着丙二醛浓度的增加,大米蛋白羰基含量逐渐增加,并且当大米蛋白被浓度大于等于0.1 mmol/L丙二醛氧化时,氧化大米蛋白羰基含量显著(p<0.05)增加,表明当丙二醛浓度大于等于0.1 mmol/L时,氧化大米蛋白氧化程度随着丙二醛浓度的增加不断增大。Wu等[5]研究丙二醛-大豆蛋白模拟氧化体系发现大豆分离蛋白氧化程度随着丙二醛浓度的增加而增大。丙二醛分子含有两个羰基,当其中一个羰基与蛋白质反应时,就会为蛋白质引入一个新的羰基;此外,丙二醛还可通过亲核侧链基团反应形成西佛碱,使得蛋白质羰基化[8]。
蛋白质巯基是对氧化最敏感的蛋白质侧链基团,蛋白质游离巯基和二硫键含量可表征蛋白质巯基的氧化程度,丙二醛氧化大米蛋白巯基和二硫键含量如表1所示。随着丙二醛浓度的增加,氧化大米蛋白游离巯基逐渐下降,并且浓度大于等于0.1 mmol/L的丙二醛氧化使得大米蛋白游离巯基含量显著(p<0.05)下降;氧化大米蛋白二硫键含量随着丙二醛浓度的增加而增加,并且浓度大于等于10 mmol/L的丙二醛氧化使得大米蛋白二硫键含量显著(p<0.05)增加,表明随着丙二醛浓度的增加,氧化大米蛋白游离巯基逐渐氧化形成二硫键。
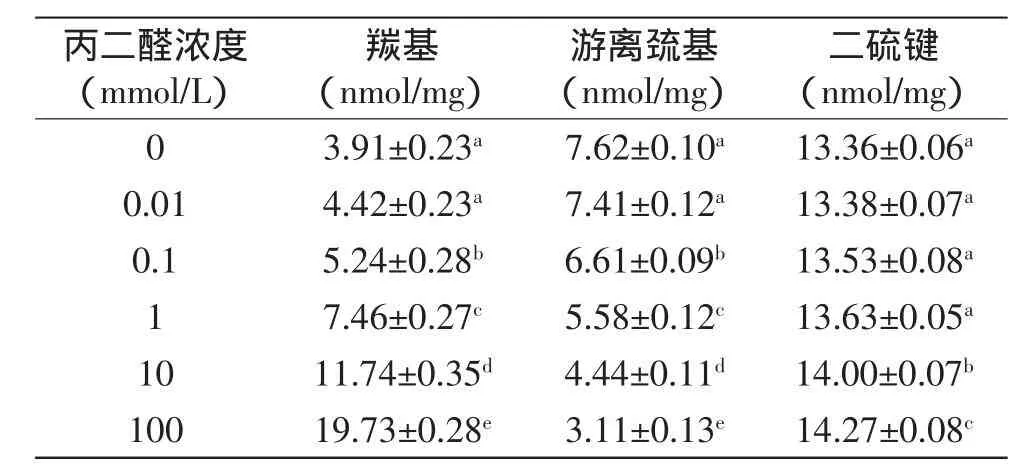
表1 丙二醛氧化大米蛋白羰基、游离巯基和二硫键含量Table 1 Protein carbonyl,free sulphydryl,and disulfide content of rice protein which oxidatively modified by malondialdehyde
2.2丙二醛氧化对大米蛋白溶解性的影响
溶解性是蛋白质功能性质的前提和基础,氧化大米蛋白溶解性如图1所示。随着丙二醛浓度的增加,大米蛋白溶解性逐渐下降,并且浓度大于等于0.1 mmol/L的丙二醛氧化修饰使得大米蛋白溶解性显著(p<0.05)下降,表明氧化大米蛋白溶解性随大米蛋白氧化程度的增加而逐渐下降。天然大米蛋白(丙二醛浓度为0 mmol/L)溶解性低于30%,这是由于大米蛋白中70%~80%左右的蛋白质是溶解性较差的谷蛋白[1]。Ye等[9]发现花生分离蛋白溶解性随着蛋白质氧化程度的增加而降低,并认为形成不溶性蛋白质氧化聚集体是造成花生分离蛋白溶解性下降的原因。大米蛋白溶解性下降的原因可能是丙二醛氧化导致大米蛋白二硫键增加,同时丙二醛通过与蛋白质中的亲核侧链基团反应形成西佛碱,进而导致大米蛋白发生共价交联形成不可溶性聚集体。
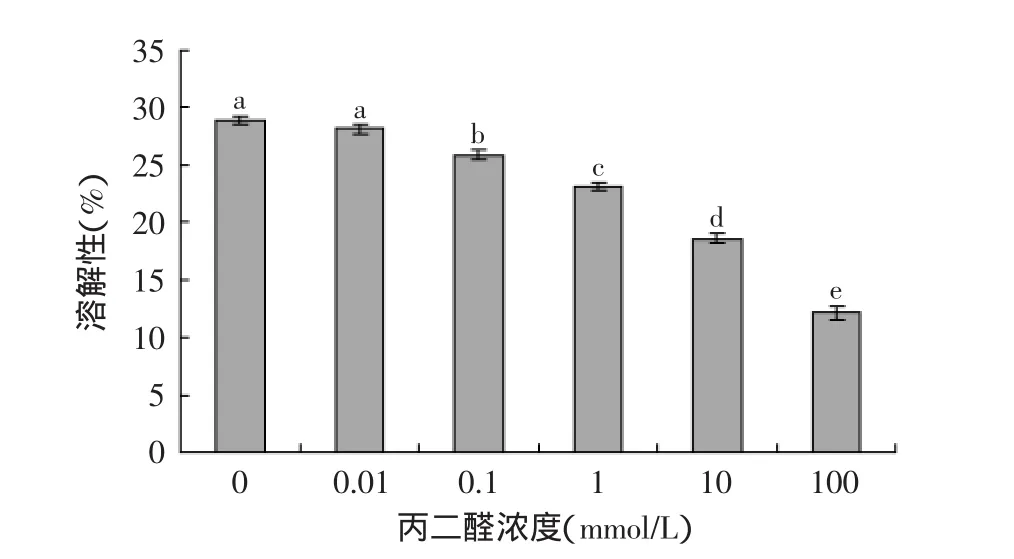
图1 丙二醛氧化对大米蛋白溶解性的影响Fig.1 Effect of oxidative modification by malondialdehyde on solubility of rice protein
2.3丙二醛氧化对大米蛋白持水性的影响
丙二醛氧化对大米蛋白持水性的影响如图2所示,随着丙二醛浓度的增加,氧化大米蛋白持水性逐渐显著(p<0.05)下降,表明氧化大米蛋白持水性随蛋白质氧化程度的增加而逐渐降低。李彤等[4]研究发现籼米米谷蛋白持水性随着籼米贮藏时间的延长而下降,并认为米谷蛋白游离巯基氧化形成二硫键和形成不可溶性蛋白质氧化聚集体是导致米谷蛋白持水性下降的重要原因。Zhao等[10]认为氧化大米蛋白中一些颗粒较大的不可溶性氧化聚集体也可能影响大米蛋白的持水性。因此,丙二醛氧化导致大米蛋白持水性下降可能是氧化大米蛋白巯基转化形成二硫键和大量形成不可溶性蛋白质氧化聚集体。
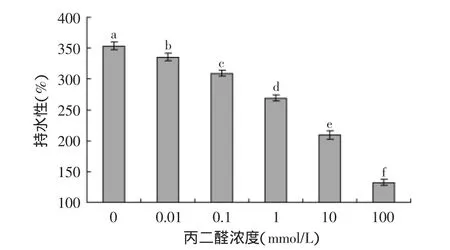
图2 丙二醛氧化对大米蛋白持水性的影响Fig.2 Effect of oxidative modification by malondialdehyde on water holding capacity of rice protein
2.4丙二醛氧化对大米蛋白持油性的影响
丙二醛氧化对大米蛋白持油性的影响如图3所示,随着丙二醛浓度的增加,大米蛋白持油性逐渐增加,并且高浓度丙二醛(≥0.1 mmol/L)氧化使得大米蛋白持油性显著(p<0.05)增加,表明氧化大米蛋白持油性随大米蛋白氧化程度的增加而增加。李彤等[4]研究发现米谷蛋白持油性随着籼米贮藏时间的延长而增加,并认为持油性上升可能是籼米贮藏过程中米谷蛋白疏水基团暴露,疏水性增强,利于蛋白质对油滴的吸附;Wu等[5]研究发现丙二醛可与大豆蛋白内部氨基酸残基接触、反应,使蛋白部分去折叠,疏水基团外露。因而,氧化大米蛋白持油性增加可能是丙二醛氧化导致大米蛋白疏水基团暴露,使得大米蛋白对油脂的吸附能力增加的原因。
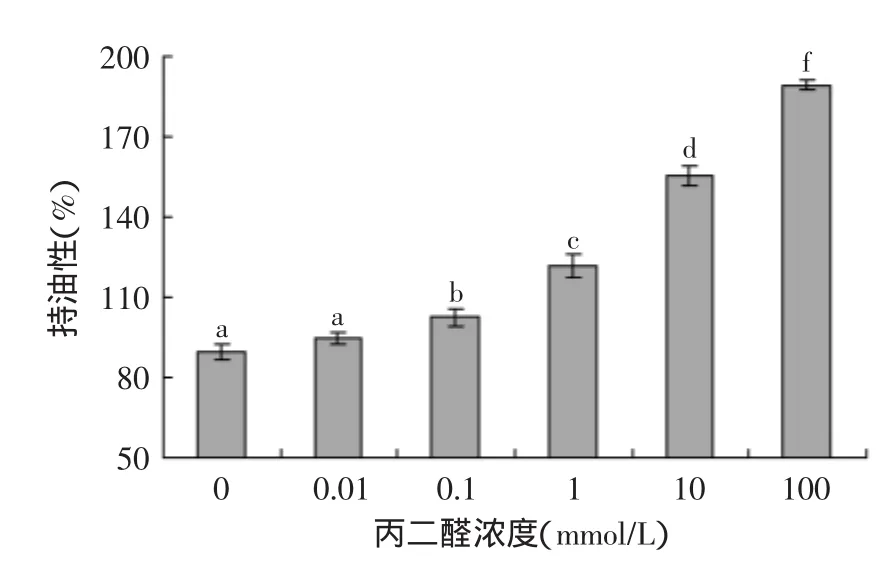
图3 丙二醛氧化对大米蛋白持油性的影响Fig.3 Effect of oxidative modification by malondialdehyde on oil-absorbing capacity of rice protein
2.5丙二醛氧化对大米蛋白起泡能力和泡沫稳定性的影响
丙二醛氧化大米蛋白起泡性和泡沫稳定性如图4所示。随着丙二醛浓度的增加,大米蛋白的起泡能力和泡沫稳定性均逐渐显著(p<0.05)下降,表明氧化大米蛋白起泡能力和泡沫稳定性随着蛋白质氧化程度的增加而降低。Wu等[5]发现脂质过氧化产物诱导的蛋白质氧化可导致大豆蛋白溶解性和稳定性下降,使得大豆蛋白不能在气-液界面充分展开,无法形成具有良好黏弹性且能阻隔空气渗透的连续蛋白膜,导致大豆蛋白起泡能力和泡沫稳定性降低。氧化大米蛋白起泡能力和泡沫稳定性降低可能是由于丙二醛氧化导致大米蛋白巯基转化形成二硫键,共价交联产生不可溶性聚集体,使大米蛋白溶解性和结构稳定性下降。
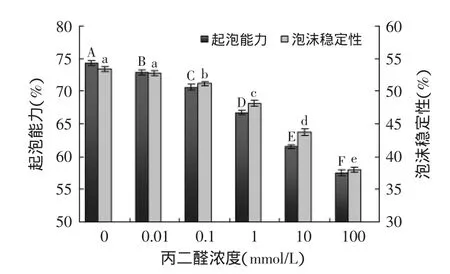
图4 丙二醛氧化对大米蛋白起泡能力和泡沫稳定性的影响Fig.4 Effect of oxidative modification by malondialdehyde on foaming capacity and foam stability of rice protein
2.6丙二醛氧化对大米蛋白乳化性和乳化稳定性的影响
丙二醛氧化对大米蛋白乳化性和乳化稳定性的影响如图5所示,随着丙二醛浓度的增加,大米蛋白的乳化性和乳化稳定性均逐渐下降,其中不同浓度丙二醛氧化大米蛋白乳化性彼此间差异性显著(p<0.05),高浓度丙二醛(≥0.1 mmol/L)氧化使得大米蛋白乳化稳定性显著下降,表明大米蛋白乳化性和乳化稳定性随着蛋白质氧化程度的增加而降低。Chen等[11]采用2,2’-盐酸脒基丙烷氧化体系模拟花生储藏过程中蛋白质氧化对花生分离蛋白乳化性的影响时发现,随着蛋白质氧化程度的增加,花生分离蛋白氧化产生不可溶性聚集体,乳化性和乳化稳定性降低;同时,李彤等[4]在研究陈化对米谷蛋白功能性质的影响时发现,米谷蛋白在陈化过程中虽然疏水基团的暴露引起了蛋白质吸油性的增加,然而蛋白质乳化作用减弱也与其溶解性下降导致蛋白质吸附扩散能力受限有关。丙二醛氧化使大米蛋白分子间发生共价交联和聚集形成不可溶性聚集体,导致溶解性下降,使得蛋白质对脂肪的吸附扩散能力降低,从而减弱了大米蛋白的乳化作用。
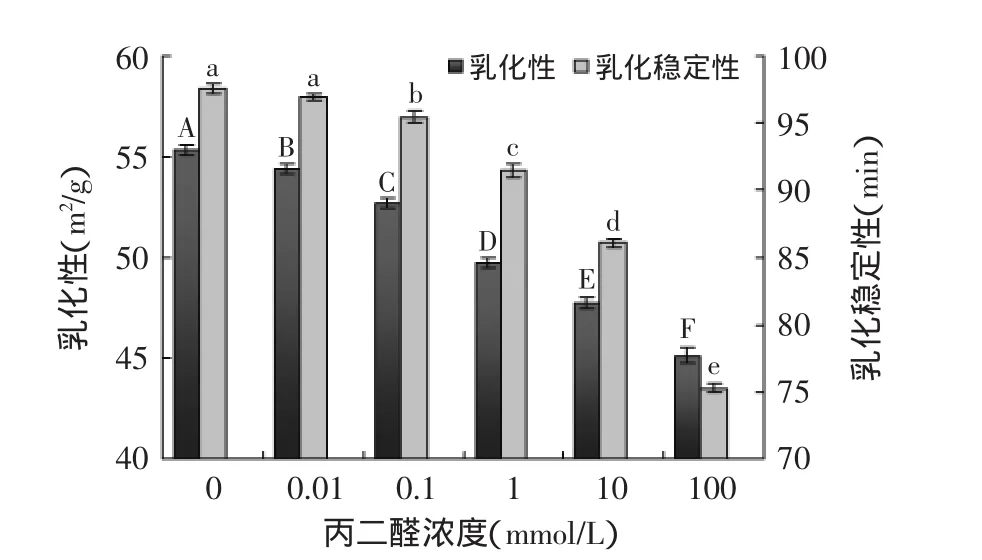
图5 丙二醛氧化对大米蛋白乳化性和乳化稳定性的影响Fig.5 Effect of oxidative modification by malondialdehyde on emulsification and emulsion stability of rice protein
3 结论
大米储藏过程中易发生陈化,陈化期间脂质发生水解和氧化反应,产生的脂质自由基和活性脂质氧化产物可导致大米蛋白氧化。本文以新收获籼米为原料提取大米蛋白,以丙二醛代表脂质次生活性氧化产物,研究丙二醛氧化对大米蛋白功能性质的影响,结果发现随着丙二醛浓度的增加,氧化大米蛋白羰基和二硫键含量增加,游离巯基含量下降,表明丙二醛导致大米蛋白氧化。随着大米蛋白氧化程度的增加,氧化大米蛋白溶解性、持水性、起泡性、乳化性逐渐下降,持油性上升,表明丙二醛氧化对大米蛋白功能性质有负面影响。丙二醛氧化影响大米蛋白功能性质的机理有待进一步研究。
[1]Muhammad A S,Faqir M A,Tahir Z,et al.Electrophoretic and functional mapping of indica rice glutelin protein isolates[J]. International Journal of Food Properties,2011(14):1375-1385.
[2]李佳南,王静,张慧娟,等.大米蛋白抗氧化肽的活性以及组成鉴定研究[J].食品工业科技,2013,34(23):53-57.
[3]Zhou Z K,Robards K,Helliwell S,et al.Ageing of stored rice:changes in chemical and physical attributes[J].Journal of Cereal Science,2002,35(1):65-78.
[4]李彤,吴晓娟,吴伟,等.陈化对籼米米谷蛋白功能特性的影响[J].粮食与油脂,2013,26(7):22-24.
[5]WuW,LinQL,HuaYF,etal.Studyonmechanismofsoyprotein oxidation induced by lipid peroxidation products[J].Advance Journal of Food Science and Technology,2013,5(1):46-53.
[6]Mohamed T K,Issoufou A,Fatmata T,et al.Effect of enzymatic hydrolysis on the functional properties of foxtail millet(Setaria italica L.)proteins[J].International Journal of Food Science and Technology,2010(45):1175-1183.
[7]Molina E,Papadopoulou A,Ledward D A.Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J].Food Hydrocolloids,2001,15(3):263-269.
[8]Burcham P C,Kuhan Y T.Introduction of carbonyl groups into proteins by the lipid peroxidation product,malondialdehyde[J].Biochemical and Biophysical Research Communications,1996,220(3):996-1001.
[9]Ye L,Liao Y,Zhao M M,et al.Effect of protein oxidation on the conformational properties of peanut protein isolate[J].Journal of Chemistry,2013(ID 423254):1-6.
[10]Zhao Q,Xiong H,Selomulya C,et al.Effect s of spray drying and freeze drying on the properties of protein isolate from rice dreg protein[J].Food and Bioprocess Technology,2013(6):1759-1769.
[11]Chen N N,Zhao M M,Sun W Z,et al.Effect of oxidation on the emulsifying properties of soy protein isolate[J].Food Research International,2013(52):26-32.
Effect of oxidative modification by malondialdehyde on functional properties of rice protein
WU Wei1,CAI Yong-jian1,WU Xiao-juan2,LI Tong1,LIN Qin-lu1,YANG Tao-tao1
(1.College of Food Science and Engineering,Center South University of Forestry and Technology,National Engineering Laboratory for Rice and By-product Deep Processing,Changsha 410004,China;2.Hunan Grain Group,Changsha 410008,China)
Fresh indica rice which oxidatively modified by different concentration of malondialdehyde were used as material to investigate effects of oxidative modification by malondialdehyde on functional properties of indica rice protein.The results indicated that as concentration of malondialdehyde increased,content of rice protein carbonyl and disulfide increased,and content of free sulphydryl decreased,which indicated that incubation of malondialdehyde with rice protein resulted in oxidation of rice protein.As concentration of malondialdehyde increased from 0 to 100 mmol/L,solubility of rice protein decreased from 28.88%to 12.20%,water holding capacity of rice protein decreased from 353.67%to 132.33%,oil-absorbing capacity of rice protein decreased from 89.40%to 189.40%,foaming capacity and foam stability of rice protein decreased from 74.27%and 54.06%to 57.56%and 38.01%,respectively,emulsification and emulsion stability of rice protein decreased from 55.32 m2/g and 97.59 min to 45.13 m2/g and 75.29 min,respectively.The results indicated that oxidative modification by malondialdehyde had a negative effect on function properties of rice protein.The results provided effective basis for further improve the functional properties of rice protein.
rice protein;malondialdehyde;protein oxidation;functional properties
TS201.1
A
1002-0306(2015)18-0113-05
10.13386/j.issn1002-0306.2015.18.014
2015-01-06
吴伟(1981-),男,博士,副教授,研究方向:粮油工程,E-mail:foodwuwei@126.com。
国家自然科学基金(31201319);公益性行业(农业)科研专项(201303071);湖南省教育厅项目(编号14C1181);湖南省科技计划专项(2014GK4003);长沙市科技计划重大专项(K1404006-21)。
