中华绒螯蟹鲜活及死后品质变化规律初探
2015-11-04王亚会王锡昌郭燕茹曾思思上海海洋大学食品学院上海201306
王亚会,王锡昌,王 帅,郭燕茹,赵 樑,曾思思(上海海洋大学食品学院,上海201306)
中华绒螯蟹鲜活及死后品质变化规律初探
王亚会,王锡昌*,王帅,郭燕茹,赵樑,曾思思
(上海海洋大学食品学院,上海201306)
为了探究中华绒螯蟹新鲜、垂死及死亡初期品质变化规律,选取鲜活、垂死、死后0、2、5、10、15和24 h共8个状态下的中华绒螯蟹进行研究,对此八种状态下的中华绒螯蟹进行感官评价,并测定失重率以及可食部位得率,结合滋味指标游离氨基酸(FAA)、非蛋白氮(NPN)、鲜度指标K值、pH、腐败指标挥发性盐基氮(TVBN)、生物胺进行品质研究。结果表明:中华绒螯蟹的感官评分随死后时间的延长而下降,中华绒螯蟹在死后10 h出现明显的腐败臭味,死后24 h打开蟹壳,里面的气味达到可接受极限;新鲜和垂死两个状态下,蟹的品质指标几乎无显著性差异(p<0.05);中华绒螯蟹在死亡10 h检测出生物胺,且直到15 h其体内有毒生物胺的含量较低,不足以引起中毒。多数指标均在D5和D10时发生较大改变,表明此时中华绒螯蟹品质有较大变化,中华绒螯蟹在死后10 h进入腐败阶段。
中华绒螯蟹,感官评价,滋味,鲜度,腐败,品质变化
中华绒螯蟹俗称大闸蟹,又称河蟹、毛蟹,属于真核域,动物界,节肢动物门,甲壳动物亚门,节肢动物软甲纲,十足目,方蟹科,绒螯蟹属,它是我国特有的水产品,自古以来就有“中华绒螯蟹上席百味淡”之说,中华绒螯蟹以细嫩的肉质和鲜甜的口感颇受人们喜爱。目前我国的中华绒螯蟹分布区域主要有三处:分别是长江水系,辽河水系以及浙江省温州与瓯江一带等沿海区域。近年来国内以及海外市场对中华绒螯蟹的需求量不断增长,其养殖产业急速扩张[1],据中国渔业年鉴[2]最新统计,中华绒螯蟹年产量从2004年的425000 t,提高到2013年的729862 t。但中华绒螯蟹上市受季节影响(一般在9~11月份集中上市),离开养殖环境后存活时间较短(10℃存活一周左右),这给中华绒螯蟹的贮运带来了极大压力。
根据传统说法,中华绒螯蟹与鱼虾不同的是中华绒螯蟹一旦死去便失去食用价值,而鱼虾等水产品死后初期仍可食用,对于这一观点学者们的解释也不尽相同,有学者认为蟹死亡初期体内会产生致病产物“肉毒碱”,但对肉毒碱的具体成分未见报道;也有学者认为死蟹失去食用价值,是因为中华绒螯蟹死亡初期会产生大量有毒生物胺,引起人体中毒。目前,国内外对刚死的中华绒螯蟹是否可以食用的研究几乎空白,以及如何区别蟹的新鲜和腐败状态,这些状态的评价指标与鱼虾是否一致,死后初期变化的内在机理与鱼虾是否相同等在国内外尚未见详细报道。
本研究将从加工特性、感官、理化这三个方面综合探究中华绒螯蟹在鲜活、垂死以及死亡初期的品质变化,从而筛选评价蟹鲜活至死亡初期品质状况的特征指标,以期为中华绒螯蟹鲜度品质评价以及食用安全提供理论依据。
1 材料与方法
1.1材料与仪器
雌、雄性中华绒螯蟹各60只于2014年11月采自松江地区,雌蟹体重(148.39±15.72)g,雄蟹体重(174.84±18.79)g;三氯乙酸、硼酸、高氯酸均为分析纯,国药集团化学试剂有限公司;氢氧化钠、氢氧化钾均为优级纯,国药集团化学试剂有限公司;磷酸二氢钾、磷酸氢二钾均为色谱纯,上海安谱科学仪器公司;17种氨基酸混标均为色谱纯,中国计量科学研究院化学计量与分析科学研究所;8种生物胺标品、9种核苷酸标品均为色谱纯,上海安谱科学仪器公司;实验用水为超纯水。
L-8800型氨基酸自动分析仪日本日立制作所;W2690/5型高效液相色谱仪美国Waters公司;Avanti J-26 XP型台式真空冷冻离心机美国贝克曼公司;乳化机SAII-2型实验室乳化机上海索维机电设备有限公司;HPP108型恒温恒湿培养箱德国Memmer公司;FOSS Kjeltec8400凯氏定氮仪福斯分析仪器公司;SUPELCOSIL LC-18-T液相色谱柱(250 mm×4.6 mm,5 μm)、GL Inertsil ODS-3液相柱(250 mm×4.6 mm,5 μm) 上海安谱科学仪器公司。
1.2实验方法
1.2.1样品前处理中华绒螯蟹用绳子捆绑后放置于恒温恒湿培养箱中,温度20℃,湿度90%,让蟹自然死亡。实验所用的样品分别为鲜活、垂死(半死不活)、死后0、2、5、10、15、24 h的中华绒螯蟹。
其中垂死(半死不活)中华绒螯蟹的判断标准为:解开捆绑中华绒螯蟹的绳子,把蟹放在20℃左右环境中,腹部朝天,刺激中华绒螯蟹,如果中华绒螯蟹不能翻回,则定义为垂死状态;死亡中华绒螯蟹的判断标准为:手夹起蟹壳,让腿自然下垂,若腿、眼睛不动,则定义为死亡状态。
取处于鲜活、垂死、死后0、2、5、10、15、24 h共8种状态的中华绒螯蟹腹部肌肉、蟹黄、蟹膏,0.5 h内完成匀浆机匀浆,之后进行封装,于-80℃的冰箱中储存。鲜活、垂死、死后0、2、5、10、15、24 h样品分别用F、D、D0、D2、D5、D10、D15、D24表示。
1.2.2加工特性测定中华绒螯蟹在八种状态下的失重率以及可食部位得率,计算公式如下。
失重率以生螃蟹计算,并以新鲜状态下中华绒螯蟹的质量作为初始质量。

可食部位(蟹肉、蟹膏)得率是把河蟹熟制后,取螃蟹可食部位,并按以下公式计算,熟制方法:洗去中华绒螯蟹体表污垢,放入不锈钢蒸锅内蒸制20 min。取出蒸熟蟹样,冷却至室温,打开头胸甲,手工剥离其蟹肉、蟹膏。

1.2.3感官评定感官评定参考JCalanc he等[3]的评价方法并作适当修改,10名经过训练的感官评价员组成评定小组,对蟹壳未打开的中华绒螯蟹色泽、气味以及蟹壳打开后中华绒螯蟹的组织结构三项指标进行评价。各个指标的权重分别为0.3、0.4、0.3,最后感官评分为各个指标的权重分之和,具体评分标准见表1。

表1 中华绒螯蟹感官评价表Table 1 Sensory evaluation of Chinese mitten crab
1.2.4pH的测定根据Wenjiao Fan[4]方法稍作修改:5 g肉加入45 mL水,10000 r/min均质2 min,迅速测量。
1.2.5K值的测定K值的测定采用HPLC方法,参考C HEN Dewei等[5]的方法并稍作修改,具体步骤是:3 g样品精确到(0.001 g),加入5%高氯酸(PCA)30 mL,组织分散器(26000 r/min)分散1 min,超声5 min,之后用冷冻离心机离心(4℃,10000 r/min,15 min),将上清液移入小烧杯内。在沉淀内加入5%的PCA 10 mL,按上述步骤重复操作一次,之后将上清液移入小烧杯中与第一次离心的上清液合并。用振荡器充分混匀,上清液进行抽滤,用6 mmol/L的氢氧化钾调pH至5.75,随后定容至50 mL容量瓶中,之后用0.22 μm的水相滤膜过滤,用高效液相色谱仪检测样品中的核苷酸的种类与含量。色谱柱:GL Inertsil ODS-3液相柱:250 mm×4.6 mm,柱温30℃;流速1 mL/min;进样量10 μL;紫外检测器检测波长:245 nm。流动相A为甲醇,B为1.7011 g磷酸二氢钾与2.1773 g磷酸氢二钾定容到1 L,并用高氯酸调节pH5.75。高效液相色谱仪的梯度洗脱程序见表2。

表2 HPLC法检测核苷酸的梯度洗脱程序Table 2 HPLC gradient elution program for nucleotide analysis
1.2.6游离氨基酸的测定根据付娜等[6]的方法稍作修改,称取1 g左右的样品,精确到(0.0001 g),加入5%三氯乙酸(TCA)15 mL,组织分散器(26000 r/min)分散1 min,于4℃冰箱中静置2 h,随后取10 mL上清液,冷冻离心(10000 r/min,4℃),定容,过滤,上机测定。
1.2.7非蛋白氮的测定非蛋白氮(NPN)主要包括游离低分子的肽类、氨基氮、核苷酸及其相关化合物等,而这些小分子物质对风味产生重要的影响。非蛋白氮的测定参照烟江敬子等[7]的方法并做适当修改,1 g左右样品,放入50 mL离心管中,加入10 mL 10%的TCA,用组织分散器(26000 r/min)分散1min,在4℃下静止2 h,之后于10000 r/min、4℃条件下离心15 min,取上清液2 mL加入消化管中,之后加入12 mL浓硫酸、0.4 g硫酸铜、3.5 g硫酸钾,消化2 h,最后用凯氏定氮仪测定数值。
1.2.8挥发性盐基氮(TVBN)含量的测定按GB/T 5009.44-2003半微量法[8]测定。挥发性盐基氮是动物性食品在酶和细菌的作用下腐败过程中,使蛋白质分解而产生氨以及胺类等碱性含氮物质。
1.2.9生物胺的测定参考GB/T 20768-2006的方法,并在检测的7种标准品中加入精胺,精胺的出峰时间为:(33.25±0.15)min,色谱柱:SUPELCOSIL LC-18-T液相色谱柱(250 mm×4.6 mm,5 μm)。
1.3数据处理
用SPSS 19.0软件的单因素方差(One-Way ANOVA)分析各个指标,以平均值±标准偏差(Mean values±S.D.)表示,p<0.05作为差异显著的要求,用SigmaPlot软件绘制各物质含量变化图。
2 结果与讨论
2.1加工特性
中华绒螯蟹的失重率与可食部位得率见图1,从图1中可以看出,以鲜活状态下的中华绒螯蟹质量作为初始质量,鲜活状态下中华绒螯蟹的失重率为0,垂死状态下中华绒螯蟹的失重率为0.13%,随死亡时间的增加,中华绒螯蟹的失重率逐渐增加,死后24 h中华绒螯蟹的失重率为8.12%。

图1 熟制雄性中华绒螯蟹在不同状态下得率与失重率Fig.1 The yield and weight loss of Chinese mitten crabin different states
中华绒螯蟹可食部位得率随死后时间的增加而下降,中华绒螯蟹蟹肉的得率在死后0 h突然下降,蟹膏的得率在死后2 h与死后0 h具有显著性差异(p<0.05),且蟹膏得率在死后24 h仅为6%左右,从图1中可以看出中华绒螯蟹蟹膏得率在死后5 h以后的下降速率要高于蟹肉,从可食部位得率的数据可以初步认为中华绒螯蟹死后蟹膏的降解消耗速率大于蟹肉。
2.2感官评定结果
中华绒螯蟹在不同状态下的感官评分见图2,中华绒螯蟹的感官评分随死亡时间的延长逐渐下降。鲜活中华绒螯蟹的蟹壳成青灰色,平滑而有光泽,蟹膏组织紧密,不流动,具有新鲜中华绒螯蟹特有的气味,无异味。随着死后时间的延长,中华绒螯蟹表面逐渐发黑,失去光泽,蟹膏组织逐渐松散,中华绒螯蟹达到腐败时期,产生氨臭味,并且心脏下面的一层粘膜变得模糊,不透明。中华绒螯蟹的感官评分,在死后5、10 h的下降速度较快,且死后10 h产生明显臭味,此时的整体色泽得分为3.07,气味得分为2.01,蟹壳打开后组织结构得分为3.48,说明死后10 h腐败性气味很明显,但组织结构较好。从图2中可以看出,气味的得分在死后24 h前始终低于整体、色泽和组织结构的得分,说明蟹在死后气味的变化较为明显,其次为色泽的变化,最后到了腐败期蟹膏的组织结构才开始发生明显变化。
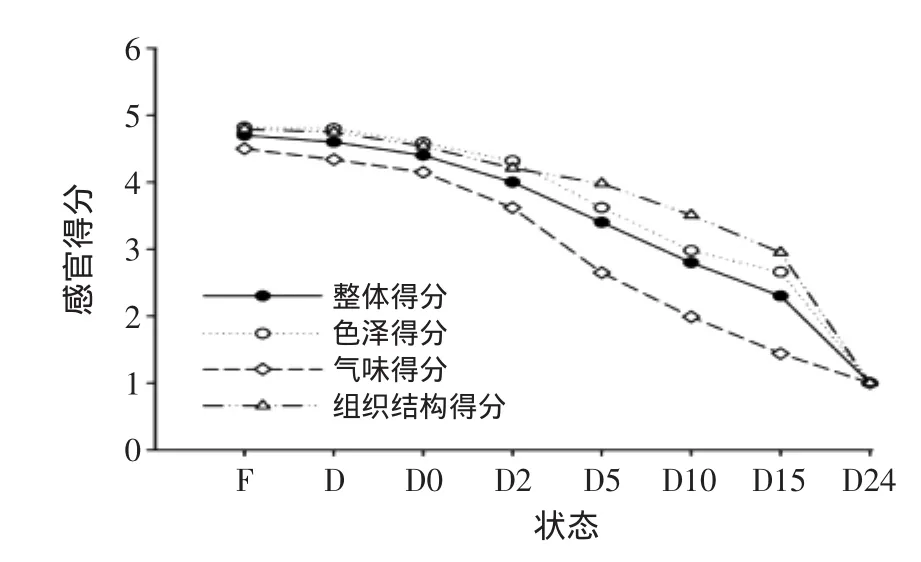
图2 中华绒螯蟹在不同状态下感官评分Fig.2 Sensory evaluation of Chinese mitten crabin different states
2.3新鲜度的变化分析
2.3.1pH中华绒螯蟹在不同状态下pH的变化如图3。从图3中可以看出pH的变化整体呈现先下降后上升的趋势,与鱼虾体内pH的变化趋势较为一致,国内外对鱼虾体内pH的变化过程研究的较为成熟,这种变化是由微生物的作用或自身酶的消化作用引起的。中华绒螯蟹死后初始阶段呼吸作用停止,糖原经过糖酵解作用产生乳酸,以及ATP和磷酸肌酸等物质分解为磷酸等酸性物质的增加,从而pH降低,pH的下降程度与肌肉中糖原的含量有关;之后由于微生物作用,蛋白质和氨基酸等物质分解产生氨及胺类碱性物质,使pH又增长[9]。
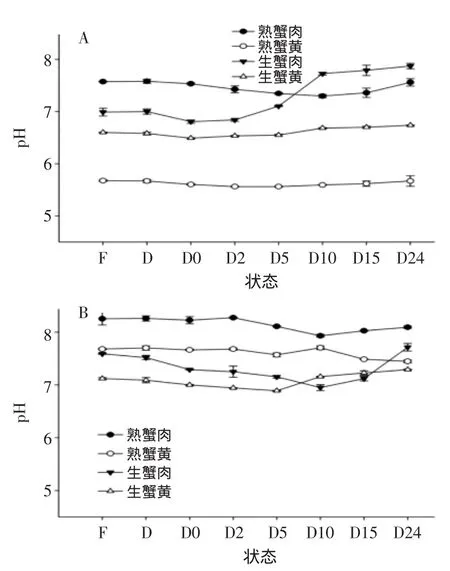
图3 中华绒螯蟹在不同状态下pH的变化Fig.3 Changes of pHextracted from Chinese mitten crabin different states
从图3可以看出,与蟹肉相比,蟹黄的pH几乎没有变化,但蟹肉的变化较蟹黄明显,这可能是由于蟹黄中含油较蟹肉高,高含油量阻止细菌进入内部作用。从整体来看,生蟹肉的变化幅度较熟蟹肉的变化幅度大,这可能是由于蟹肉熟制后体内的一些与代谢有关的酶失活造成的。从图3可以看出蟹体内的pH与鱼存在很大的差异,有研究[10]指出—般活鱼肌肉的pH在7.2~7.4,洄游性的红肉鱼因糖原含量较高(0.4%~1.0%),死后最低pH可达到5.6~6.0,而底栖性白肉鱼糖原较低(0.4%),最低pH为6.0~6.4。
2.3.2K值中华绒螯蟹在鲜活至死后24 h腹部肌肉中K值的变化见图4。中华绒螯蟹在死后初始阶段ATP受体内自身酶的作用发生生物化学变化,K值是(HxR+Hx)对ATP分解产物总含量的百分率,K值越小表示越新鲜。图4所示,随着中华绒螯蟹死后时间的增加,K值呈上升趋势,蟹在鲜活状态下的K值小于10%,这与鱼虾等水产品的初始值相差不大,而蟹死后24 h,已经达到腐败,但是K值不超过50%,而鱼虾等水产品达到腐败阶段的K值均已超过60%。
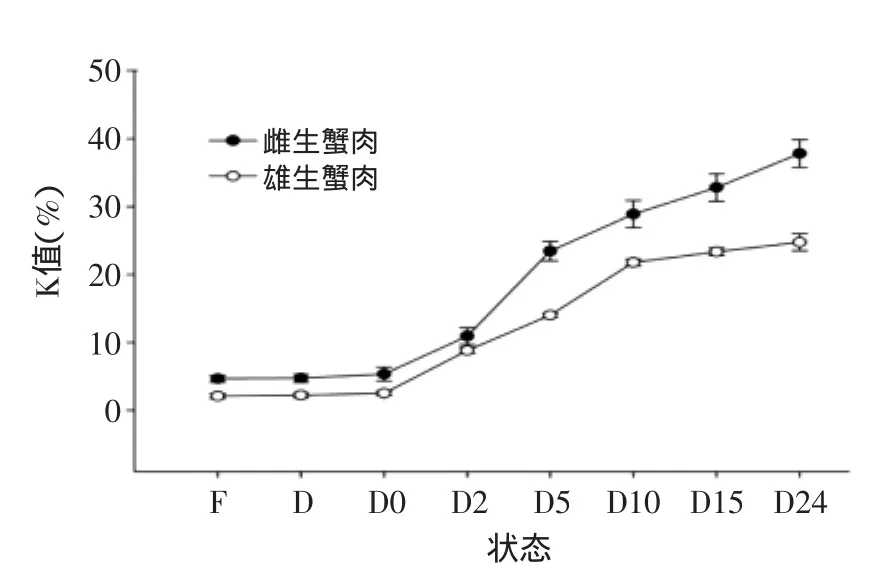
图4 中华绒螯蟹在不同状态下腹部肌肉中K值变化Fig.4 Changes of Kvalue extracted from bellymeat in different states
2.3.3游离氨基酸(TFAA)新鲜雌蟹和雄蟹腹部肌肉中共检测出16种氨基酸,其中苏氨酸、甘氨酸、丙氨酸、精氨酸和脯氨酸是肉中的主要游离氨基酸,这五种氨基酸占总氨基酸含量的87%左右,此实验结果与付娜等[9]的结果较为接近。雌蟹蟹黄中同样检测出16种氨基酸,其中谷氨酸、甘氨酸、丙氨酸、精氨酸脯氨酸是蟹黄中主要的游离氨基酸,这五种氨基酸占总游离氨基酸含量的75%左右,雄蟹蟹膏中共检测出17种氨基酸,较其他多了半胱氨酸,但含量相对较低。
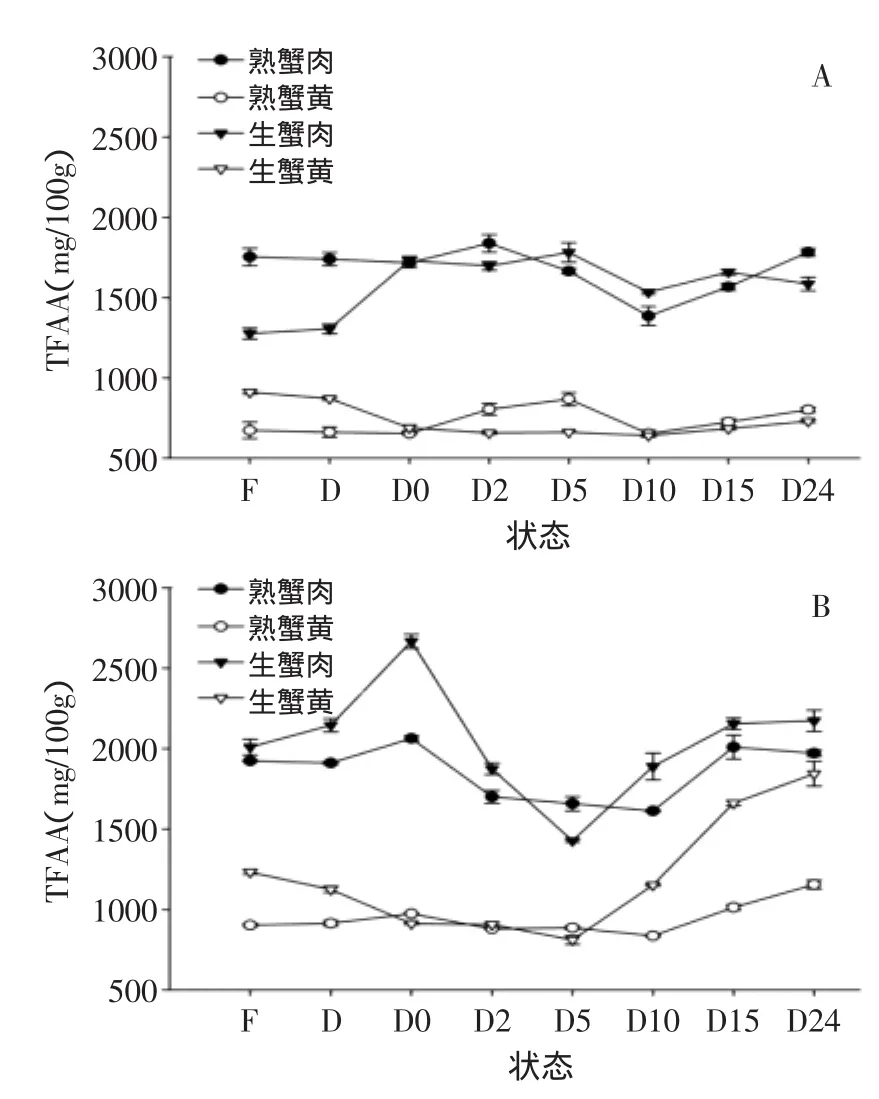
图5 中华绒螯蟹在不同状态下体内TFAA含量的变化Fig.5 Changes in contents of TFAA extracted from Chinese mitten crabin different state
图5显示了中华绒螯蟹在不同状态下体内TFAA的含量变化,从图5中可知熟制中华绒螯蟹蟹肉和生蟹肉中游离氨基酸变化趋势一致,均随死亡时间的增加呈现先增加再下降后增加的趋势,熟制蟹黄和蟹膏的变化趋势一致且与蟹肉相同;生蟹肉和蟹黄的变化并未呈现一致的趋势。TFAA含量的上升可能是因为死亡初期肌肉自溶、蛋白质降解作用造成的;之后由于微生物代谢过程中消耗FAA作为其营养物质,导致TFAA含量下降;之后TFAA含量又上升可能是由于到了腐败后期,微生物代谢产生的蛋白酶类水解蛋白质和肽类,形成FAA,这一趋势和鱼虾的鲜度变化机理相似[11]。
2.3.4非蛋白氮非蛋白氮(NPN)即除去蛋白质的氮,包括游离氨基酸、肽、生物碱、氧化三甲胺、核苷酸等成分中的氮[12]。
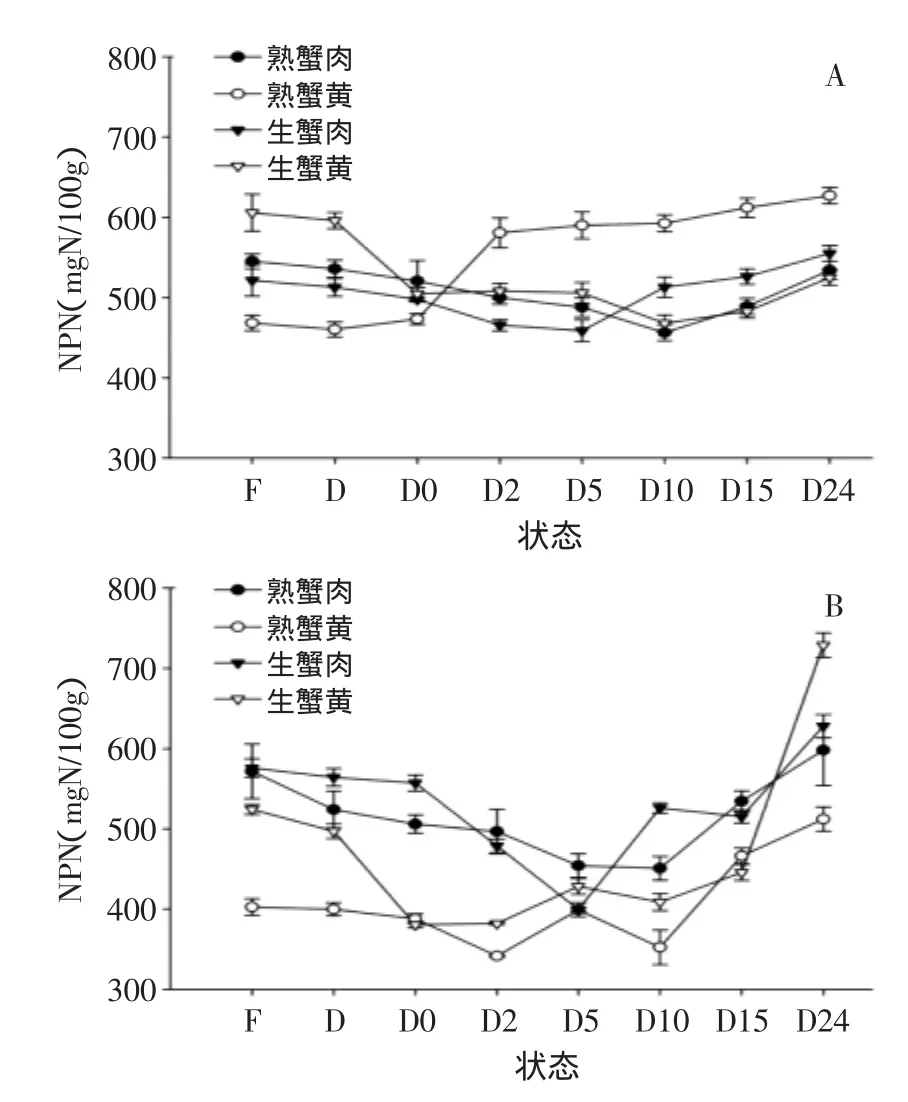
图6 中华绒螯蟹在不同状态下体内NPN含量的变化Fig.6 Changes in contents of NPN extracted from Chinese mitten crabin different states
图6表示了中华绒螯蟹在不同状态下非蛋白氮含量的变化。从结果中可以看出,腹部肌肉中的NPN含量随贮藏时间的增加呈现先下降再升高的趋势,蟹黄和蟹膏的变化没有统一的变化趋势。在中华绒螯蟹死亡初期,蛋白质降解,汁液流失以及微生物代谢等的综合作用,导致NPN含量降低,具体的代谢过程和每种物质对NPN含量变化的作用还需以后实验验证。之后NPN含量增加可能是由于中华绒螯蟹到了腐败阶段蛋白质等生物大分子逐渐被降解,生成氨基酸等小分子含氮化合物,这与TFAA后期变化较为一致。
2.4腐败程度的变化分析
2.4.1挥发性盐基氮挥发性盐基氮是评判肉品新鲜度的一个重要指标,国家标准GB/T 5009.44—2003依据TVBN含量来划分猪肉新鲜度等级。
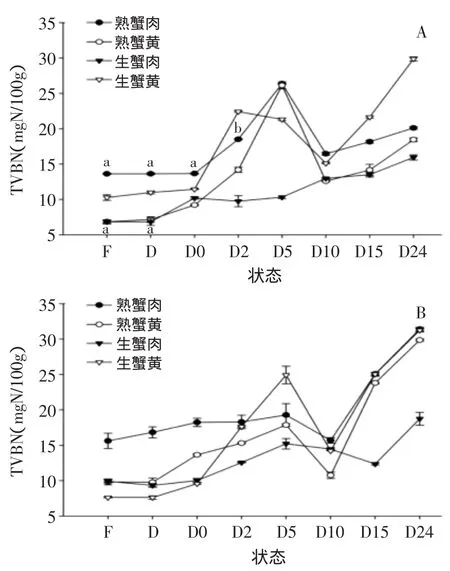
图7 中华绒螯蟹在不同状态下TVBN含量变化Fig.7 Changes in contents of TVBN value from Chinese mitten crab in different states
图7显示了挥发性盐基氮的变化情况,从图7中可知随着蟹死亡时间的增加挥发性盐基氮整体呈现先增加后下降再增加的趋势,这与大多数水产品如鱼虾等水产品趋势有所不同。Özogul F等研究鲈鱼、郭美娟等研究南美白对虾,Charles Odilichukwu R等研究南极磷虾的TVBN值均显示,随贮藏时间的增加TVBN呈现上升趋势。而孟勇等对中华绒螯蟹的TVBN值研究指出,12℃和25℃条件下,TVBN值随贮藏天数的增加而增加,4℃条件下,TVBN值在第1 d略有下降,随后上升,跟本实验较为相似,但对于具体的原因没做具体解释。本实验在10 h出现下降,可能是由于水分的流失以及产生的一些挥发性胺类,对于具体的原因还待进一步探讨。欧盟委员会法规[13]显示消费者最高可接受水产品的TVBN的浓度范围在25~35 mgN/100g,本次实验中华绒螯蟹死后24 h已经出现明显异味,生蟹黄、蟹膏的TVBN值已超过25 mgN/100g,与感官评定结果较为一致。
2.4.2生物胺表3显示了雄性中华绒螯蟹在不同状态下体内(蟹肉、蟹膏混合)有毒生物胺的含量变化,从表3中可以看出中华绒螯蟹在死后5 h内未检出生物胺,在死后10 h检测出腐胺、尸胺、酪胺,而此时结合感官评价,蟹在死后10 h产生明显臭味,但可以发现在死后15 h,检测出的量未达到可引起人体中毒的计量,此检测结果与孟勇等研究中华绒螯蟹生物胺的结果较为相近。可以初步得出结论,中华绒螯蟹死后食用会引起中毒的物质并不是由于生物胺引起的。
3 结论与展望
河蟹的感官评分随死后时间的延长而下降,河蟹在死后10 h出现明显的腐败臭味,死后24 h打开蟹壳,里面的气味达到可接受极限;新鲜和垂死两个状态下,蟹的品质指标几乎无显著性差异。
雌蟹蟹肉,熟制样品pH随死亡时间的增加先下降后上升;K值随死亡时间的增加整体呈现增加趋势,但鲜活、垂死及死后初期河蟹并无显著性差异;TVBN随死亡时间的增加呈现先增加后下降再增加的趋势,转折点分别为D5、D10;NPN含量呈现先下降后增高的趋势,转折点为D10;TFAA在初期无显著性差异,之后逐渐增高,然后出现了下降的趋势,到死后24 h又出现了增高,转折点分别为D2、D10。生样的pH随死亡时间的增加同样先下降后上升;K值随死亡时间的增加而增加;TVBN随死亡时间的增加整体呈增加趋势,但D0、D2、D5无显著性差异;NPN值呈现下降后增高的趋势,转折点为D5;TFAA呈现先增高后下降再增高的趋势。

表3 雄性中华绒螯蟹不同状态下体内8种生物胺含量变化(mg/kg)Table 3 Changes in contents of biogenic amine extracted from male crab in different states(mg/kg)
雌蟹蟹黄,熟制样品pH随死亡时间的增加变化并不显著;TVBN值随死后时间的延长呈现先增加后下降再增加的趋势,转折点分别为D5、D10;NPN呈现上升的趋势;TFAA呈现先增高后下降再增高的趋势,转折点分别为D5、D10。生样pH随死亡时间的增加变化同样不显著;TVBN值呈现先增加后下降再增加的趋势,转折点分别为D2、D10;NPN值呈现先下降后上升的趋势,转折点D10;TFAA呈现先下降后增高的趋势,且变化不明显。
雄蟹蟹肉,熟制样品pH随死亡时间的增加先下降后上升;K值随死亡时间的增加而增加;TVBN值呈现先增高后下降的趋势,转折点分别为D5、D10;NPN值呈现先下降后上升的趋势,转折点为D5,且与D10无显著性差异;TFAA呈现先增高后下降再增高的趋势,转折点分别为D0、D10。生样,pH随死亡时间的增加先下降后上升;TVBN值呈现先增高后下降的趋势,转折点为D5、D15;NPN值呈现先下降后上升的趋势,转折点为D5;TFAA呈现先增高后下降再增高的趋势,转折点分别为D0、D5。
雄蟹蟹膏,熟制样品pH随死亡时间的增加呈现波动变化;K值随死亡时间的增加而增加;TVBN值同样呈现先增高后下降的趋势,转折点分别为D5、D10;NPN值变化趋势不明显,呈现波动性的变化,但D10之后出现明显上升;TFAA呈现先增高后下降再增高的趋势,转折点分别为D0、D10。生样,pH随死亡时间的增加先下降后上升;TVBN值呈现先增高后下降的趋势,转折点分别为D5、D10;NPN值同样在D10之后出现明显上升;TFAA呈现先下降后增高的趋势,转折点为D5。
多数指标均在D5和D10时发生较大改变,表明此时中华绒螯蟹品质有较大变化,中华绒螯蟹在死后10 h进入腐败阶段。
中华绒螯蟹在死亡10 h能检测到生物胺,且直到15 h其体内有毒生物胺的含量较低,不足以引起中毒,但还需进一步验证。
鲜活和垂死状态下的中华绒螯蟹所测的结果显示,两者的差异性不显著,对于鲜活和垂死阶段的中华绒螯蟹品质还有待结合营养、滋味、气味等方面进一步探究,从而筛选出评判中华绒螯蟹死亡前后品质变化的灵敏指标。
[1]Sai-qi Gu,Xi-chang Wang,Ning-ping Tao,et al. Characterization of volatile compounds in different edible parts of steamed Chinese mitten crab(Eriocheirsinensis)[J].Food Research International,2013(54):81-92.
[2]中国渔业年鉴[M].北京:中国农业出版社,2014.
[3]J Calanche,S Samayoa,V Alonso,et al.Assessing the effectiveness of a cold chain for fresh fish salmon(Salmosalar)and sardine(Sardinapilchardus)in a food processing plant[J]. Food Control,2013(33):126-135.
[4]Wenjiao Fan,Junxiu Sun,Yunchuan Chen,et al.Effect of chitosan coating on quality and shelf of silver carp duringfrozen storage[J].Food Chemistry,2009,115(1):66-70.
[5]ChENDewei, Zhangmin, SundarS.Compositional characteristics and nutritional quality of Chinese mitten crab(Eriocheirsinensis)[J].Food Chemistry,2007,103(4):1343-1349.
[6]付娜,王锡昌,陶宁萍,等.蒸制和煮制中华绒螯蟹4个部位中游离氨基酸含量差异性分析[J].食品科学,2013,24:178-181.
[7]江敬子,香川实惠子,松本美铃,等.6種の抽出方法によるスルメイカ生肉エキスとそれらの呈味成分[J].Nippon Suisan Gakkaishi,1995,61(4):619-626.
[8]GB/T5009.44—2003,肉与肉制品卫生标准的分析方法[s].北京:中国标准出版社,2003.
[9]C Ruız-Capillas,A Moral,J Morales,et al.Characterisation of non-protein nitrogen in the Cephalopods volador(Illexcoindetii),pota(Todaropsiseblanae)and octopus(Eledonecirrhosa)[J].Food[10]水产食品学[M].北京:中国农业出版社,2010.
Chemistry,2002(76):165-172.
[11]付娜,王锡昌.电子舌分析和感官评价在游离氨基酸对中华绒螯蟹整体滋味贡献评价中的研究[J].食品工业科技,2014,20:91-96.
[12]刘志远.中国对虾贮藏保鲜过程中肌肉蛋白质组学研究[D].浙江:浙江工商大学,2013.
[13]Official Journal of European Union.Commission Regulation(EC)No.2074/2005 of 5 December 2005 on total volatile basic nitrogen(TVBN)limit values for certain categories of fishery products and specifying the analysis methods to be used[S]. 2005.L338,36-39.
Quality evaluation of fresh and dead Chinese mitten crab(Eriocheirsinensis)
WANG Ya-hui,WANG Xi-chang*,WANG Shuai,GUO Yan-ru,ZHAO Liang,ZENG Si-si
(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
The pH,free amino acids(FAA),non-protein nitrogen(NPN),total-volatile basic nitrogen(TVBN),K values,sensory evaluation and biogenic amine of E.sinensis were studied to evaluate the quality of Chinese mitten crab(Eriocheirsinensis)at different stages including fresh,dying,zero,2,5,10,15 and 24 h after death. The results showed that the sensory evaluation was decreased with the increasing of death time,the noticeable odor of corruption at the 10 h after death,after the death of 24 h open crab shells,inside the smell of meet acceptable limit.The difference was not significant between fresh and dying stage,quality deterioration mainly occurs after death.The biogenic amines were detected at the 10 h after death and the 15 h after death the low levels of biogenic amines cannot cause poisoning.Most indicators have occurred major changes at the 5 h after death and the 10 h after death,indicating that there were major changes in the quality of the crab.Sensory score,K value,pH,TVBN valuewere displayed that the crab of 10 h after death entered corruption stage.
Chinese mitten crab(Eriocheirsinensis);sensory evaluation;flavour;fresh;death;quality evaluation
TS201.2
A
1002-0306(2015)18-0131-07
10.13386/j.issn1002-0306.2015.18.018
2014-12-23
王亚会(1989-),女,在读硕士研究生,研究方向:食品营养与品质评价,E-mail:18201803997@163.com。
王锡昌(1964-),男,博士,教授,研究方向:食品营养与品质评价,E-mail:xcwang@shou.edu.cn。
自然基金(31471608);上海市农委中华绒螯蟹产业技术体系(D-8003-10-0208)。
