膳食5'-核苷酸对酒精性肝损伤大鼠肠道菌群的影响
2015-11-02蔡夏夏徐美虹张召锋
蔡夏夏,鲍 雷,王 楠,徐美虹,李 迪,武 欣,张召锋,李 勇*
(北京大学公共卫生学院营养与食品卫生学系,北京 100191)
膳食5'-核苷酸对酒精性肝损伤大鼠肠道菌群的影响
蔡夏夏,鲍 雷,王 楠,徐美虹,李 迪,武 欣,张召锋,李 勇*
(北京大学公共卫生学院营养与食品卫生学系,北京 100191)
目的:研究膳食5'-核苷酸对酒精性肝损伤大鼠肠道菌群的影响,并进一步探讨可能的作用机制。方法:雄性Wistar大鼠随机分为对照组、酒精组、葡萄糖等热量对照组、普通饲料组、质量分数0.04%、0.16% 5'-核苷酸干预组,连续饲养7 周,测定大鼠体质量、脏体比、血清乙醇体积分数、血清转氨酶活力、血脂水平及总蛋白含量等相关指标;平板培养大鼠粪便中的乳酸杆菌、双歧杆菌、大肠杆菌、肠球菌,计算大鼠粪便中各种细菌的菌落数。结果:膳食5'-核苷酸能够增加酒精引起的大鼠体质量降低,轻度抑制血清乙醇体积分数的升高,抑制酒精引起丙氨酸氨基转移酶、乳酸脱氢酶活力和甘油三酯水平等升高(P<0.05),增加血清总蛋白、白蛋白及球蛋白含量(P<0.05);并能够增加肝体比,减少盲体比(P<0.05);膳食5'-核苷酸能够增加肠道乳酸杆菌数量,同时减少大肠杆菌及肠球菌的数量(P<0.05)。结论:膳食5'-核苷酸能够改善酒精引起的大鼠肝脏损伤,调节肠道菌群可能是其作用机制之一。
5'-核苷酸;酒精性肝损伤;肠道菌群;丙氨酸氨基转移酶;酒精性脂肪性肝炎
酒精性肝损伤(alcoholic liver injury,ALD)是由于长期大量饮酒所导致的肝脏疾病,通常包括脂肪肝、酒精性肝炎、肝纤维化、肝硬化,严重时甚至造成肝功能衰竭[1]。过量或有害的酒精摄入被认为是全球致死致残的最重要危险因素之一,每年也导致了全球大约250万人死亡,伤残调整生命年高达6 940万人年[2]。我国对全国酒精性肝病发病情况、临床特征等进行的多中心回顾研究显示,2000-2004年ALD患者占同期肝病患者比例逐年升高,轻症酒精性肝病、酒精性脂肪肝、酒精性肝炎、酒精性肝硬化分别占11.2%、22.6%、28.8%、37.4%,ALD发病率也呈逐年上升趋势[3]。
正常情况下,肝脏参与了肠道来源的毒素和微生物产物的解毒,其独一无二的解剖位置、血液供给和肝脏结构使肝细胞和肝窦内皮细胞不仅暴露于肠道来源的代谢必需营养素,也暴露于肠道来源的微生物产物[4]。因此,越来越多的研究也表明,肝脏疾病包括ALD等与肠-肝轴的紊乱密切相关[5-7]。人体肠道中定居着100万亿个微生物[8],肠道菌群的稳定对于肠-肝轴的稳定具有重要作用[9]。人群研究证实,酒精诱导的肝脏损伤患者与正常人相比肠道菌群改变,双歧杆菌、乳酸杆菌等有益菌数量明显减少,短期口服补充双歧杆菌后肝脏转氨酶、乳酸脱氢酶活力和总胆红素含量明显降低[10]。动物及体外研究也证实酒精能够诱导内毒素血症、肠道菌群改变、肝脏脂肪变性及肠道上皮细胞屏障功能障碍[11-13]。因此,肠道菌群将是治疗酒精性肝病的潜在作用靶点。
膳食核苷酸被认为是对胃肠道细胞生长、修复和分化有重要作用的非蛋白含氮化合物[14]。它能够加速老年大鼠因食物剥夺后肠道的修复速率[15],亦能够改善配方食品组婴幼儿肠道菌群的组成[16],而且,体外研究证实,补充核苷酸能够刺激体外双歧杆菌的生长,具有直接的益生效应[17]。所以,本实验通过富含5'-核苷酸的饲料喂养酒精性肝损伤大鼠,观察膳食5'-核苷酸对酒精性肝损伤大鼠的影响及可能作用机制。
1 材料与方法
1.1动物、材料与试剂
SPF级雄性Wistar大鼠(动物合格证号:SCXK11-00-0004;实验动物使用许可证号:SYXK(京)2006-0025;实验动物生产许可证号:SCXK(京)2006-0008),体质量250~300 g,由北京大学医学部实验动物中心提供,饲养地点为北京大学医学部实验动物科学部,动物每3 只一笼,自由饮水和摄食,饲养环境为SPF环境,节律光照,室温(22±1)℃,相对湿度40%~50%。动物实验通过北京大学医学部伦理委员会审核,动物饲养管理及实验操作符合《北京市实验动物管理条例》。
对照组动物饲料为AIN-93G饲料(AIN-93G饲料组分(以下均为质量分数):20.0%酪蛋白、13.2%糊化玉米淀粉、10.0%蔗糖、39.7%玉米淀粉、5.0%纤维素、7%豆油、3.5%矿物质混合物、0.3% L-胱氨酸、1.0%维生素混合物、0.25%酒石酸胆碱、0.001 4%叔丁基对苯二酚)、普通饲料组饲以普通大鼠维持饲料(普通大鼠维持饲料组分:玉米、面粉、大豆、鱼粉、草粉、碳酸钙、磷酸氢钙、矿物盐、维生素等,主要参照GB 14924.3-2010《实验动物 配合饲料营养成分》配制),饲料合格证号SCXK(京)-2009-2008,膳食核苷酸干预组饲料以AIN-93G饲料(由北京华阜康生物科技股份有限公司提供)配方为基础,分别添加0.04%、0.16%的混合5'-核苷酸。
混合核苷酸(5'-腺嘌呤核苷酸(adenosine 5'-monophosphate5'-AMP)、5'-胞嘧啶核苷酸(cytosine 5'-nucleotides,5'-CMP)、5'-鸟嘌呤核苷酸二钠(guanosine 5'-monophosphate disodium,5'-GMPNa2)、5'-尿嘧啶核苷酸二钠(uridine 5'-monophosphate disodium,5'-UMPNa2)的质量比为22.8∶26.6∶20.4∶30.2) 大连珍奥生物工程股份有限公司;无水乙醇(分析纯) 国药集团化学试剂北京有限公司;EnzyChromTM乙醇检测试剂盒(ECET-100) 美国Bioassay Systems公司;伊红美蓝琼脂(HB0107)、乳酸杆菌LBS琼脂(HB0385)、双歧杆菌BS培养基(HB0394)、肠球菌琼脂(HB0133) 青岛海博生物技术有限公司。
1.2动物分组及处理
SPF级雄性Wistar大鼠42 只,适应性喂养2 周,随机分为对照组、酒精组、葡萄糖等热量组、普通饲料组及0.04%、0.16%(质量分数,下同)5'-核苷酸干预组,每组7 只,除对照组和葡萄糖等热量组外,其余28 只大鼠以50%乙醇灌胃,乙醇初始灌胃量为2 g/(kg·d)(以体质量计,下同),后逐渐增加剂量,2 周后达到8 g/(kg·d),维持此剂量,每天1~2 次灌胃,继续干预5 周,开始灌胃乙醇记为第1周第1天,结束时为第7周。对照组、酒精组和葡萄糖等热量组大鼠喂养AIN-93G饲料,普通饲料组喂养国标规定配方的普通大鼠维持饲料(含一定量的核苷酸),5'-核苷酸干预组大鼠饲料是在AIN-93G饲料基础上添加不同剂量5'-核苷酸所制成。
1.3样本采集
于第48天收集各组大鼠新鲜粪便,置于无菌EP管中保存;干预7 周后,禁食12 h,经股动脉采血后颈椎脱臼处死全部大鼠,离心得血清,迅速留取大鼠肝脏,完整盲肠并称质量,按公式(1)、(2)分别计算大鼠的肝体比和盲体比。
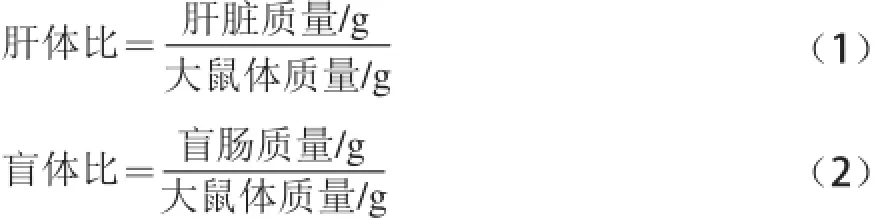
1.4相关指标测定
1.4.1一般情况观察
实验过程中每周观察各组大鼠的一般情况,包括毛色、精神状态、摄食及日常活动情况等。每周称量一次大鼠体质量、进食量。
1.4.2血清乙醇体积分数测定
在干预第45天将酒精组、普通饲料组及0.04%、0.16% 5'-核苷酸干预组大鼠用50%乙醇灌胃后0.5、1、2、3 h不同时间点进行尾静脉采血,每次采血量约为0.5 mL,3 000 r/min离心10 min得血清,按照EnzyChromTM乙醇检测试剂盒说明书进行血清乙醇体积分数测定。
1.4.3血清生化指标测定
实验结束股动脉采血,3 000 r/min离心10 min,分离血清,使用全自动生化仪检测血清生化指标,包括血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)活力及总胆红素(total bilirubin,TBIL)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、球蛋白(globulin,GLB)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)水平,乳酸脱氢酶(lactate dehydrogenase,LDH)活力。
1.4.4大鼠肠道菌群培养
按照培养基说明配制不同菌种专用培养基,取大鼠新鲜粪便0.1 g,加入10 mL无菌生理盐水中,即为10-2g/mL质量浓度稀释菌液。将装有稀释菌液的EP管置于漩涡振荡器上充分振荡,使其均质化后,再依次进行10 倍梯度稀释至10-6g/mL。双歧杆菌使用双歧杆菌BS培养基培养,采用10-4、10-5、10-6g/mL 3 个质量浓度,点样体积2 ☒L;乳酸杆菌采用10-3、10-4、10-5g/mL 3 个质量浓度,滴种5 ☒L标本液于乳酸杆菌LBS培养基上;肠杆菌、肠球菌分别使用伊红美蓝培养基和肠球菌培养基培养,均采用10-4、10-5g/mL两个质量浓度,点样体积5 ☒L。肠杆菌、肠球菌置于37 ℃生化培养箱内倒置培养24 h。双歧杆菌、乳杆菌置于37 ℃恒温厌氧罐内倒置培养48 h。培养结束后,观察计数,记录每克粪便的菌落数,以菌落形成单位(colony forming unit,CFU)表示。按照公式(3)、(4)进行细菌计数,并取对数转换(lg(CFU/g))进行统计分析。

1.5统计学处理
2 结果与分析
2.1膳食5'-核苷酸对酒精性肝损伤大鼠体质量的影响
实验期间,酒精组大鼠出现多饮、少尿、消瘦、活动减少,精神萎靡,毛色杂乱无光泽的症状,5'-核苷酸干预组大鼠毛色较光泽,状态较活跃,饮水量正常,尿量较酒精组增多,总体状态有所缓解。
第0周至第7周各组大鼠的体质量变化如图1所示,实验期间对照组和葡萄糖等热量组大鼠体质量增长明显,酒精组体质量增长缓慢甚至下降。干预第3~7周,酒精组体质量明显低于对照组(P<0.05),干预第6、7周,0.04% 5'-核苷酸干预组与酒精组相比体质量明显增加(P<0.05)。

图1 大鼠体质量-时间变化图(n=7)=7Fig.1 Effect of administration for 7 weeks on body weight in rats (n = 7)
2.2膳食5'-核苷酸对酒精性肝损伤大鼠血清乙醇体积分数的影响
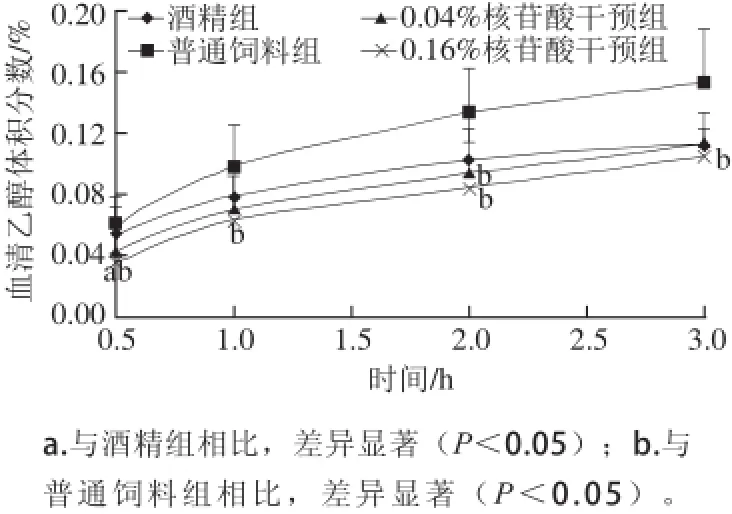
图2 大鼠血清乙醇体积分数-时间变化图(n=7)=7Fig.2 Plots of serum alcohol concerntration against post-administration time (n = 7)
如图2所示,在灌胃乙醇后0.5~2 h,与酒精组和普通饲料组相比,5'-核苷酸干预组血清乙醇体积分数上升缓慢,0.16% 5'-核苷酸干预组有统计学差异(P<0.05),0.04% 5'-核苷酸干预组2 h时血清乙醇体积分数亦明显低于普通饲料组,但是在2 h后5'-核苷酸干预组与酒精组相比血清乙醇体积分数下降无显著差异。
2.3膳食5'-核苷酸对酒精性肝损伤大鼠肝脏功能和血脂代谢相关指标的影响

表1 肝功能及血脂代谢相关指标(n =7)Table 1 Parameters related to liver function and lipid metabolism (n = 7)
如表1所示,酒精组大鼠血清A L T、T B I L、TG、LDH水平与对照组相比明显升高(P<0.05),TP、ALB、GLB及HDL-C水平较对照组明显降低(P<0.05)。普通饲料组ALT、TBIL、ALB与酒精组有同样的趋势。与酒精组相比,核苷酸干预能够明显降低ALT、TBIL、TG、LDH水平,并能够增加TP、ALB及HDL-C水平(P<0.05)。
2.4膳食5'-核苷酸对酒精性肝损伤大鼠脏体比的影响

图3 各组大鼠脏体比(n=7)=7Fig.3 Organ weight/body weight ratios of rats in each group (n = 7)
如图3所示,5'-核苷酸干预组大鼠肝体比较普通饲料组、葡萄糖等热量组明显升高(P<0.05);0.16% 5'-核苷酸干预组大鼠肝体比明显高于酒精组(P<0.05)。酒精组和普通饲料组盲体比明显高于对照组及葡萄糖等热量组(P<0.05);0.04%、0.16% 5'-核苷酸干预组盲体比较普通饲料组明显下降(P<0.05),其中0.04% 5'-核苷酸干预组与酒精组相比盲体比明显下降(P<0.05)。
2.5膳食5'-核苷酸对酒精性肝损伤大鼠肠道菌群数量的影响

表2 大鼠粪便肠道菌群数量(n==77)Table 2 Gut flora in feces (n == 77)lg(CFU/g)
如表2所示,与对照组相比,酒精组大鼠粪便乳酸杆菌数量明显减少(P<0.05),肠球菌及大肠杆菌数量明显增多(P<0.05)。膳食补充不同剂量5'-核苷酸后,大鼠粪便乳酸杆菌数量较酒精组明显增多(P<0.05),同时肠球菌及肠杆菌数量较酒精组明显减少(P<0.05)。普通饲料组肠道菌群较酒精组没有明显改善。
3 讨 论
酒精对人体的生理和健康具有复杂的影响。酒精不仅仅能够使人成瘾,也是一种胎儿致畸物[18]和成人神经毒素,亦是肝脏和心血管疾病、炎症、骨流失和骨折的致病因素。有研究显示,酗酒者日常每天摄入的能量有50%来自酒精,所以容易导致营养不良[19]。本研究采用酒精灌胃后,大鼠体质量增长缓慢,在第7周甚至有下降趋势,说明酒精组大鼠出现营养不良状况,添加5'-核苷酸的饲料喂养大鼠后,大鼠体质量较酒精组明显增加,这说明核苷酸能够改善酒精所引起的大鼠营养不良。
人体摄入的酒精大量由小肠吸收入肝脏代谢,长期过量酒精摄入会损伤肝脏解毒功能及脂质代谢的功能。给大鼠每天饲喂含酒精的饲料后,肝脏脂肪含量进行性增多,而且在早在第2周组织学就能观察到脂肪变性,且血清ALT活力升高,第8周即出现酒精性脂肪性肝炎,血清碱性磷酸酶活力亦明显升高[5]。本研究结果显示,大鼠在灌胃酒精7 周时血清ALT、LDH含量和TBIL水平明显升高,TP、ALB、GLB水平明显降低,提示酒精灌胃导致大鼠肝脏功能受损;而且血清TG水平明显升高,HDL-C水平明显降低,提示酒精灌胃致使大鼠肝脏脂质代谢能力亦受损。5'-核苷酸干预组大鼠ALT、LDH活力和TBIL、TG水平较酒精组明显降低,TP、ALB、GLB水平明显升高,这与之前本课题组研究结果类似[20-21]。此外,与酒精组相比,5'-核苷酸干预组的肝体比也明显升高,5'-核苷酸干预组大鼠经酒精灌胃后血乙醇体积分数上升缓慢。所以,膳食补充5'-核苷酸能够改善酒精引起的肝脏功能损伤,调节肝脏脂质代谢,促进肝脏蛋白质的合成以及肝脏修复。
肝脏70%的血液供应来自于肠道,是防御肠道病原的第一道防线[4]。正常情况下,肝脏参与了肠道来源毒素和微生物产物的解毒,通过肝细胞和枯否细胞的形式吸收组织细胞的损伤和炎症因子。 Kirpich等[10]的人群研究证实,饮酒者与正常对照组相比粪便中双歧杆菌、乳酸杆菌、肠球菌均明显减少。动物实验证实日常酒精消耗会影响结肠黏膜微生物构成,肠道菌群失调是酒精诱导的内毒素血症的重要机制之一[12],而且酒精诱导的肠泄露和内毒素血症在脂肪性肝炎之前已经发生,它们并不是由酒精性脂肪性肝炎所导致,说明酒精所致的肠泄露和内毒素血症很可能是酒精性脂肪性肝炎发生的协同因素[5]。革兰氏阴性菌是内毒素的主要来源,本研究粪便肠道菌群培养结果显示,酒精组大鼠粪便中乳杆菌较对照组及等热量组明显降低,肠球菌及革兰氏阴性菌大肠杆菌明显增多,进一步证明了酒精组大鼠肠道菌群紊乱,革兰氏阴性菌数量增多,双歧杆菌及乳杆菌等有益菌减少。膳食核苷酸补充能够增加DNA和RNA的合成,通过增加核苷酸库,提高核苷酸的利用率,增强肠道细胞的生长和分化[15]。添加核苷酸能够直接抑制婴幼儿拟杆菌-卟啉单胞菌属-普氏菌属细菌的生长,促进双歧杆菌生长[16]。给C57BJ/6N雄性小鼠喂食含有5%乙醇的Lieber-DeCarli液体饲料8 周,在喂养最后两周给予鼠李糖乳杆菌能够明显抑制酒精诱导的内毒素血症和肝脏脂肪变性发生,改善肝脏功能[13]。以上核苷酸促进双歧杆菌的研究主要是针对婴幼儿所进行的,或者更多是体外研究,动物体内研究甚少,本研究结果中,无论是酒精组还是5'-核苷酸干预组大鼠粪便中双歧杆菌数量并没有明显差异,该结果可能是物种差异性所致,需要进一步实验验证。但是与酒精组相比,5'-核苷酸干预组乳酸杆菌数量较酒精组明显增多,肠球菌和大肠杆菌数量明显减少,对肠道菌群的改善作用较明显,而且优于普通饲料组。促进肠道菌群结构的改善,进而缓解内毒素血症所致的肝脏功能障碍可能是5'-核苷酸保护酒精性肝损伤的机制之一。
本研究发现,普通饲料组大鼠在灌胃酒精后,体质量增长缓慢甚至下降,血清乙醇体积分数明显高于5'-核苷酸干预组,肝脏功能及血脂代谢相关指标、粪便中肠道菌群数量较酒精组亦没有明显改善,甚至有加重趋势。在国内,AIN-93G大鼠饲料与符合GB 14924.3-2010的普通大鼠维持饲料均适用于维持大小鼠生长,目前并没有相关文献比较二者对大鼠生长的影响,二者原料不同,且AIN-93G中酪蛋白含量为20%,普通大鼠维持饲料中粗蛋白含量≥18%,其余营养成分含量接近。普通大鼠维持饲料组分为玉米、面粉、大豆、鱼粉、草粉、碳酸钙、磷酸氢钙、矿物盐、维生素等,原料里可能含有一定比例的核苷酸,本研究结果并没有发现其能够改善酒精性肝损伤及肠道菌群紊乱,该结果仅能提示普通饲料喂养并不能改善大鼠酒精性肝损伤及肠道菌群紊乱。由于普通饲料组大鼠饲喂的基础饲料与酒精组及5'-核苷酸干预组基础饲料虽然营养成分相近,但原料不同,故三者间并不具有可比性,该结果还需要更多的动物研究证明。
本实验采用50%乙醇灌胃,成功诱导大鼠肝脏功能损伤,实验结果证明膳食添加5'-核苷酸可以有效降低大鼠血清转氨酶、乳酸脱氢酶活力和血脂水平,促进肝脏细胞再生,缓解乙醇灌胃后血清乙醇体积分数的升高,并发现5'-核苷酸可能通过增加乳酸杆菌等有益菌数量,降低肠杆菌、肠球菌等有害菌数量来改善肠道菌群构成,促进肠道恢复稳态,从而促进肝脏修复。以上结果为5'-核苷酸应用于酒精性肝损伤的临床营养治疗提供了实践证明和理论依据,但是需要进一步在体外及人群实验中得到证实。
[1] 厉有名, 范建高, 王炳元, 等. 酒精性肝病诊疗指南(2010年1月修订)[J].现代医药卫生, 2011, 27(6): 801-804.
[2] TORRUELLAS C, FRENCH S W, MEDICI V. Diagnosis of alcoholic liver disease[J]. World Journal of Gastroenterology, 2014, 20(33):11684-11699.
[3] 全国酒精性肝病调查协作组. 全国酒精性肝病的多中心调查分析[J].中华消化杂志, 2007, 27(4): 231-234.
[4] SON G, KREMER M, HINES I N. Contribution of gut bacteria to liver pathobiology[J]. Gastroenterology Research and Practice, 2010: 1-13.
[5] KESHAVARZIAN A, FARHADI A, FORSYTH C B, et al. Evidence that chronic alcohol exposure promotes intestinal oxidative stress,intestinal hyperpermeability and endotoxemia prior to development of alcoholic steatohepatitis in rats[J]. Journal of Hepatology, 2009, 50(3):538-547.
[6] KESHAVARZIAN A, HOLMES EW, PATEL M, et al. Leaky gut in alcoholic cirrhosis: a possible mechanism for alcohol-induced liver damage[J]. American Journal of Gastroenterology, 1999, 94(1):200-207.
[7] MIELE L, VALENZA V, la TORRE G, et al. Increased intestinal permeability and tight junction alterations in nonalcoholic fatty liver disease[J]. Hepatology, 2009, 49(6): 1877-1887.
[8] CANI P D, DELZENNE N M. Gut micro☒ora as a target for energy and metabolic homeostasis[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2007, 10(6): 729-734.
[9] RIORDAN S M, WILLIAMS R. The intestinal flora and bacterial infection in cirrhosis[J]. Journal of Hepatology, 2006, 45(5): 744-757.
[10] KIRPICH I A, SOLOVIEVA N V, LEIKHTER S N, et al. Probiotics restore bowel flora and improve liver enzymes in human alcoholinduced liver injury: a pilot study[J]. Alcohol, 2008, 42(8): 675-682.
[11] FLEMING S, TORATANI S, SHEA-DONOHUE T, et al. Pro- and anti-inflammatory gene expression in the murine small intestine and liver after chronic exposure to alcohol[J]. Alcoholism: Clinical and Experimental Research, 2001, 25(4): 579-589.
[12] MUTLU E, KESHAVARZIAN A, ENGEN P, et al. Intestinal dysbiosis: a possible mechanism of alcohol-induced endotoxemia and alcoholic steatohepatitis in rats[J]. Alcoholism: Clinical and Experimental Research, 2009, 33(10): 1836-1846.
[13] WANG Yuhua, KIRPICH I, LIU Yanlong, et al. Lactobacillus rhamnosus GG treatment potentiates intestinal hypoxia-inducible factor, promotes intestinal integrity and ameliorates alcohol-induced liver injury[J]. American Journal of Pathology, 2011, 179(6): 2866-2875.
[14] MANZANO M, ABAD☒A-MOLINA A C, OLIVARES E G, et al. Dietary nucleotides accelerate changes in intestinal lymphocyte maturation in weanling mice[J]. Journal of Pediatric Gastroenterology and Nutrition, 2003, 37(4): 453-461.
[15] ORTEGA M A, NUNEZ M C, GIL A, et al. Dietary nucleotides accelerate intestinal recovery after food deprivation in old rats[J]. Journal of Nutrition, 1995, 125(6): 1413-1418.
[16] SINGHAL A, MACFARLANE G, MACFARLANE S, et al. Dietary nucleotides and fecal microbiota in formula-fed infants: a randomized controlled trial[J]. American Journal of Clinical Nutrition, 2008, 87(6):1785-1792.
[17] GIL A. Modulation of the immune response mediated by dietary nucleotides[J]. European Journal of Clinical Nutrition, 2002,56(Suppl 3): 1-4.
[18] 董文红, 赵洁, 赵佳夕, 等. 外源性核苷酸对酒精发育毒性的拮抗作用[J]. 北京大学学报: 医学版, 2012, 44(3): 426-430.
[19] BUJANDA L. The effects of alcohol consumption upon the gastrointestinal tract[J]. American Journal of Gastroenterology, 2000,95(12): 3374-3382.
[20] 赵明, 刘志刚, 张佳丽, 等. 口服核苷酸降血脂作用的实验研究[J].中国预防医学杂志, 2009, 10(12): 1124-1126.
[21] 江清浩, 林兵, 李勇, 等. 外源性5'-核苷酸促进大鼠酒精性肝损伤的修复[J]. 营养学报, 2011, 33(4): 349-353.
Effects of Dietary 5'-Nucleotides on Gut Microbiota in Rats with Ethanol-Induced Liver Injury
CAI Xiaxia, BAO Lei, WANG Nan, XU Meihong, LI Di, WU Xin, ZHANG Zhaofeng, LI Yong*
(Department of Nutrition and Food Hygiene, School of Public Health, Peking University, Beijing 100191, China)
Purpose: To observe the effects of dietary 5'-nucleotides on the gut microbiota of rats with alcoholic liver injury. Methods: Male Wistar rats were given either alcohol or glucose by gavage for 7 weeks. A subgroup of rats was also fed with diets including 0.04% or 0.16% 5'-nucleotides. Body weights, liver to body weight ratio, and the levels of serum alcohol concentration, transaminase activities, triglycerides and total proteins were tested. Stool cultures were performed at the 7thweek, and the colony-forming units per gram stool were determined. Results: The alanine aminotransferase,triglycerides, lactate dehydrogenase and total bilirubin were significantly elevated, and total proteins, albumin and globulin were significantly decreased in alcoholic live injury group when compared to vehicle or glucose groups. Dietary 5'-nucleotides could increase body weights and the ratio of liver weight to body weight, and decrease the levels of serum ethanol, alanine aminotransferase, triglycerides, lactate dehydrogenase and total bilirubin in rats with alcoholic live injury. Total protein, albumin and globulin were significantly increased in nucleotide groups when compared to alcoholic live injury group. Nucleotide groups had significantly increased number of benefical lactobacilli, and reduced number of pathogenic Escherichia coli and enterococci. Conclusion: Dietary 5'-nucleotides could improve ethanol-induced liver injury, and the mechanism may be associated with regulation of the gut microbiota.
5'-nucleotides; alcoholic liver injury; gut microbiota; alanine aminotransferase; alcoholic steatohepatitis
R151.2
A
1002-6630(2015)15-0212-05
10.7506/spkx1002-6630-201515039
2014-10-30
蔡夏夏(1988—),女,博士研究生,研究方向为营养与疾病。E-mail:shuiruoran8886@126.com
李勇(1958—),男,教授,博士,研究方向为营养与疾病。E-mail:liyong@bjmu.edu.cn
