一株费氏丙酸杆菌生长特性及其代谢物抑菌作用分析
2015-11-02郑丽雪王荆楚时慧佳
郑丽雪,王荆楚,时慧佳,曹 雪,齐 斌*
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.苏州市食品生物技术重点实验室,江苏 常熟 215500;3.吉林中粮生化有限公司,玉米深加工国家工程研究中心,吉林 长春 130033)
一株费氏丙酸杆菌生长特性及其代谢物抑菌作用分析
郑丽雪1,2,王荆楚2,时慧佳2,曹 雪3,齐 斌1,*
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.苏州市食品生物技术重点实验室,江苏 常熟 215500;3.吉林中粮生化有限公司,玉米深加工国家工程研究中心,吉林 长春 130033)
对一株费氏丙酸杆菌 生长特性及其代谢物抑菌作用进行研究。结果表明:该菌株生长周期约为10 d,第1~3天为其对数生 长期,第4~8天为菌体生长的稳定期,第9~10天为衰亡期。在生长过程中,菌体利用糖的速率很快,还原糖在发酵1 d内几乎被消耗殆尽,发酵液pH值在发酵 的第1天下降到4.6左右,此后一直到第10天,pH值基本稳定在4.6左右。在同等条件下,该 丙酸杆菌代谢物对大肠杆菌的 抑制作用优于对金黄色葡萄球菌和酵母菌的抑制作用。对代谢产物的分析结果表明,发酵产物中抑菌物质除了丙酸之外,还存在其他物质,初步判定为细菌素。
丙酸杆菌;生长特性;抑菌物质;细菌素
近年来,关于丙酸杆菌代谢物的研究报道很多,贾彩凤[1]、梁新乐[2]等做了丙酸杆菌代谢物作为食品防腐剂及在食品发酵工业中的应用研究,Wang Peng[3]、梁泽鑫[4]等针对丙酸杆菌产酸特性进行了研究,其他的研究工作主要集中在丙酸杆菌发酵代谢物抑菌作用的研究方面[5-12]。丙酸杆菌代谢产物中起到抑菌作用的主要物质为细菌素。细菌素是由细菌代谢产生,对同种或近源种有特异性抑制杀菌作用的蛋白质或多肽。由乳酸菌产生的多种细菌素已被分离并进行了性质分析[13-15],其中Nisin已被多个国家批准使用。丙酸杆菌细菌素是由丙酸杆菌合成的蛋白质或多肽,已经 发现的丙酸杆菌细菌素PLG-1[16]具有广泛的抑菌作用,能抑制革兰氏阴性细菌、部分革兰氏阳性菌、霉菌和酵母[17]。法国罗地亚公司已经把包含食品丙酸杆菌素的天然食品防腐剂开发为产品,并在美国和欧洲市场大量销售。国内对于丙酸杆菌细菌素的研究还处于起步阶段,本实验室也曾开展过相关的研究工作,并取得一定成效[18-19]。本实验对一株费氏丙酸杆菌的生长特性及其代 谢物的抑菌作用进行研究,并对抑菌代谢产物性质(是否为细菌素)进行探讨,以期为后续的分离、纯化等方面的研究奠定理论基础。
1 材料与方法
1.1菌种
费氏丙酸杆菌、酵母菌2-10515 常熟理工学院生物与食品工程学院发酵工程中心保存;金黄色葡萄球菌ATCC25923、大肠杆菌ATCC25922 中国科学院微生物研究所。
1.2仪器与设备
LDZX-50KB型立式压力蒸汽灭菌锅 上海申安医疗器械厂;xs105du型电子天平、s20k型酸度计 瑞士梅特勒-托利多公司;LHR-250型霉菌培养箱 上海索谱仪器有限公司;CR22GⅡ型高速冷冻离心机 日本日立公司;SW-CJ-1B超净工作台 苏净集团安泰公司;UV-2450型紫外-可见分光光度计 日本岛津公司;Milli-Q Advantage超纯水仪 美国Millipore公司。
1.3培养基
1.3.1费氏丙酸杆菌培养基
改良PYG培养基:酪蛋白胨5.0 g、蛋白胨5.0 g、酵母提取物10.0 g、牛肉提取物5.0 g、葡萄糖5.0 g、K2HPO42.0 g、吐温-80 1.0 mL、刃天青1.0 mL、盐溶液40.0 mL,蒸馏水950.0 mL,氯化血红素溶液10.0 mL,VK1溶液0.2 mL、L-半胱氨酸0.5 g,pH 7.2。盐溶液:CaCl2·2H2O 0.25 g、MgSO4·7H2O 0.5 g、K2HPO41.0 g、KH2PO41.0 g、NaHCO310.0 g、NaCl 2.0 g,蒸馏水1.0 L。氯化血红素溶液:氯化血红素50.0 mg、1 mol/L NaOH 1.0 mL,蒸馏水99.0 mL。VK1溶液:VK10.1 mL,95%乙醇20.0 mL。
1.3.2大肠杆菌培养基
营养肉汤培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g,蒸馏水1 000 mL,pH 7.0。
1.3.3金黄色葡萄球菌培养基
营养肉汤培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g,蒸馏水1 000 mL,pH 7.0。
1.3.4酵母菌培养基
PDA液体培养基[20]。
1.4方法
1.4.1菌种活化
将斜面保存的费氏丙酸杆菌菌株接种于改良的PYG固体培养基上,于30 ℃厌氧罐中厌氧培养2.5 d。
将斜面保存的金黄色葡萄球菌ATCC25923、大肠杆菌ATCC25922分别接种于营养肉汤培养基中,37 ℃培养12 h。将斜面保存的酵母菌2-10515接种于PDA培养基中,30 ℃培养24 h。
1.4.2生长曲线测定
将活化好的费氏丙酸杆菌接种到改良PYG液体培养基中,30 ℃厌氧培养10 d,每隔1 d吸取一定量的发酵液,以PYG液体培养基作为空白,在620 nm波长处测定发酵液光密度(OD)值,以此绘制费氏丙酸杆菌生长曲线。
1.4.3残糖含量的测定
每隔24 h吸取一定量的发酵液,8 000 r/min离心5 min,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[10]测定上清液中残糖含量。
1.4.4pH值测定
采用s20k型酸度计测定不同时间发酵液上清液pH值。
1.4.5费氏丙酸杆菌代谢物抑菌作用分析
1.4.5.1费氏丙酸杆菌代谢物对大肠杆菌抑制作用分析
将1 mL活化好的大肠杆菌菌液接入9 mL已灭菌的营养肉汤培养基中,然后向其中分别加入不同时间的费氏丙酸杆菌发酵上清液0.5 mL,混合液于36 ℃条件下培养24 h,以一支9 mL营养肉汤培养基+1 mL指示菌液+0.5 mL费氏丙酸杆菌培养基管作为空白对照管,在620 nm波长处测定混合液OD值,考察不同时间的发酵液对大肠杆菌抑制作用。
1.4.5.2费氏丙酸杆菌代谢物对金黄色葡萄球菌抑制作用分析
将1 mL活化好的金黄色葡萄球菌菌液接入9 mL已灭菌的营养肉汤培养基中,以下操作方法参照1.4.5.1节进行。考察不同天数的发酵液对金黄色葡萄球菌的抑制作用。
1.4.5.3费氏丙酸杆菌代谢物对酵母菌抑制作用分析
将1 mL活化好的酵母菌菌液接入9 mL已灭菌的PDA培养基中,以下操作方法参照1.4.5.1节进行。考察不同天数的发酵液对酵母菌的抑制作用。
1.4.6抑菌活性代谢产物分析
分别用1 mol/L丙酸和l mol/L乙酸调节费氏丙酸杆菌液体发酵培养基pH值至4.6(pH 4.6为费氏丙酸杆菌发酵上清液的终pH值),然后各取200 ☒L调酸后的培养基加入含有指示菌(大肠杆菌)的平板牛津杯中,以费氏丙酸杆菌发酵上清液(8 d)为空白对照,36 ℃条件下培养24 h,观察抑菌情况,以此考察发酵产物抑菌作用是否因发酵产酸引起。
2 结果与分析
2.1生长曲线测定结果
由图1可知,第1天菌体生长速率很快,直接进入对数生长期,从第2~3天结束,菌体量增长缓慢,从第4~8天结束,菌体量基本稳定,第9天菌体生长进入衰亡期。

图1 费氏丙酸杆菌生长曲线Fig.1 Growth curve of Propionibacterium freudenreichii
2.2残糖含量测定结果
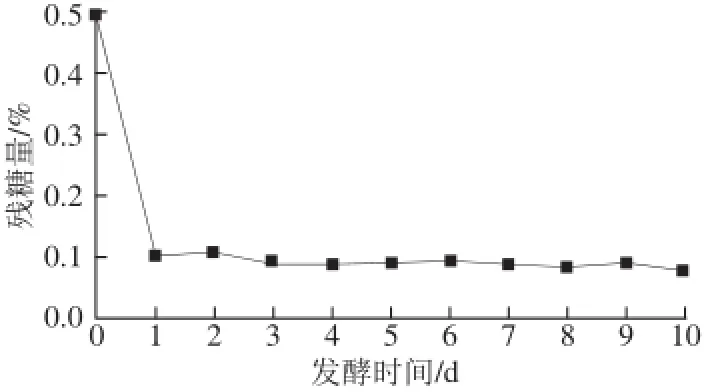
图2 不同时间发酵液残糖含量Fig.2 Amount of residual sugar at different fermentation times
由图2可知,发酵液中的还原糖含量在发酵1 d内几乎被消耗殆尽(0.5%~0.1%),从第2~3天起,还原糖含量略有降低,之后基本不变。
2.3发酵液pH值

图3 不同时间发酵液ppHH值Fig.3 pH at different fermentation times
如图3所示,pH值在发酵的第1天下降到4.6左右,此后一直到第10天,pH值基本稳定在4.6左右。这是由于丙酸杆菌在生长过程中产生丙酸、乙酸等多种有机酸,pH值稳定在4.6是有机酸产生和消耗相互平衡的结果[21]。发酵液中还原糖含量及pH值的变化趋势和马悦培等[22]研究的薛氏丙酸杆菌发酵过程中发酵液的还原糖含量及pH值变化趋势相似。
2.4费氏丙酸杆菌代谢物对大肠杆菌抑制作用
如图4所示,0 d为空白对照组,其他发酵时间的OD620nm值均小于空白对照组,这说明费氏丙酸杆菌代谢物对大肠杆菌具有抑制作用。同时,每管发酵液代谢物对大肠杆菌的抑制作用相差不大(OD620nm值相近)。
2.5费氏丙酸杆菌代谢物对金黄色葡萄球菌、酵母菌的抑制作用

图5 不同时间费氏丙酸杆菌代谢物对金黄色葡萄球菌(A)和酵母菌(B)抑制作用Fig.5 Inhibitory effects of Propionibacterium freudenreichii metabolites at different fermentation times on Staphylococcus aureus (A) and yeast (B)
费氏丙酸杆菌代谢物对金黄色葡萄球菌和酵母菌抑制作用分别如图5A、5B所示,其中0 d为空白对照组,其他时间的OD620nm值均和空白对照组相差不大,综合2.4节实验结果,这说明在同等条件下,该费氏丙酸杆菌代谢物对大肠杆菌的抑菌作用优于对金黄色葡萄球菌和酵母菌的抑制作用。
2.6抑菌活性代谢产物分析结果
如图6所示,经丙酸调节pH值的发酵培养基对指示菌有抑制作用(图中2所示,抑菌圈直径为16 mm),但并没有费氏丙酸杆菌发酵上清液的抑菌作用大(图中1和3抑菌圈直径平均值为24 mm),而经乙酸调节pH值的发酵培养基对 指示菌没有抑制作用,这说明:1)费氏丙酸杆菌发酵产物对大肠杆菌有抑制作用;2)发酵产物乙酸没有抑菌作用;3)发酵产物中的丙酸有抑菌作用;4)发酵产物中的抑菌物质除了丙酸之外,还存在其他物质。卢楠等[5]对谢氏丙酸杆菌发酵废液中生物抑菌物质进行了研究,她们发现发酵液可以抑制一些革兰氏阳性菌、阴性菌及真菌,而且抑菌效果明显优于化学防腐剂,其主要抑菌成分为等电点在2.0附近的蛋白类物质、丙酸铵、乙酸铵。牛爱地等[23]对一株从酸菜中分离的有抑菌活性的乳杆菌的代谢产物进行了研究,研究表明有抑菌活性的代谢产物是一种蛋白质,且具有良好的热稳定性。这些蛋白类的抑菌物质就是细菌素。所以,本实验费氏丙酸杆菌代谢物中丙酸以外的抑菌物质可初步判定为细菌素,在以后的实验中将进一步进行验证。

图6 费氏丙酸杆菌代谢物中抑菌物质分析Fig.6 Antibacterial activity of Propionibacterium freudenreichii metabolites
3 结 论
通过对费氏丙酸杆菌基本生长特性的研究,得出该菌生长周期约为10 d,第1~3天为其对数生长期,第4~8天为菌体生长的稳定期,第9~10天为衰亡期。在生长过程中,菌体利用糖的速率很快,还原糖在发酵1 d内几乎被消耗殆尽,发酵液pH值在发酵的第1天下降到4.6左右,此后一直到第10天,pH值基本稳定在4.6左右。通过对费氏丙酸杆菌代谢物抑菌作用研究,得出在同等条件 下,费氏丙酸杆菌代谢物对大肠杆菌的抑制作用优于对金黄色葡萄球菌和酵母菌的抑制作用。对代谢产物分析结果表明,发酵产物中抑菌物质除了丙酸之外,还存在其他物质,根据文献报道[5],初步推断出这些物质为细菌素,进一步的验证实验将继续开展。
实验室小发酵罐的高密度培养实验是在摇瓶培养基础上开展的,梁泽鑫等[4]研究了5 L罐产酸费氏丙酸杆菌发酵动力学,取得了很好的效果。王晓云等[6]研究了补加氨水对薛氏丙酸杆菌分批发酵及代谢物抑菌活性的影响,研究表明,补加氨水后有效地调节了发酵液的pH值,显著提高了费氏丙酸杆菌代谢物的抑菌活性。Feng Xiaohai等[24]研究了7.5 L发酵罐中费氏丙酸杆菌CCTCC M207015发酵产丙酸的动力学。因此,高密度培养也将是本实验下一步研究的重点内容。另外,邱雯雯等[25]研究了直投式费氏丙酸杆菌发酵剂的制备,利用制得的直投式发酵剂发酵酸奶,酸奶指标达到了指标要求。所以,今后也可以考虑制备直投式的发酵剂用于食品发酵,取得发酵、防腐一举两得的效果。
[1] 贾彩凤. 丙酸杆菌代谢物作为食品防腐剂的研究[D]. 上海: 华东师范大学, 2005.
[2] 梁新乐, 刘爱琴, 钟立人. 丙酸杆菌的研究进展及其在食品发酵工业中的应用[J]. 食品研究与开发, 2006, 27(6): 170-172.
[3] WANG Peng, JIAO Youjing, LIU Shouxin. Novel fermentation process strengthening strengthening strategy for production of propionic acid and vitamin B12by Propionibacterium freudenreichii[J]. Joural of Industrial Microbiology Biotechnology, 2014, 41: 1811-1815.
[4] 梁泽鑫, 王菊芳. 产酸丙酸杆菌生长特性及5L罐发酵动力学研究[J].激光生物学报, 2014, 23(3): 251-256.
[5] 卢楠, 朱文华. 谢氏丙酸杆菌发酵废液中生物抑菌物质的研究[J].河北工业科技, 2012, 29(3): 138-140.
[6] 王晓云, 金风杰, 计芬芬, 等. 补加氨水对薛氏丙酸杆菌分批发酵及代谢物抑菌活性的影响[J]. 食品工业科技, 2012, 33(14): 224-227.
[7] 冯晗, 荣邵丰, 贾彩凤, 等. 丙酸杆菌代谢物对恶臭假单胞菌抑制活性[J]. 兰州大学学报: 自然科学版, 2008, 44(2): 58-62.
[8] 荣绍丰, 常忠义, 高红亮, 等. 不同丙酸杆菌代谢物对酵母菌抑菌作用的研究[J]. 食品工业, 2009, 30(1): 1-3.
[9] 荣绍丰, 常忠义, 高红亮, 等. 发酵条件对费氏丙酸杆菌代谢物抑菌活性的影响[J]. 食品工业, 2008, 29(6): 3-5.
[10] DANILOVA I V, BYKOVCHENKO T V, RYZHKOVA E P. A positive effect of Propionibacterium freudenreichii on the growth of Saccharomyes cerevisiae during their cocultivation[J]. Applied Biochemistry and Microbiology, 2006, 42(4): 378-383.
[11] HAJFARAJOLLAH H, MOKHTARANI B, NOGHABI K A. Newly antibacterial and antiadhesive lipopeptide biosurfactant secreted by a probiotic strain, Propionibacterium freudenreichii[J]. Applied Biochemistry and Biotechnology, 2014, 174(8): 2725-2740.
[12] YUKSEKDAG Z N, DARILMAZ D O, BEYATLI Y. Dairy propionibacterium strains with potential as biopreservatives against foodborne pathogens and their tolerance-resistance properties[J]. European Food Research & Technology, 2014, 238(1): 17-26.
[13] STILES M E. Biopreservation by lactic acid bacteria[J]. Antonie van Leeuwenhoek, 1996, 70: 331-345.
[14] 田文利, 吴琼, 吕红线, 等. 乳酸链球菌素(Nisin)的研究进展[J]. 食品工业, 2000, 21(3): 28-30.
[15] STEVENS K A, SHELDON B W, KLAPES N A, et al. Nisin treatment for inactivation of Salmonella species and other gramnegative bacteria[J]. Applied & Environmental Microbiology, 1991,57(12): 3613-3615.
[16] LEVERSEE J A, GLATZ B A. Detection of the bacteriocin propionicin PLG-1 with polyvalent anti-PLG-1 anti-serum[J]. Applied & Environmental Microbiology, 2001, 67(5): 2235-2239.
[17] SHOTARO T, HIROSHI K, KOICHI H. SF6gas analysis technique and its application for evaluation of internal conditions in SF6gas equipment[J]. IEEE Transactions on Power Apparatus and Systems,1981, 100(9): 4196-4206.
[18] 王海晶, 王玉华, 齐斌. 响应面法优化产丙酸杆菌素菌株的培养条件[J]. 中国乳品工业, 2011, 39(2): 13-16.
[19] 刘靖, 王立梅, 齐斌. 丙酸杆菌高产菌株的诱变选育[J]. 食品工业科技, 2012, 33(9): 187-189.
[20] 周德庆. 微生物学实验教程[M]. 2版. 北京: 高等教育出版社, 2006: 372.
[21] 陈玉梅, 常忠义, 王疆元, 等. 乳酸钠和葡萄糖对薛氏丙酸杆菌生长及代谢物抑菌活性的影响[J]. 西北农林科技大学学报: 自然科学版,2007, 35(2): 178-182.
[22] 马悦培, 高红亮, 常忠义, 等. 不同初始pH对丙酸杆菌细菌素发酵的影响[J]. 食品工业科技, 2010, 31(5): 215-217.
[23] 牛爱地, 韩建春. 一株从酸菜中分离的产细菌素乳杆菌的鉴定及其所产抑菌物质的研究[J]. 东北农业大学学报, 2009, 40(10): 104-108.
[24] FENG Xiaohai, XU Hong, YAO Jun, et al. Kinetic analysis and pH-shift control strategy for propionic acid production with Propionibacterium freudenreichii CCTCC M207015[J]. Applied Biochemistry & Biotechnology, 2010, 160(2): 343-349.
[25] 邱雯雯, 陈存社, 高思思, 等. 直投式费氏丙酸杆菌发酵剂的制备及其保护剂的优化[J]. 食品工业科技, 2013, 39(9): 95-100.
Growth Characteristics and Metabolite Bacteriostatic Action of Propionibacterium freudenreichii
ZHENG Lixue1,2, WANG Jingchu2, SHI Huijia2, CAO Xue3, QI Bin1,*
(1. College of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China;2. Suzhou Key Laboratory of Food and Biotechnology, Changshu 215500, China;3. National Engineering Research Center of Corn Deep Processing, Jilin CO FCO Bio-chemical Co. Ltd., Changchun 130033, China)
The growth characteristics and metabolite bacteriostasis of Propionibacterium freudenreichii were studied. The results showed: the strain's growth cycl e was approximately 10 days, involving logarithmic phase (1-3 d), stability phase(4-8 d) and decline phase (9-10 d). In the process of growth, sugar was consumed quickly, and almost completely depleted in the first day. The pH after 1 day of fermentation dropped to 4.6 and then remained at 4.6 during the remaining fermentation period. Under the same conditions, the bacteriostatic effect of Propionibacterium fre udenreichii metabolites on E. coli was better than those of Staphylococcus aureus and yeast. Bacteriocins were dominant metabolites with antimicrobial activity besides propionic acid.
Propionibacterium freudenreichii; growth characteristics; antimicrobial substances; bacteriocins
Q939.9
A
1002-6630(2015)15-0163-04
10.7506/spkx1002-6630-201515030
2014-10-13
江苏省科技支撑计划项目(BE2013339);苏州市科技计划项目(SYN201226;SYN201417)
郑丽雪(1982—),女,实验师,硕士,研究方向为食品生物技术。E-mail:lixue9418@163.com
齐斌(1965—),男,研究员,博士,研究方向为粮食油脂与植物蛋白工程。E-mail:qibin65@126.com
