利用玉米芯水解液产苹果酸的戴尔根霉突变菌株选育及代谢分析
2015-11-02王华林汪海涛吴学凤陈小举潘丽军姜绍通李兴江
孙 婷,杨 英,王华林,汪海涛,吴学凤,张 旻,陈小举,潘丽军,姜绍通,李兴江,*
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽建筑大学环境与能源工程学院,安徽 合肥 230601)
利用玉米芯水解液产苹果酸的戴尔根霉突变菌株选育及代谢分析
孙 婷1,杨 英2,王华林1,汪海涛1,吴学凤1,张 旻1,陈小举1,潘丽军1,姜绍通1,李兴江1,*
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽建筑大学环境与能源工程学院,安徽 合肥 230601)
诱变筛选发酵玉米芯水解液高产苹果酸的根霉属菌株,并对其进行代谢分析,研究其高产苹果酸的机理。对分离得到的菌株进行ITS序列鉴定,进一步利用软X射线辐射对菌种进行诱变筛选、对出发菌株和突变菌株的相关酶活力进行测定及代谢通量分析。利用软X射线辐射结合丙烯醇平板筛选乙醇脱氢酶缺陷型菌株,得到突变株-1,发现其乙醇脱氢酶基因的3 处密码子突变为“TAA”,阻断了突变菌株的乙醇代谢途径。进而利用软X射线辐射结合氟乙酸平板筛选乙醛酸循环缺陷型菌株,得到复合突变株-2,降低了副产物富马酸及琥珀酸的产量。复合突变株-2的葡萄糖-6-磷酸脱氢酶中几处NADP(H)结合位点发生突变,增加了糖酵解和磷酸戊糖两种途径的相互作用,促进了其戊糖代谢。经过两步分离筛选,得到的复合突变株-2能发酵玉米芯水解液高产苹果酸,且减少了副产物乙醇、富马酸、琥珀酸的生成。复合突变株-2的苹果酸产量占代谢物总产量的比例由出发菌株的71%增加到91%,苹果酸产量增大1倍,研究成果对工业化利用突变菌株生产苹果酸具有重要意义。
苹果酸;玉米芯水解液;代谢通量分析;葡萄糖-6-磷酸脱氢酶
苹果酸是一种重要的有机酸,广泛运用于食品和化学等领域。与柠檬酸相比,苹果酸酸度大、产热低,味道柔和、持久且具特殊香味,被誉为“最理想的食品酸味剂”[1]。目前制备苹果酸的方法主要有2 种[2-3]:一是一步发酵法,利用霉菌直接发酵糖质原料产苹果酸;二是两步发酵法,利用2 种不同功能的微生物,将糖质原料先转化为延胡索酸,再转化为苹果酸。其中一步发酵法筛选出高效菌株是关键,也是难点所在,两步发酵法对发酵条件要求很严格,且发酵周期长,产酸率较低,苹果酸对糖的产率一般为60%左右,副产物也较多,不适合工业化生产。而一步发酵法可以避免上述的缺点,且产物安全性高,备受消费者青睐。因此,基于可再生非粮生物质原料一步发酵法制备苹果酸更有潜力,这也是本实验的创新所在,分离筛选出的戴尔根霉突变菌株可利用生物质原料一步发酵产苹果酸,产量高且副产物低。在中国,每年有100万t的玉米芯废弃物,利用率低,随着发酵技术进步,可以利用玉米芯水解液发酵产苹果酸。这对食品、化学领域都具有重要意义[4]。
国内外有关生物质原料发酵有机酸的报道很多,研究最热的是米根霉发酵产乳酸,但尚未有关于生物质发酵产苹果酸的报道。Maas等[5]利用小麦秸秆水解液发酵产乳酸,木糖利用率10.3 g/L,葡萄糖利用率19.2 g/L,最终产乳酸6.8 g/L,乙醇5.7 g/L,产量低且副产物多;Park等[6]用办公废纸水解液(包括82.8 g/L葡萄糖、7 g/L木糖、3.4 g/L纤维二糖)发酵产49.1 g/L的乳酸,发酵产量有待进一步提高;Bai Dongmei等[7]利用玉米芯水解液发酵60 h可产乳酸65 g/L,说明玉米芯相对于其他生物质原料更具发酵潜力。以上研究虽然不是发酵产苹果酸,但是由于发酵菌株的同源性以及五、六碳糖代谢的相似性,故具有很高的借鉴意义[8]。
本实验分离得到一株能发酵玉米芯水解液产苹果酸的根霉菌株。但作为生产菌种,其代谢过程伴随大量副产物生成。本实验的重点是以其作为出发菌株进行准确的代谢分析,通过胞内代谢通路及关键酶基因操作定向选育突变菌株[9]。采用物理辐射诱变结合化学试剂筛选的方法,通过改变代谢酶活性来调控代谢过程,以达到降低副产物形成、提高苹果酸产量的目的。关键酶基因表征分析解释了关键酶活性变化的实质,进一步解释了突变菌株产物、副产物的代谢流量变化,关键酶基因操作对代谢通量改变、代谢途径变化、代谢网络建立都具重要意义,也是初级代谢网络建立的科学聚焦之处。
本实验在代谢途径和代谢通量分析的基础上,围绕关键点定向选育菌株,降低了富马酸、琥珀酸、乙醇的产量,促进了五碳糖和六碳糖共代谢,增加了苹果酸产量,为实现产业化打下了基础。
1 材料与方法
1.1材料与试剂
1.1.1菌株
原始菌株分离自丰原集团发酵工厂的发酵污染液,后由合肥工业大学农产品加工研究院绍通菌种保藏中心诱变选育及保存。
1.1.2培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L、葡萄糖20 g/L 、琼脂20 g/L,自然pH值;分离培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L、 溴甲酚绿0.1 g/L、自然pH值;发酵培养基:玉米芯水解液125 g/L、(NH4)2SO42 g/L、 K2HPO40.8 g/L、MgSO40.3 g/L、ZnSO40.2 g/L、CaCO3调pH值至5.0。
1.1.3玉米芯水解液
玉米芯由丰原集团收集,切碎碾磨成直径小于1.0 mm的颗粒,进行稀酸酸解和酶解。取原料1 000 g,按照固液比1∶5(m/V)的比例加入质量分数为0.4%的稀酸,搅拌速率100 r/min,高压罐中160 ℃持续加压20 s后,减压蒸汽爆破。经洗涤的固体残渣在52 ℃条件下酶解,所用酶为纤维素酶(Genencor,Spezyme CP)和真菌的β-葡萄糖苷酶(Novozym 188,Novozymes A/S),搅拌速率120 r/min,持续72 h。1 000 g玉米芯得约450 g总糖(葡萄糖与木糖比例约4∶1),将总糖浓缩成约125 g/L(含葡萄糖100 g/L和木糖25 g/L)用作进一步发酵。
1.2仪器与设备
E2695高效液相色谱仪 沃特斯中国有限公司;Aminex HPX-87糖分析柱 北京京京未来科技发展有限公司;1790气相色谱仪 北京兴延诚博科技有限公司;MicroSpin S-400 HR聚合酶链式反应柱 沃特曼公司;721型可见分光光度计 上海元析仪器有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;YX280A全自动高压灭菌锅 上海三申仪器有限公司;ZC-100B恒温气浴摇床 上海申胜生物技术有限公司。
1.3方法
1.3.1菌株分离
从丰原集团20 m3染菌的柠檬酸发酵罐中取100 mL发酵液于250 mL三角瓶中,32 ℃、200 r/min摇瓶培养2 d,摇瓶内壁挑取菌丝通过含有溴甲酚绿的PDA培养基分离。
1.3.2菌株诱变与筛选
菌株培养3 d(1.3.1节得到的菌株),挑取孢子在软X射线下辐射2 min(物理射线技术支持由中国科学技术大学提供)。将孢子稀释并涂布到含有丙烯醇的培养基平板上(15 g/L琼脂、2~10 mL/L丙烯醇),筛选存活细胞菌落用于进一步的研究;将上一步软X射线辐射诱变得到的菌株涂布于氟乙酸平板上(15 g/L琼脂,5~30 g/L氟乙酸),30 ℃培养30 h,筛选出生长旺盛的突变菌株。
1.3.3发酵罐发酵培养
发酵采用15 L发酵罐,装液量10 L,接种量1 L(孢子悬液体积分数10%),发酵温度30 ℃,通气量0.4 L/(L·min),搅拌速率500 r/min。
1.3.4ITS序列分析
从冻干的细胞中提取DNA,进行ITS序列(18S rDNA和5.8S rDNA间的ITS1,5.8S rDNA和28S rDNA间的ITS2)分析,测序采用引物参考相关文献[10],进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR产物纯化用MicroSpin S-400 HR柱。ITS序列测序由宝生物工程(大连)有限公司完成,并通过GenBank中BLAST程序进行相似性分析。
1.3.5系统发育树构建
构建系统发育树前将样本序列保存为txt文本文件,序列只包含序列字母(ATCG或氨基酸简写字母),然后将需要构建系统树的序列导入MEGA软件,DNA序列进行比对后选择NJ法进行构建,选择Kimura 2-parameter模型,Bootstrap次数为1 000,最终生成系统发育树图。
1.3.6代谢通量分析
代谢通量分析用于计算形成的胞内代谢物:ATF=r,式中:r为网络中形成的代谢产物速率/(mmol/(g·h));F为内部反应速率/(mmol/(g·h));A为所有反应物和生成物的总化学计量矩阵;T为系统运算符号。代谢通量的计算可以利用Excel 2007中的MMULT和MINVERSE函数或者Matlab软件。
1.3.7细胞生物量测定
发酵液过滤得残渣,用0.01 mol/L的HCl溶液充分洗涤,除去过量CaCO3,再用蒸馏水洗涤,得残留菌体,于80 ℃烘干至恒质量,得到菌体细胞生物量。
1.3.8残糖及有机酸含量测定
利用Aminex HPX-87H柱进行高效液相色谱(high performance liquid chromatography,HPLC)分析。洗脱剂:5 mmol/L H2SO4,流速:0.5 mL/min,温 度:65 ℃。配制0.25、0.50、1.00、2.00、4.00 g/L残糖及有机酸标准溶液,经HPLC分析后绘制标准曲线,由此计算发酵液中残糖及有机酸含量。
1.3.9乙醇含量测定
采用1790气相色谱仪,色谱柱采用DB-WAX毛细管柱,N2为载气,流速为15 mL/min,进样器温度240 ℃,柱温220 ℃,检测温度250 ℃,进样量1 μL,分流比1∶100,外标法定量。
1.3.10蛋白质含量测定
[11],采用布拉德福德法测定发酵液蛋白质含量。
1.3.11酶活力检测
木糖还原酶(xylose reductase,XR)活力测定参考文献[12],葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH)活力测定参考文献[13],异柠檬酸裂解酶活力测定参考文献[14],苹果酸脱氢酶活力测定参考文献[15],丙酮酸羧化酶活力测定参考文献[16],琥珀酸脱氢酶活力测定参考文献[17],富马酸水合酶活力测定参考文献[18]。柠檬酸合成酶、乌头水合酶(aconitate hydratase,ACO)、苹果酸酶、乙醇脱氢酶(alcohol dehydrogenase,ADH)、α-酮戊二酸脱氢酶、磷酸果糖激酶、苹果酸合成酶活力均利用试剂盒测定。
1.3.12相关酶基因检测
基因组DNA是从冷冻干燥的细胞中提取并进行扩增和测序。引物序列如下:ADH引物分别为A1和A2(A1:5'-ATGTCTGAAGAAAC-3',A2:5'-TTAGTTCATGACGAG-3');ACO引物分别为K1和K2(K1:5'-ATGATCTCTGCTTAT',K2:5'-TCACACATGGTTAAT-3');G6PDH引物分别为P1和P2(P1:5'-ATGTCGCATGAAAGTTAC-3',P2:5'-TTAAAGCTTGTTGGAAGA-3');XR引物分别为X1和X2(X1:5'-ATGGAAGAATATGCGC-3',X2:5'-TTATTTACTCAAATCATG-3')。
2 结果与分析
2.1出发菌株Rhizopus delemar HF-119的分离及代谢分析
2.1.1出发菌株的分离鉴定
从丰原集团20 m3染菌的柠檬酸发酵罐中取100 mL发酵液于250 mL摇瓶培养2 d,摇瓶内壁挑取菌丝通过含有溴甲酚绿的PDA培养基分离,挑取生长旺盛的菌株进一步分离,筛选得到产生大的黄色透明圆圈的菌株,如图1所示。

图1 分离得到出发菌株Fig.1 Isolated colonies of the parent strain

图2 出发菌株的系统发育树Fig.2 Phylogenetic tree of the parent strain
如图2所示,将出发菌株的ITS区域序列结果提交到GenBank进行分析,结果显示出发菌株与已有根霉属几种菌有99%的高度同源性,分析发现出发菌株代谢过程涉及的相关酶也较为相近,尤其与戴尔根霉菌较相近,故命名为根霉属中的戴尔根霉菌Rhizopus delemar HF-119(后统称出发菌株),将其序列与相近菌株序列进行比对,运用MEGA软件采用NJ法构建系统发育树。
2.1.2出发菌株的基本碳源利用情况
以下面4 种碳源进行发酵产酸:玉米芯水解液125 g/L、葡萄糖+木糖(葡萄糖100 g/L、木糖25 g/L)、葡萄糖(分析级)100 g/L、木糖(分析级)25 g/L。发酵结果如图3、4所示。

图3 以生物质糖源与分析级糖源为碳源的苹果酸产量(A)、菌体生物量(B)和碳源残余量(C)的比较Fig.3 Malate output (A), BM synthesis (B) and consumption of carbon source (C) from corn cob hydrolysate and analytical-grade sugars
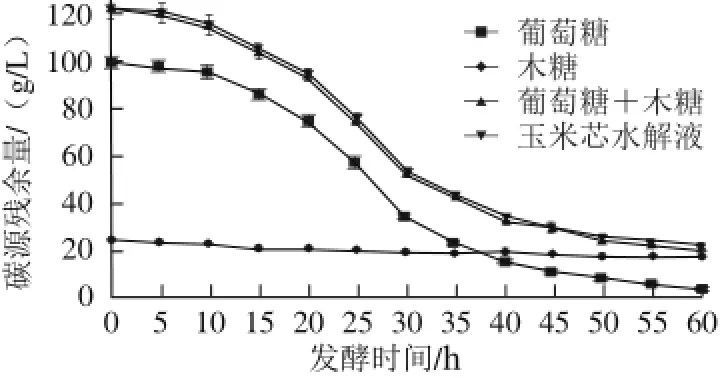
图4 4 种碳源的消耗情况比较Fig.4 Comparison of consumption of four carbon sources
由图3、4可知,葡萄糖100 g/L、木糖25 g/L的混合糖源与玉米芯水解液相比,苹果酸产量、产酸率略高、菌体生物量略低,碳源的消耗速率大体相同,二者差异并不显著,故以混合的葡萄糖+木糖作为发酵原料代替玉米芯水解液进行代谢流量分析,减少玉米芯水解液中未知成分对于代谢流量所造成的影响。图4显示发酵进行60 h后,25 g/L的木糖还剩下16.5 g/L,且苹果酸产量与细胞生物都很低,说明分离的出发菌株可以利用木糖发酵,但发酵效率还需通过诱变筛选进一步增强。
2.1.3出发菌株的发酵进程研究
在出发菌株发酵的过程中,检测葡萄糖、木糖消耗量,苹果酸、富马酸、乙醇产量及菌体生物量,结果如图5所示。出发菌株主要代谢产物为苹果酸,发酵60 h时苹果酸质量浓度达到60.5 g/L,但同时也伴随大量富马酸、乙醇等副产物生成。木糖被消耗证明该菌株的磷酸戊糖途径(hexose monophophate pathway,HMP)被激活,后续诱变筛选可围绕增强HMP途径开展。
2.1.4出发菌株的代谢酶活力分析

表1 关键酶活力分析Table 1 Key enzyme activity analysis of the parent strain
检测出发菌株相关酶活力,结果如表1所示。分析表中酶活力可知,出发菌株苹果酸生成来自以下三部分:1)由草酰乙酸转化得到,因为PC和MDH活性较高;2)由丙酮酸合成,因ME活性较高;3)由乙醛酸循环中ISOC催化得到,因为无KDH活性,三羧酸循环(tricarboxylic acid cycle,TCA)受阻,检测到CS、ACO、ISOC、MS活性,说明存在乙醛酸循环。同时产生副产物富马酸和琥珀酸是由于缺少α-KDH和FUMH,只能通过乙醛酸循环中ISOC催化得到。XR、XDH、XK是木糖转化为5-磷酸木酮糖的关键酶,也是HMP途径的重要部分,说明该出发菌株可进行木糖代谢。
2.1.5出发菌株的代谢途径分析及代谢网络构建
在出发菌株关键酶活力分析基础上,结合研究已经较为透彻的苹果酸代谢途径分析。首先,菌株代谢潜力明显,即菌株代谢入口具备五、六碳糖共代谢特征,这为广谱的生物质转化提供了可能。其次,菌株苹果酸合成来源多样化,尤其上游的丙酮酸羧化途径及苹果酸酶合成途径均是典型的CO2固定化途径,使得菌株具备较高的碳得率的优势,进一步构建代谢网络(图6)。

图6 出发菌株的代谢网络[199--2211]Fig.6 Metabolic network for the parent strain[19-21]
在生物反应方程式与主要产物分析的基础上绘制出发菌株的基本代谢途径,通过关键酶分析建立代谢网络模型。图6中清晰显示苹果酸主要来自3 条途径,分别对应苹果酸1、苹果酸2、苹果酸3,副产物富马酸、柠檬酸、琥珀酸、乙醇对应的代谢途径是主要改造对象,尤其是糖酵解与HMP途径相偶联的NADPH生成途径,为菌株能量平衡带来了重要的调控突破点。
2.1.6出发菌株的代谢通量分析
根据生物反应式及建立的代谢网络列出代谢通量方程式,如表2所示。

表2 代谢通量方程式Table 2 Metabolic flux equations
表2列出60 个流量方程式及其流量值。其中41 个方程式((1)~(41))从基础质量平衡的生物反应式中获得,另外11 个方程系数参考文献[19-21]获得。其他方程式(包括底物摄入(53)、(54),产物输出(55)~(59),检测生物量(60))都是直接测得的。本实验计算这部分的数据通过用代谢物净变化量趋于稳定的量除以该稳定阶段的时间获得。细胞生物量几乎在40~50 h时固定,特别选择此时期进行代谢通量分析。整个体系通量数据有60 个相对应的反应式,通过矩阵计算这些通量如表3所示。

表3 代谢通量数据Table 3 Original metabolic flux data(mmol/(g·h))
出发菌株的通量数据如表3第一列所示,代谢通量最多的是苹果酸,主要通过以下3 条途径得到,其中75%的苹果酸来自草酰乙酸,18%来自乙醛酸,7%来自丙酮酸。副产物乙醇和富马酸代谢通量高,需进一步消弱。木糖的代谢通量为0.059 5 mmol/(g·h),与葡萄糖相比消耗量低,说明HMP途径需进一步加强。
2.2突变株-1的选育及代谢分析
2.2.1突变株-1的选育
软X射线诱变出发菌株 ,选取丙烯醇含量为2、4、6、8、10 mL/L的平板进行菌株筛选,结果表明丙烯醇含量过低抑制效果不明显,丙烯醇含量在6 mL/L时,出发菌株即被显著抑制,基本不生长,少数缺陷型突变株生长,因而选择6 mL/L丙烯醇进行诱变筛选。
2.2.2突变株-1的发酵进程分析
软X射线辐射结合丙烯醇诱变出发菌株得到突变株-1,绘制突变株-1的发酵进程曲线并和出发菌株进行基础发酵参数比较,结果如图7所示。

图7 突变株-1的发酵进程Fig.7 Time course of fermentation by mutant strain-1
与出发菌株相比,突变株-1在发酵时间、菌体生物量、残糖含量等发酵参数上基本没有变化,但苹果酸产量显著增加,副产物乙醇质量浓度明显减少。结合表3的代谢通量数据可知,苹果酸通量由出发菌株的1.056 5 mmol/(g·h)增加到1.388 5 mmol/(g·h)(F3),主要由于来自草酰乙酸这部分的通量从0.785 7 mmol/(g·h)增加到1.086 3 mmol/(g·h)(F41)。
2.2.3突变株-1的相关酶活力分析
为了解释代谢通量机制,测定突变株-1的相关酶活力并与出发菌株酶活力进行比较,结果如图8所示。
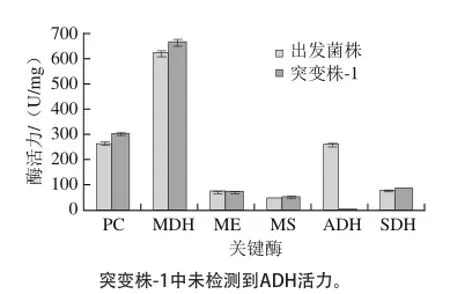
图8 出发菌株与突变株-1的相关酶参数Fig.8 Key enzyme activities involved from the parent strain and mutant strain-1
与出发菌株相比,突变株-1的乙醇脱氢酶(ADH)活力从259.4 U/mg减少至0,引起乙醇急剧减少,丙酮酸羧化酶(PC)活力从265.6 U/mg增加到304.6 U/mg,苹果酸脱氢酶(MDH)活力从623.0 U/mg增加为666.3 U/mg。这些关键酶活力的改变对应引起代谢通量和代谢物产量的变化。
2.2.4突变株-1的突变基因表征
乙醇脱氢酶可以将丙烯醇转化为对细胞有致死毒性的丙烯醛,常采用此方法进行乙醇阻断选育,筛选到能在丙烯醇平板上良好生长的突变株,往往其乙醇脱氢酶发生了不可逆的致死性突变。对乙醇脱氢酶的基因进一步研究,分析比较出发菌株和突变株-1的乙醇脱氢酶基因序列,NCBI(www.ncbi.nlm.nih.gov)登录号分别为KF060237和KF060238。对比发现在突变株-1的乙醇脱氢酶基因中有3 处密码子(GAA、GAA、CAA)突变成了“TAA”,导致了乙醇脱氢酶活力的改变。
2.3复合突变株-2的选育及代谢分析
2.3.1复合突变株-2的选育
采用软X射线诱变突变株-1,选取氟乙酸质量浓度为5、7、10、12、15 g/L的平板进行菌株筛选,结果表明氟乙酸质量浓度过低时其抑制作用不明显,当氟乙酸质量浓度为7 g/L时,出发菌株出现被显著抑制,基本不生长的现象,因而选择7 g/L氟乙酸进行诱变筛选,挑取那些在此条件下能够生长的缺陷型突变株。
2.3.2复合突变株-2的发酵进程分析
软X射线辐射结合氟乙酸诱变突变株-1得到复合突变株-2,绘制复合突变株-2的发酵进程曲线并和出发菌株、突变株-1进行基础发酵参数比较,如图9、10所示。
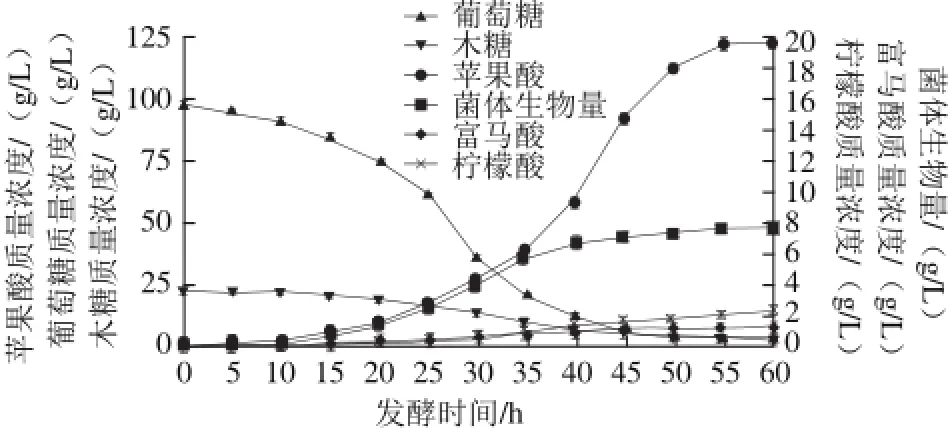
图9 复合突变株-2的发酵进程Fig.9 Time course of fermentation by mutatnt strain-2

图10 出发菌株、突变株-1及复合突变株-2的基础发酵参数比较Fig.10 Basic fermentation parameters from the parent strain, mutant strain-1 and mutant strain-2
经过诱变筛选得到复合突变株-2,将其与出发菌株、突变株-1进行基础发酵参数的比较,发现复合突变株-2在发酵时间、菌体生物量、残糖含量方面基本没有变化,但苹果酸产量由60.5 g/L增加到122 g/L,副产物乙醇、富马酸产量明显减少,木糖代谢途径得到增强,此外还具有一定量的柠檬酸生成。
2.3.3复合突变株-2的代谢通量分析
复合突变株-2代谢通量如表3所示,复合突变株-2的苹果酸通量由1.388 5 mmol/(g·h)增加到2.162 7 mmol/(g·h)(F3),其中从丙酮酸转化成苹果酸的通量由0.0 7 2 1 m m o l/(g·h)增 加到0.422 3 mmol/(g·h)(F34),从草酰乙酸转化成苹果酸的通量由1.086 3 mmol/(g·h)增加到1.711 8 mmol/(g·h)(F41),从乙醛酸转化成苹果酸的通量从0.230 1 mmol/(g·h)减少到0.028 7 mmol/(g·h)(F48),这一系列变化有效地减少了副产物生成,增强了木糖代谢途径。
综合分析两次诱变结果,第一次辐射结合烯丙醇平板筛选得到突变株-1,与出发菌株相比,苹果酸代谢通量从1.056 5 mmol/(g·h)增加到1.388 5 mmol/(g·h)(F3),增加了31.42%,乙醇代谢通量从0.403 5 mmol/(g·h)减少为0(F43),这说明突变株的乙醇代谢途径被阻断;琥珀酸由0.039 7 mmol/(g·h)减少至0.015 9 mmol/(g·h)(F50),减少了59.95%,富马酸由0.158 6 mmol/(g·h)增加到0.214 1 mmol/(g·h)(F58、F59),增加了35.06%,副产物富马酸的增加可能是由于乙醇代谢途径阻断而使得其他代谢途径增强所致。对于突变株-1进一步进行软X射线辐射结合氟乙酸筛选得到复合突变株-2,苹果酸代谢通量增加了55.76%,富马酸代谢通量减少了88.52%,琥珀酸通量减少了74.84%,乙醇代谢通量依然是0。 由此说明第二次诱变不仅保证了第一次突变诱变菌株的优良性状,而且进一步提高了苹果酸产量,降低了富马酸、琥珀酸产量。整体来说,两次诱变苹果酸代谢通量增加了1.106 2 mmol/(g·h),其中第一次诱变贡献了30.01%,第二次诱变贡献了69.99%。
2.3.4复合突变株-2的关键酶酶活力表征与分析
测定复合突变株-2相关酶活力,与出发菌株及突变株-1进行比较,结果如图11所示。
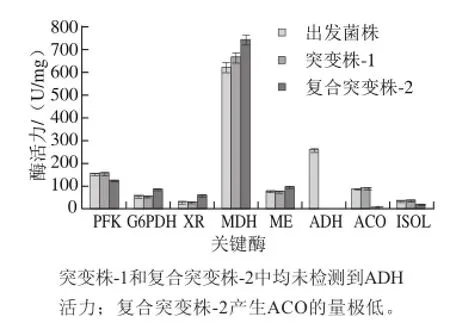
图11 出发菌株、突变株-1及复合突变株-2涉及的关键酶活力分析Fig.11 Key enzyme activities involved from the parent strain, mutant strain-1 and mutant strain-2
复合突变株-2的ACO活力由88.6 U/mg减少至4.4 U/mg,阻断了乙醛酸循环,有效地减少了富马酸和琥珀酸的生成,ISOC的活力减少进一步加强了阻断效果。PFK的活力从150.5 U/mg减少至120.5 U/mg,降低糖酵解(Embden-Meyerhof-Parnas pathway,EMP)途径的代谢通量,抑制柠檬酸积累。
复合突变株-2的苹果酸流量合成主途径主要来自丙酮酸的羧化及草酰乙酸的氢化,但综合分析发现细胞的总体还原力(能量) 处于平衡,并没有结余,则细胞生长、活动及代谢所需能量必须有其他结余能量途径来弥补,对突变株的发酵过程及代谢通量深入分析发现木糖代谢得到有效加速以及HMP途径流速得到显著提升,其EMP/HMP流量穿梭提升的背后肯定与突变株在此步骤中的代谢关键酶有关联,进一步的酶活力分析表明,突变株的G6PDH(此步骤的关键酶)活力显著提升。此关键酶具有提供2 倍的还原性H(NADPH)的能力,以此来弥补突变株-1在乙醛循环中丢失的还原性H(NAD和FADH),且增加戊糖磷酸途径的代谢通量。G6PDH能提供木糖还原酶、ME催化过程中需要的关键辅助因子NADPH,所以某种意义上通过活化G6PDH能增强木糖与ME代谢。通过酶基因及酶蛋白数据库(http://enzyme. expasy.org)分析表明,该酶蛋白常在90~100的氨基酸序列范围与NADPH(NADP+)具有较活跃的结合位点,而通过对比复合突变株-2与出发菌株的G6PDH关键酶基因序列及氨基酸序列发现,复合突变株-2在第88、92、100、102位发生了多处突变,这也进一步说明突变株中该关键酶基因的多处突变与其酶活力改变(包括与NADPH/NADP+的结合能力)及细胞能力供给系统的平衡可能是相关的,从而改变相关代谢通量。
出发菌株与复合突变株-2 ACO基因序列的NCBI登录号分别是KF060239和KF060240,G6PDH基因的NCBI登录号分别是KF041003和KF041003。综上所述,ACO基因序列有几处突变位点引起酶活力的降低,解释了其下游富马酸及琥珀酸代谢通量显著降低的原因;G6PDH基因序列中位于NADP(H)结合区域的部分序列发生突变,增强了其与NADP+的结合,提高了其催化能力。
3 结 论
以一步发酵法产苹果酸为基础,通过诱变筛选得高产苹果酸且副产物减少的复合突变菌株-2,该菌株由于乙醇脱氢酶突变缺陷降低了乙醇产量,乙醛酸循环突变缺陷降低了富马酸和琥珀酸产量,葡萄糖-6-磷酸脱氢酶NADP(H)活动位点突变增加EMP和HMP相互作用,促进了戊糖途径。经过两步选育,复合突变株-2的苹果酸产量占代谢物总产量的比例由出发菌株的71%增加到91%,苹果酸产量由出发菌株的60.5 g/L增加1 倍,大幅度提高了苹果酸产量。代谢途径分析证明复合突变株-2菌株能利用玉米芯水解液进行五、六碳糖共代谢,这对于农业废弃物利用具有重要意义。复合突变株-2产酸量高、副产物低,复合突变株-2的获得及代谢选育研究为工业化生产苹果酸提供了一定的理论依据与应用价值。
参考文献:
[1] 吴军林, 吴清平, 张菊梅. L-苹果酸抗氧化作用机理研究[J]. 食品科技, 2010, 35(2): 194-198.
[2] 刘建龙, 刘建军, 杨连生. 酶转化法及微生物发酵法生产L-苹果酸的研究进展[J]. 中国酿造, 2005, 24(7): 5-7.
[3] 王锐清. L-苹果酸的生产及应用研究进展[J]. 化工时刊, 2002, 16(5):1-7.
[4] GAO Guoliang, ZHANG Xiaoye, WANG Yaqiang, et al. Estimation of emissions from field burning of crop straw in China[J]. Chinese Science Bulletin, 2008, 53(5): 784-790.
[5] MAAS R H, BAKKER R R, EGGINK G, et al. Lactic acid production from xylose by the fungus Rhizopus oryzae[J]. Applied Microbiology and Biotechnology, 2006, 72(5): 861-868.
[6] PARK E Y, ANH P N, OKUDA N. Bioconversion of waste office paper to L(+)-lactic acid by the filamentous fungus Rhizopus oryzae[J]. Bioresource Technology, 2004, 93(1): 77-83.
[7] BAI Dongmei, LI Shizhong, CUI Zhanfeng, et al. Enhanced L-(+)-lactic acid production by an adapted strain of Rhizopus oryzae using corncob hydrolysate[J]. Applied Biochemistry and Biotechnology,2008, 144(1): 79-85.
[8] MAAS R H, SPRINGER J, EGGINK G, et al. Xylose metabolism in the fungus Rhizopus oryzae: effect of growth and respiration on L(+)-lactic acid production[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(6): 569-578.
[9] 刘宇鹏, 郑璞, 倪晔, 等. Actinobacillus succinogenes抗氟乙酸突变株的选育及其[J]. 生物工程学报, 2008, 24(3): 460-467.
[10] ABE A, ODA Y, ASANO K, et al. Rhizopus delemar is the proper name for Rhizopus oryzae fumaric-malic acid producers[J]. Mycologia,2007, 99(5): 714-722.
[11] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[12] BETTIGA M, HAHN-HAGERDAL B, GORWA-GRAUSLUND M F,et al. Comparin xylose reductase/xylitol dehydrogenase and xylose isomerase pathways in arabinose and xylose fermenting Saccharomyces cerevisiae strains[J]. Biotechnology for Biofuels,2008, 1(1): 16. doi: 10.1186/1754-6834-1-16.
[13] REN Lujing, HUANG He, XIAO Aihua, et al. Enhanced docosahexaenoic acid production by reinforcing acetyl-CoA and NADPH supply in Schizochytrium sp. HX-308[J]. Bioprocess and Biosystems Engineering, 2009, 32(6): 837-843.
[14] QUARTARARO C E, HADI T, CAHILL S M, et al. Solvent isotopeinduced equilibrium perturbation for isocitrate lyase[J]. Biochemistry,2013, 52(51): 9286-9293.
[15] REN Lujing, FENG Yun, LI Juan, et al. Impact of phosphate concentration on docosahexaenoic acid production and related enzyme activities in fermentation of Schizochytrium sp.[J]. Bioprocess and Biosystems Engineering, 2013, 36(9): 1177-1183.
[16] MARIET J, GUETTLER M V, MAHENDAR K J. Environmental and physiological factors affecting the succinate product ratio during carbohydrate fermentation by Actinobacillus sp. 130Z[J]. Archives of Microbiology, 1997, 167(6): 332-342.
[17] KREGIEL D. Succinate dehyd rogenase activity assay in situ with blue tetrazolium salt in crabtree-positive Saccharomyc es cerevisiae strain[J]. Food Technology Biotechnology, 2008, 46(4): 376-380.
[18] JONGH W A, NIELSEN J. Enhanced citrate production through gene insertion in Aspergillns niger[J]. Metabolic Engineering, 2008, 10(2):87-96.
[19] MCHINLAY J B, SHACHAR-HILL Y, ZEIKUS J G, et al. Determining Actinobacillus succinogenes metabolic pathways and fl uxes by NMR and GC-MS analysis of13C-labeled metabolic product isotopomers[J]. Metabolic Engineering, 2007, 9(2): 177-192.
[20] BAI Dongmei, ZHAO Xueming, LI Xingang, et al. Strain i mprovement of Rhizopus oryzae for over-production of L(+)-lactic acid and metabolic fl ux analysis[J]. Biochemical Engineering Journal,2004, 18(1): 41-48.
[21] LONGACRE A, REIMERS J M, GANNON J E, et al. Flux analysis of glucose metabolism in Rhizopus oryzae for the purpose of increasing lactate yields[J]. Fungal Genetics and Biology, 1997, 21(1): 30-39.
Mutation and Metabolism Analysis for a Malic Acid-Producing Rhizopus delemar Strain Utilizing Corn Cob Hydrolysate
SUN Ting1, YANG Ying2, WANG Hualin1, WANG Haitao1, WU Xuefeng1, ZHANG Min1, CHEN Xiaoju1, PAN Lijun1,JIANG Shaotong1, LI Xingjiang1,*
(1. School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China;2. School of Environment and Energy Engineering, Anhui Jianzhu University, Hefei 230601, China)
High-level production of malic acid by fermentation of corn cob hydrolysate with an isolated Rhizopus delemar strain was expected. Then metabolic analysis and research of the underlying mechanism were carried out. Phylogenetic analysis based on ITS region sequences was carried out for the identifi cation of X-ray-induced mutant strains, and the key enzyme activities and metabolic fl ux were also analyzed. The results showed 3 “TAA” codons in the alcohol dehydrogenase gene of the anti-allyl mutant strain, which interrupt the pathway of ethanol metabolism. The breeding for the antifl uoroacetate mutant strain succeeded to decrease the fl ux of fumaric and succinic acid. Some NADP (H)-binding loci were mutated in the G6PDH gene of the mutant, probably leading to increased interaction of Embden-Meyerhof-Parnas pathway with Hexose-Monophophate pathway and improved pentose metabolism. After two-step breeding and regulation for this isolated strain, the production of malic acid was enhanced markedly; the formation of ethanol, fumaric acid and succinic acid were decreased simultaneously. Compared with the parent strain, the proportion of malic acid in mutant strain-2 increased to 91% from 71% and the yield of malic acid was increased markedly, which is of signifi cance for deep industrial development.
malate; corn cob hydrolysate; metabolic fl ux analysis; glucose-6-phosphate dehydrogenase
TS201.3
A
1002-6630(2015)15-0090-08
10.7506/spkx1002-6630-201515018
2014-09-27
国家自然科学基金面上项目(31470002;31371859)
孙婷(1990—),女,硕士研究生,研究方向为工业微生物。E-mail:sunting@mail.hfut.edu.cn
李兴江(1978—),男,副教授,博士,研究方向为发酵工程代谢调控。E-mail:lixingjiang1978@hfut.edu.cn
