影响精氨酸-还原糖模拟体系荧光性晚期糖基化终末产物形成的因素
2015-11-02夏秋琴吕丽爽
夏秋琴,吕丽爽
(南京师范大学金陵女子学院,江苏 南京 210097)
影响精氨酸-还原糖模拟体系荧光性晚期糖基化终末产物形成的因素
夏秋琴,吕丽爽*
(南京师范大学金陵女子学院,江苏 南京 210097)
目的:通过建立精氨酸-还原糖模拟体系,考察影响该体系荧光性晚期糖基化终末产物(advanced glycation end products,AGEs)形成的因素。方法:对建立的精氨酸-还原糖模拟体系,采用荧光光谱法(λex/λem=370 nm/440 nm)检测反应温度、还原糖浓度、pH值、金属离子和抑制剂染料木黄酮对AGEs形成的影响;并分析各个影响因素的作用效果。结果:在单个影响因素:反应温度(121 ℃)、还原糖及其浓度(3 mmol/L的核糖)、pH值(9.2)和金属离子(Fe3+)作用下,产生荧光性AGEs作用效果最强,9 mmol/L抑制剂染料木黄酮对荧光性AGEs的形成有抑制作用。结论:反应时间、反应温度、还原糖种类及其浓度、pH值、金属离子和抑制剂染料木黄酮均对精氨酸-还原糖模拟体系荧光性AGEs的形成有影响,在该模拟体系中,反应时间是影响荧光性AGEs产生最主要的因素,其次为还原糖的种类。
荧光性晚期糖基化终末产物;荧光光谱;精氨酸-还原糖模拟体系;染料木黄酮;还原糖
非酶糖基化反应,也被称为非酶褐变和美拉德反应,是发生于还原糖和蛋白质的氨基酸基团之间的一类复杂的反应,它对于食品中风味物质、颜色色泽的形成具有重要作用[1]。还原糖和蛋白质发生的连续性非酶糖基化反应会产生中间产物——活性二羰基化合物,包括丙酮醛(methylglyoxal,MGO)和乙二醛(glyoxal,GO)等,进而在此高活性中间产物的诱导下反应形成不可逆转的晚期糖基化终末产物(advanced glycation end products,AGEs)[2]。AGEs可通过食物摄入,亦会在体内蓄积[3-4]并导致某些疾病的发生,如糖尿病、动脉粥样硬化、阿兹海默症和慢性心脏衰竭等[5-7]。有文献报道,精氨酸(arginine,Arg)是发生糖基化反应形成体系复杂的AGEs的主要氨基酸,如2003年,Brock等[8]揭示了Arg残基是核糖核酸酶糖基化的主要位点;另外Lima等[9]等发现由MGO诱导的β-酪蛋白糖基化的位点中也有Arg。
除了糖基化反应主体氨基酸残基Arg之外,活性羰基、还原糖及还原糖氧化降解产生的二羰基化合物(MGO、GO)在糖基化反应进程中也起到了至关重要作用。活性羰基化合物与游离氨基酸作用会产生一系列小分子的AGEs产物。Arg含有的胍基(-CN3H4)基团会加速精氨酸与还原糖降解产生的活性二羰基化合物MGO作用,产生的产物为Argpyrimidine[10];Arg与GO作用的产物为(S,S)-1-[4-(acetylamino)-4-carboxy-1-butyl]-2-imino-4-[(Z)-(2-furyl)-methylidene]-5-{2-[1-[4-(acetylamino)-4-carboxy-1-butyl]-4-[(E)-(2-furyl)methylidene]-5-oxo-1,3-imidazol-2inyl]}azamethylidene-1,3-imidazolidine(BISARG)[11]。另外,Arg与葡萄糖交联反应会产生Pentosidine[12]。这些产物的成功分离为AGEs形成途径和机制提供了重要的信息。
食品中AGEs的形成取决于食物所含的成分以及食物的加工方式[13]。在食品加工过程中,非酶糖基化反应(Maillard反应)赋予了食品色、香、味;同时其复杂的反应也产生了一些有害产物。随着对Maillard反应产物研究的逐步深入,如何降低有害终产物的产生,改善加工条件成为当前研究的热点。据文献报道食品成分[14],如:蛋白质类别、还原糖种类以及这些成分含量的高低[15];食品加工的方式[16],如:加热、高温灭菌等;热处理的时间;食品的酸碱度[17]以及食品中其他配料、天然AGEs抑制剂等都会直接或间接影响蛋白糖基化反应从而对AGEs的产生起到举足轻重的作用。
1 材料与方法
1.1材料与试剂
精氨酸 生工生物工程(上海)股份有限公司;葡萄糖、果糖、核糖、半乳糖 上海国药化学试剂有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 广东省化学试剂工程技术研究开发中心;染料木黄酮 南京广润生物制品有限公司;Na2HPO4·12H2O、NaH2PO4·2H2O为分析纯。
1.2仪器与设备
FA2104N电子分析天平 上海精密科学仪器有限公司;PHS-3C数字式pH计 上海三信仪表厂;XW-80A微型漩涡混合仪 上海沪西分析仪器厂有限公司;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;HH-S数显恒温油浴锅 金坛市医疗仪器厂;多孔酶标仪 瑞士帝肯贸易有限公司。
1.3.1反应温度对精氨酸-还原糖模拟体系荧光性AGEs形成的影响
根据文献[18-19]的测定方法加以引用,用0.2 mol/L pH 7.4的磷酸盐缓冲液(phosphate buffered saline,PBS)溶解精氨酸、葡萄糖、果糖、核糖和半乳糖,在10 mL样品管中分别加2 mL精氨酸、2 mL各类还原糖和2 mL PBS,使精氨酸的最终浓度为1 mmol/L,还原糖的最终浓度为1 mmol/L。混匀,于37、60、85、100、121 ℃分别加热0、15、30、45、60、90、120、240 min,取样1 mL于2 mL样品管,-20 ℃保存。解冻后于λex/λem= 370 nm/440 nm测定荧光值。
1.3.2还原糖浓度对精氨酸-还原糖模拟体系荧光性AGEs形成的影响
参照文献[18-19]的方法加以改进,用0.2 mol/L pH 7.4的PBS溶解精氨酸、葡萄糖、果糖、核糖和半乳糖,在10 mL样品管中分别加2 mL精氨酸,2 mL各类还原糖和2 mL PBS,使精氨酸的最终浓度为1 mmol/L,还原糖的最终浓度分别为0.5、1、2、3 mmol/L。混匀,于100 ℃分别加热0、15、30、45、60、90、120、240 min,取样1 mL于2 mL样品管,-20 ℃保存。解冻后于λex/λem= 370 nm/440 nm测定荧光值。空白组为2 mL的精氨酸和4 mL的PBS缓冲液,混合均匀。
1.3.3pH值对精氨酸-还原糖模拟体系荧光性AGEs形成的影响
据文献[18-19]的检测方法加以引用,分别用0.2 mol/L pH 4.0、6.5、7.4、9.2的PBS溶解精氨酸、葡萄糖、果糖、核糖和半乳糖,在10 mL样品管中分别加2 mL精氨酸、2 mL各类还原糖和2 mL PBS,使精氨酸的最终浓度为1 mmol/L,还原糖的最终浓度为1 mmol/L。混匀,于100 ℃分别加热0、15、30、45、60、90、120、240 min,取样1 mL于2 mL样品管,-20 ℃保存。解冻后于λex/λem= 370 nm/440 nm测定荧光值。
1.3.4金属离子对精氨酸-还原糖模拟体系荧光性AGEs形成的影响
图5为卡箍类半环形薄壁铸件的浇注系统方案[6]。蜡模起模后,质地较软。为防止蜡模变形在蜡件上增设了工艺筋。该件底部两端的热节通过底部开内浇口消除,但浇口横截面太小引起了其他部位的缩松。其改进方案为:仍是底部开浇口,通过开侧浇口增大有效横截面积并将2件合1件进行组树。
根据文献[18-19]的测定方法改进,用pH 7.4的PBS分别溶解含有Fe3+、Fe2+、Mg2+、Ca2+和Zn2+氯化物,使其浓度均为0.02 mmol/L,以此溶解精氨酸、葡萄糖、果糖、核糖和半乳糖,在10 mL样品管中分别加2 mL精氨酸,2 mL各类还原糖和2 mL PBS,使精氨酸的最终浓度为1 mmol/L,还原糖的最终浓度为1 mmol/L。混匀,于100 ℃分别加热0、15、30、45、60、90、120、240 min,取样1 mL于2 mL样品管,-20 ℃保存。解冻后于λex/λem= 370 nm/440 nm测定荧光值。空白组是2 mL的精氨酸和2 mL的每组对应的还原糖,再加上2 mL的PBS缓冲液,混合均匀。
1.3.5抑制剂染料木黄酮对精氨酸-还原糖模拟体系荧光性AGEs形成的影响
依据文献[18-19]的方法加以改进,用0.2 mol/L pH 7.4的PBS溶解精氨酸和核糖,在10 mL样品管中分别加2 mL精氨酸、2 mL核糖,使精氨酸的最终浓度为1 mmol/L,还原糖的最终浓度为1 mmol/L,再加2 mL用DMSO溶解的染料木黄酮,使其浓度分别为1.5、3、6、9 mmol/L。混匀,于100 ℃分别加热0、15、30、45、60、90、120、240 min,取样1 mL于2 mL样品管,-20 ℃保存。解冻后于λex/λem= 370 nm/440 nm测定荧光值。以抑制率反映染料木黄酮对荧光性AGEs的抑制作用。
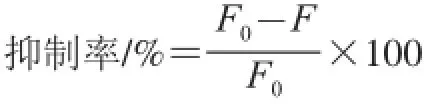
式中:F0为初始荧光值;F为实验荧光值。
1.4数据分析
采用Excel 2013和Minitab 16软件进行数据统计分析,Excel 2013软件用于分析实验所测得的荧光性AGEs;Minitab 16软件用于分析各个影响因素的作用效果,其中每组实验数据均做3 组平行,测定结果以平均值表示。
2 结果与分析
2.1反应温度对精氨酸-还原糖模拟体系产生荧光性AGEs的影响
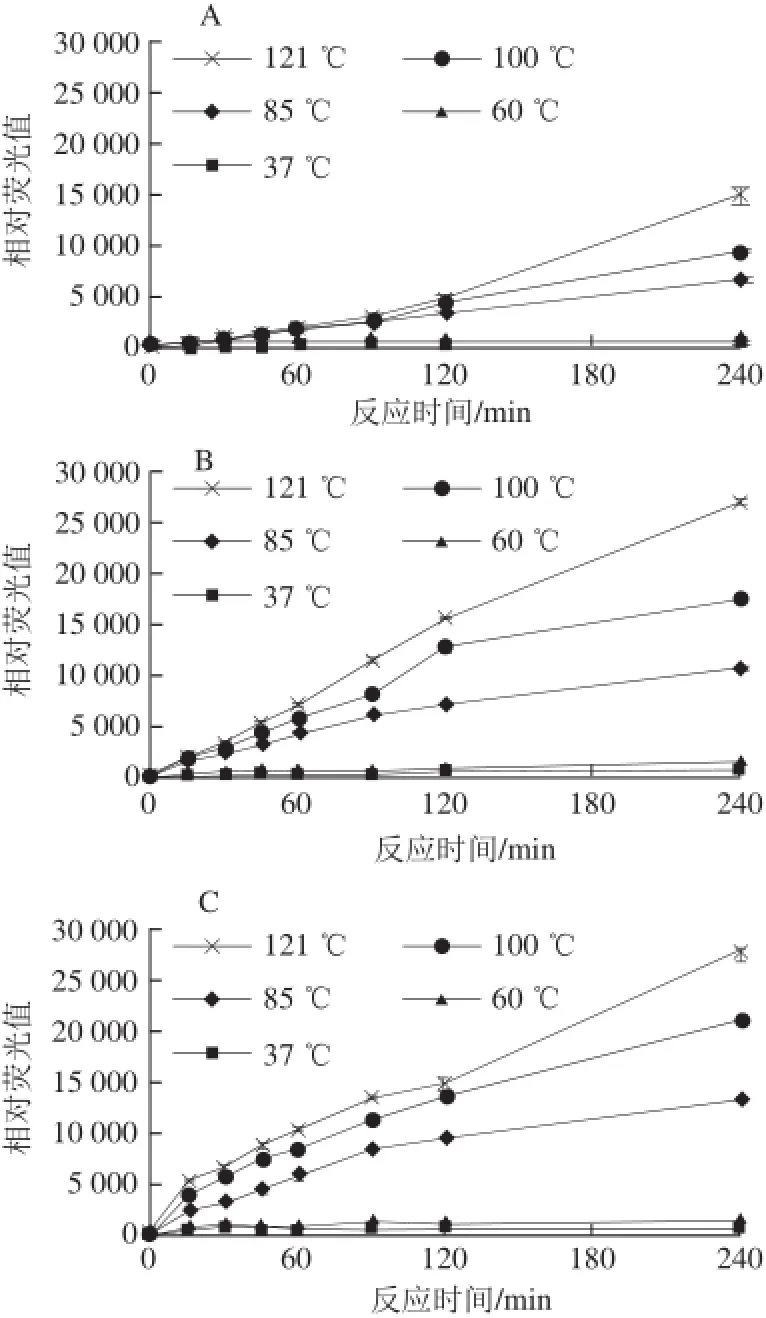
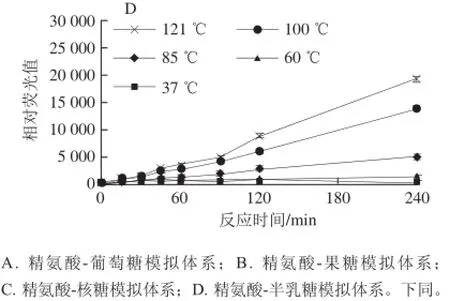
图1 反应温度对荧光性AGEs生成的影响Fig.1 Effect of reaction temperature on the formation of fluorescent AGEs
由图1可知,反应温度(37~121 ℃)对精氨酸与各个还原糖模拟体系中荧光性AGEs的形成亦存在显著性(P≤0.05)影响,特别是温度高于85 ℃以后。随着反应温度的升高,荧光性AGEs产生的量增加,而低于60 ℃在240 min内几乎没有荧光性AGEs的产生。另外,核糖和果糖诱导精氨酸产生的荧光性AGEs的量较为接近,且高于相应的葡萄糖和半乳糖,而葡萄糖和半乳糖诱导的精氨酸的量相当,但是比较低。
2.2还原糖浓度对精氨酸-还原糖模拟体系产生荧光性AGEs的影响
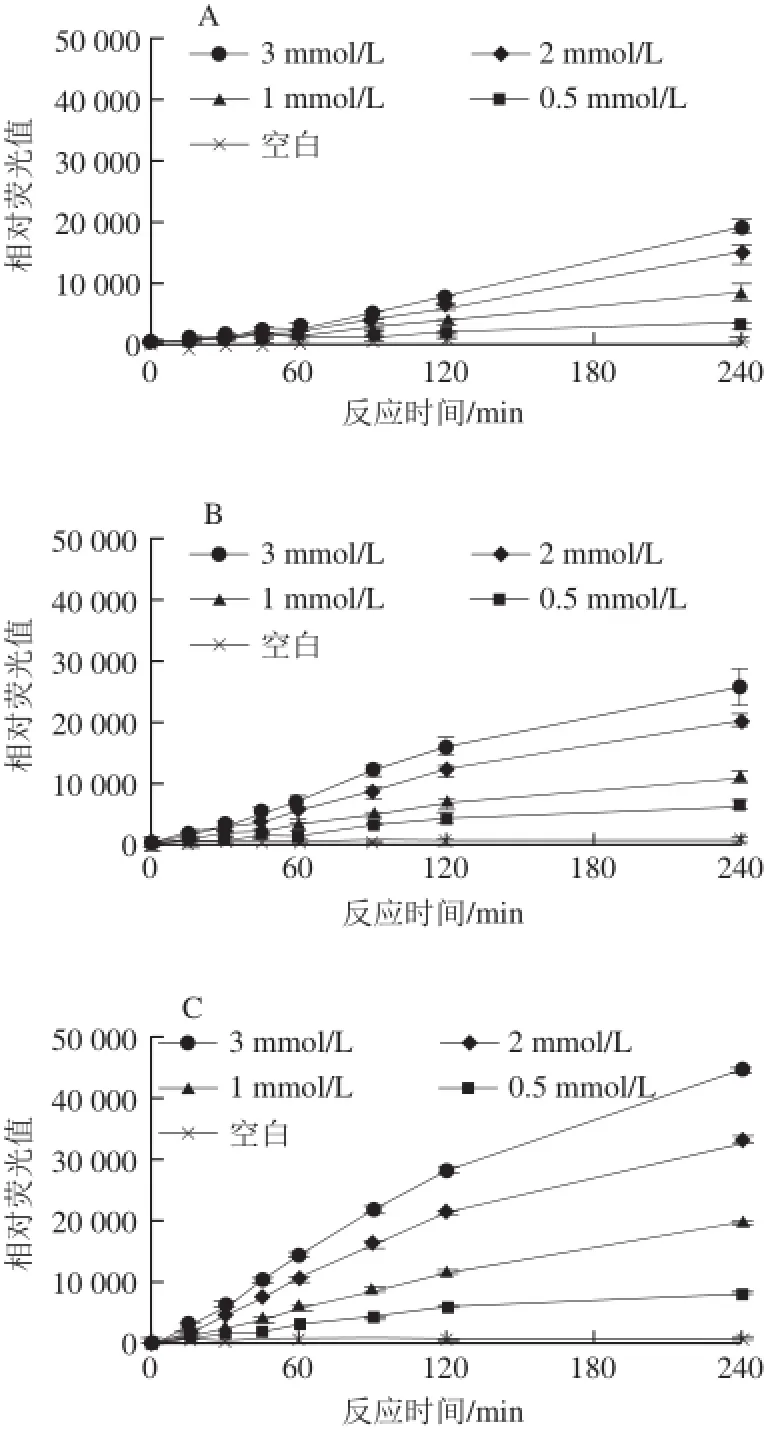
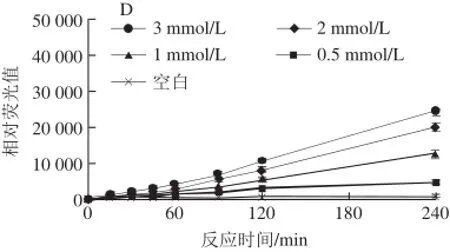
图2 还原糖浓度对荧光性AGEs生成的影响Fig.2 Effect of reducing sugar concentration on the formation of fluorescent AGEs
由图2可知,精氨酸-还原糖模型中,各种还原糖(葡萄糖、果糖、核糖和半乳糖)和精氨酸反应产生的荧光性AGEs的量均随着还原糖浓度的增大而增加。其中在精氨酸-核糖模型中,荧光性AGEs的强度是最高的,其他3 种糖诱导产生荧光性AGEs量相差不大,依次为果糖、葡萄糖、半乳糖;当浓度为3 mmol/L、反应时间为240 min时,核糖诱导产生的AGEs量约为其他3 种糖的2 倍。因为核糖为五碳糖,反应速率比六碳糖的葡萄糖等还原糖快[20]。此外,在精氨酸-还原糖模型中,随着时间的延长,各模型产生的荧光性AGEs的量呈逐渐递增的趋势。
2.3pH值对精氨酸-还原糖模拟体系产生荧光性AGEs的影响
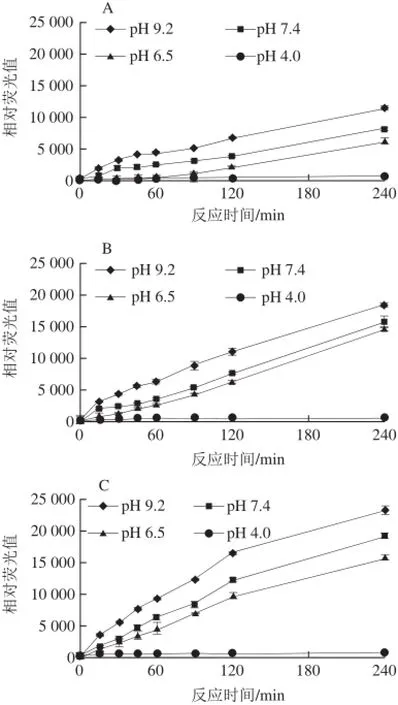
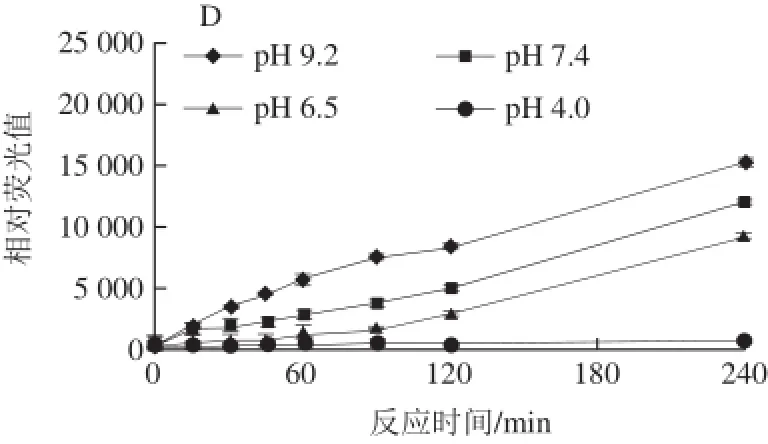
图3 pH值对荧光性AGEs生成的影响Fig.3 Effect of pH on the formation of fluorescent AGEs
由图3可知,pH值(4.0、6.5、7.4和9.2)越接近碱性,体系的荧光强度就越高;酸性条件pH 4.0条件下几乎不产生荧光性AGEs,文献[21]报道说在偏酸性环境中,N-葡萄糖胺容易被水解因此不利于反应的进行;而碱性条件pH 9.2的荧光性AGEs则随着时间的延长不断增强。此外,模型中以精氨酸-核糖模型反应最强烈,其次分别为果糖、半乳糖和葡萄糖模型。
2.4金属离子对精氨酸-还原糖模拟体系产生荧光性AGEs的影响
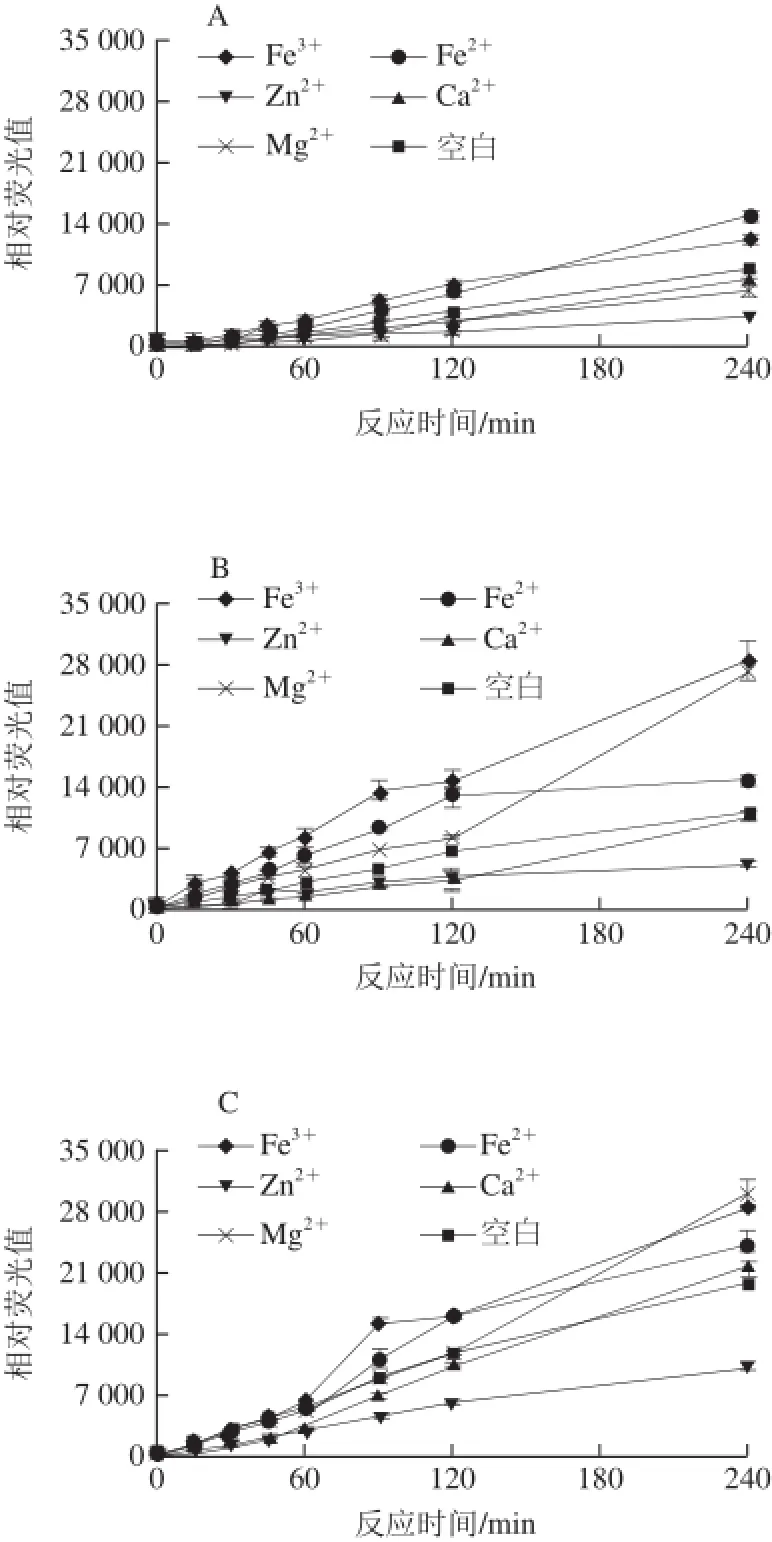
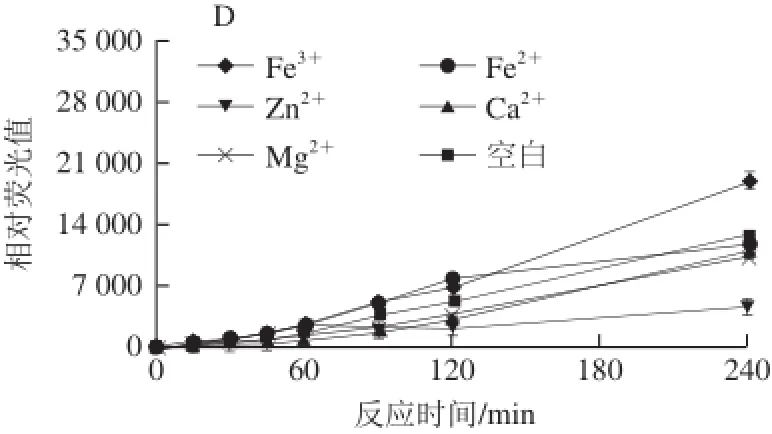
图4 金属离子对荧光性AGEs生成的影响Fig.4 Effect of metal ions on the formation of fluorescent AGEs
由图4可知,5 类金属离子对体系中荧光性AGEs的产生作用效果不一。其中,在4 个还原糖模拟体系下,Zn2+对体系荧光性AGEs的产生起抑制作用;Ca2+的作用效果并不明显。在精氨酸-核糖和精氨酸-果糖体系,金属离子Fe3+、Mg2+和Fe2+的存在对体系荧光性AGEs的产生有促进作用,而在精氨酸-半乳糖体系,只有Fe3+对荧光性AGEs起促进作用。而Mg2+在精氨酸-葡萄糖体系中起轻微抑制作用。Kwak等[22]的研究也表明Fe3+和Fe2+会促进酶促反应的进行,而Ca2+作用效果不明显;文献[23-24]报道称过渡金属离子如Fe3+和Fe2+等会通过氧化途径和催化作用形成自由基从而对荧光性AGEs的产生起到促进作用。
2.5抑制剂染料木黄酮对精氨酸-核糖模拟体系产生荧光性AGEs的影响
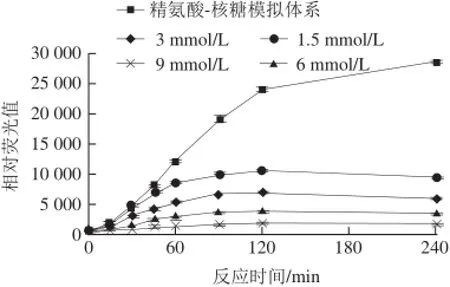
图5 抑制剂染料木黄酮浓度对荧光性AGEs生成的影响Fig.5 Effect of genistein on the formation of fluorescent AGEs
由图5可知,抑制剂染料木黄酮对精氨酸-核糖体系产生的荧光性AGEs有抑制作用。在反应240 min之内,染料木黄酮的抑制效果随其浓度的增加而加强,在精氨酸-核糖模型中,当反应时间达到240 min、染料木黄酮浓度为1.5、3、6、9 mmol/L时,对荧光性AGEs的抑制率分别达68%、79%、88%和95%。说明染料木黄酮对于荧光性AGEs有显著抑制作用。Jung等[25]通过荧光检测的方法寻找AGEs受体的阻断剂,在检测了50 个样品之后,发现染料木黄酮可以阻止AGE-RAGE的交联,并且随着染料木黄酮剂量的增加,其阻断程度也呈线性增加。因此,表明染料木黄酮可以作为断裂剂起到阻断AGEs交联的作用。
2.6影响荧光性AGEs形成的因素及其交互作用分析
影响精氨酸-还原糖模拟体系荧光性AGEs形成的因素及其交互作用如表1所示。在精氨酸-还原糖模拟体系中,反应时间是影响其产生荧光性AGEs最主要的因素,而还原糖种类则屈居第二,与反应时间所占比例相比,还原糖种类要低很多。此外,pH值、还原糖浓度、金属离子以及反应温度对体系荧光性AGEs的产生所占比例都不是很高,并且相差不大。虽然抑制剂染料木黄酮可以明显抑制荧光性AGEs的产生,但与反应时间相比,染料木黄酮所占比例不高。此外,在交互作用中,反应时间与反应温度的交互作用对体系荧光性AGEs的产生作用效果比较高。
3 结 论
精氨酸-还原糖模拟体系在加热条件下会产生一系列有荧光性吸收的AGEs,一些影响因素,如反应温度、还原糖浓度、pH值、金属离子以及抑制剂染料木黄酮对于荧光性AGEs的产生有重要作用,其中,当反应时间一定,反应温度(37、60、85、100、121 ℃)越高、还原糖浓度(0.5、1、2、3 mmol/L)越高,产生荧光性AGE的强度就越高;pH值接近9.2时产荧光性AGEs比较(pH 4.0、6.5、7.4)多;此外,抑制剂染料木黄酮对荧光性AGEs的形成有抑制作用。
在反应时间、反应温度、还原糖浓度、pH值、金属离子以及抑制剂染料木黄酮等影响因素和交互作用中,反应时间是影响精氨酸-还原糖体系形成荧光性AGEs的最重要因素,其次为还原糖种类。其他作用因素,如反应温度、pH值、金属离子、还原糖浓度以及抑制剂染料木黄酮均对荧光性AGEs的形成有作用,但作用程度相较反应时间低。
[1] HENLE T. Protein-bound advanced glycation endproducts (AGEs)as bioactive amino acid derivatives in foods[J]. Amino Acids, 2005,29(4): 313-322.
[2] LUEVANO-CONTRERES C, CHAPMAN-NOVAKOFSKI K. Dietary advanced glycation end products and aging[J]. Nutrients, 2010, 2(12):1247-1265.
[3] URIBARRI J, WOODRUFF S, GOODMAN S. Advanced glycation end products in foods and a practical guide to their reduction in the diet[J]. Journal of the American Dietetic Association, 2010, 110(6):911-916.
[4] KRAJCOVICOVA-KUDLACKOVA M, SEBEKOVA K, SCHINZEL R,et al. Advanced glycation end products and nutrition[J]. Physiological Research, 2002, 51(3): 313-316.
[5] SMIT A J, HERTOG J W, VOORS A A, et al. Advanced glycation end products in chronic heart failure[J]. Annals of the New York Academy of Sciences, 2008, 1126: 225-230.
[6] MEERWALDT R, LINKS T, ZEEBREGTS C, et al. The clinical relevance of assessing advanced glycation end products accumulation in diabetes[J]. Cardiovasc Diabetol, 2008, 7: 29. doi: 10.1186/1475-2840-7-29.
[7] BAYNES J W, THORPE S R. Role of oxidative stress in diabetic complications: a new perspective on an old paradigm[J]. Diabetes,1999, 48(1): 1-9.
[8] BROCK J W, HINTON D J, COTHAM W E, et al. Proteomic analysis of the site specifi city of glycation and carboxymethylation of ribonuclease[J]. Journal of Proteome Research, 2003, 2(5): 506-513.
[9] LIMA M, MOLONEY C, AMES J M, et al. Ultra performance liquid chromatography-mass spectrometric determination of the site specificity of modification of beta-casein by glucose and methylglyoxal[J]. Amino Acids, 2009, 36(3): 475-481.
[10] WILKER S C, CHELLAN P, ARNOLD B M, et al. Chromatographic quantification of argpyrimidine, a methylglyoxal-derived product in tissue proteins: comparison with pentosidine[J]. Analytical Biochemi stry, 2001, 290(2): 353-358.
[11] HOFMANN T. 4-Alkylidene-2-imino-5-[4-alkylidene-5-oxo-1,3-imidazol-2-inyl]aza- methylidene-1,3-imidazolidine: a novel colored substructure in melanoidins formed by Maillard reactions of bound arginine with glyoxal and furan-2-carboxaldehyde[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 3896-3901.
[12] GRILLO M A, COLOMBATTO S. Advanced glycation end-products(AGEs): involvement in aging and in neurodegenerative diseases[J]. Amino Acids, 2008, 35(1): 29-36.
[13] MALENE W P, RIKKE V H, JEANETTE M, et al. Advanced glycation end products in food and their effects on health[J]. Food and Chemical Toxicology, 2013, 60: 10-37.
[14] HWANG I G, KIM H Y, WOO K S. Biological activities of Maillard reaction products (MRPs) in a sugar-amino acid model system[J]. Food Chemistry, 2011, 126(1): 221-227.
[15] BENJAKUL S, LERTITTIKUL W, BAUER F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J]. Food Chemistry, 2005, 93(2): 189-196.
[16] YILMAZ Y, TOLEDO R. Antioxidant activity of water-soluble Maillard reaction products[J]. Food Chemistry, 2005, 93(2): 273-278.
[17] KIM J S, LEE Y S. Effect of reaction pH on enolization and racemization reactions of glucose and fructose on heating with amino acid enantiomers and formation of melanoidins as result of the Maillard reaction[J]. Food Chemistry, 2008, 108(2): 582-592.
[18] SANG Shengmin, SHAO Xi, BAI Naisheng, et al. Tea polyphenol(-)-epigallocatechin-3-gallate: a new trapping agent of reactive dicarbonyl species[J]. Chemical Research in Toxicology, 2007, 20:1862-1870.
[19] 房红娟, 李红姣, 张双凤, 等. 加工条件对BSA-Glucose模拟体系中晚期糖基化末端产物形成的影响[J]. 食品科学, 2012, 33(21): 6-10.
[20] LAROQUE D, INISAN C, BERGER C, et al. Kinetic study on the Maillard reaction. Consideration of sugar reactivity[J]. Food Chemistry, 2008, 111(4): 1032-1042.
[21] 肖怀秋, 李玉珍, 林亲录. 美拉德反应及其在食品风味中的应用研究[J]. 中国食品添加剂, 2005(2): 27-30.
[22] KWAK E J, LIM S I. The effect of sugar, amino acid, metal ion, and NaCl on model Maillard reaction under pH control[J]. Amino Acids,2004, 27(1): 85-90.
[23] RAMONAITYTE D T, KERSIENE M, ADAMS A, et al. The interaction of metal ions with Maillard reaction products in a lactoseglycine model system[J]. Food Research International, 2009, 42(3):331-336.
[24] MORITA J, KASHIMURA N. The Maillard reaction of DNA with D-fructose 6-phosphate[J]. Agricultural and Biological Chemistry,1991, 50: 1359-1366.
[25] JUNG D H, KIM Y S, KIM J S. Screening system of blocking agents of the receptor for advanced glycation end products in cells using fluorescence[J]. Biological & Pharmaceutical Bulletin, 2012, 35(10):1826-1830.
Factors Influencing the Formation of Fluorescent AGEs in Arginine-Reducing Sugar Model System
XIA Qiuqin, L☒ Lishuang*
(Ginling College, Nanjing Normal University, Nanjing 210097, China)
Purpose: To investigate the factors infl uencing the formation of fl uorescent AGEs in Arg-reducing sugar model system. Methods: The infl uencing factors including temperature, reducing sugar concentration, pH, metal ion and genistein concentration were detected by fl uorescence spectrometry, (λex/λem= 370 nm/440 nm). Results: Based on the preliminary one-factor-at-a-time experiments, a reaction temperature of 121 ℃, addition of 3 mmol/L ribose as a reducing sugar, pH 9.2 and the presence of Fe3+were the best conditions for the formation of fl uorescent AGEs, whereas 9 mmol/L genistein could effectively inhibit the formation of fl uorescent AGEs. Conclusion: Reaction temperature, reducing sugar concentration, pH,and metal ion have a signifi cant effect on the formation of fl uorescent AGEs, and genistein could inhibit the fl uorescent AGEs. Among these influencing factors reaction time has the greatest influence on the formation of fluorescent AGEs,followed by reducing sugar type.
fl uorescent advanced glycation end products (AGEs); fl uorescence spectrometry; arginine-reducing sugar model system; genistein; reducing sugar
TS201.2
A
1002-6630(2015)15-0050-06
10.7506/spkx1002-6630-201515011
2014-09-29
江苏省基础研究计划(自然科学基金)资助项目(BK2012850);浙江省自然科学基金项目(LY12C15001)
夏秋琴(1989—),女,硕士,研究方向为食品科学。E-mail:Shally0809@126.com
吕丽爽(1969—),女,副教授,博士,研究方向为食品化学和功能性食品。E-mail:lishuanglv@126.com
