脂肽类生物表面活性剂Surfactin的乳化性
2015-11-02郭芳芳陆兆新别小妹吕凤霞
戴 超,郭芳芳,陆兆新,别小妹,张 充,吕凤霞*
(南京农业大学食品科技学院,江苏 南京 210095)
脂肽类生物表面活性剂Surfactin的乳化性
戴 超,郭芳芳,陆兆新,别小妹,张 充,吕凤霞*
(南京农业大学食品科技学院,江苏 南京 210095)
采用白金板法对Surfactin的表面活性进行研究,并用浊度法和离心法对其乳化性进行研究。结果表明:Surfactin的临界胶束浓度为9.03×10-5mol/L,可将水的表面张力由73.98 mN/m降至最低27.48 mN/m。在浓度为1×10-3~1.2×10-2mol/L的NaCl溶液中,Surfactin溶液的表面张力随盐浓度升高逐渐降低并最终稳定在34 mN/m;Surfactin在121 ℃处理20 min后,其表面张力仍能保持在37.10 mN/m;在pH值为2~12范围内,其表面活性稳定并良好;表明Surfactin具有较强的NaCl浓度、温度、pH值的耐受性。浊度法测得Surfactin亲水亲油平衡(hydrophile lipophilic balance,HLB)值为14,对所需HLB值为12~16的油相乳化性能良好。
脂肽类生物表面活性剂;Surfactin;乳化性;亲水亲油平衡值
脂肽类生物表面活性剂(lipopeptides biosurfactants)主要是由芽孢杆菌产生的一类胞外分泌的次级代谢产物。它们具有生物相容性、生物降解性、较高的表面活性及抗菌活性等特性,其超强的表面活性被广泛应用于石油开采、环境治理、生物医疗、农业、化妆品和食品工业等领域。乳化剂是表面活性剂中的一种,是食品工业上不可或缺的食品添加剂种类之一,有分散不相溶两相物质的能力[1-2]。Surfactin的结构中有着亲水的氨基酸残基基团和疏水的脂肪烃链,这决定了Surfactin具有乳化剂的性质[3]。这显示了它在食品工业中具有巨大的应用前景,比如与淀粉结合,改善产品质构;阻止小液滴互相凝结,改善产品稳定性;与蛋白质相互作用,增进面团的网络结构,增强韧性等[4-6]。由于不同结构的生物表面活性剂其物理化学性质,如表面活性、最适pH值和对热的稳定性等不同,这也就决定其功能和应用领域。目前,对脂肽类表面活性剂研究较多的是表面活性素(surfactin),Surfactin虽应用广泛,但多用于原油的开采和环境治理上,关于其乳化性的应用报道甚少。因此,对脂肽类生物表面活性剂的乳化性等相关性质进行研究对其今后的应用具有重要的现实意义。同时,Surfactin具有的乳化性和抗菌性符合功能性食品和绿色食品添加剂的要求,因而本实验采用白金板法对Surfactin的表面活性进行了研究,并用浊度法和离心法对其乳化性进行了研究,细化地研究Surfactin的乳化性,为其在食品以及化妆品等行业中巨大的潜在应用价值提供参考。
1 材料与方法
1.1材料与试剂
Surfactin样品由淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)fmb50发酵分离纯化制得。
松节油 上海运佳黄浦制药有限公司;豆维家大豆油南京邦基粮油有限公司;其他试剂均为国产分析纯。
1.2仪器与设备
AY120电子精密天平 日本Shimadzu公司;Dragon-med移液器 大龙兴创实验仪器有限公司;Orion 3 STAR pH计 美国Orion公司;HYG-A全温摇瓶柜 太仓实验设备厂;Centrifuge 5804R冷冻离心机德国Eppendorf公司;BC/BP-225SB海尔冷柜 海尔集团;LABOROTA-4001旋转蒸发仪 德国Heidolph公司;B25系列乳化机 上海贝而特流体设备有限公司;DCAT21型表面张力仪 德国Dataphyscis公司。
1.3方法
1.3.1Bacillus amyloliquefaciens fmb50的发酵
取菌种fmb50斜面置于37 ℃培养箱活化18~24 h,从斜面挑取两环接种于一级种子培养基(1 L摇瓶,装液量200 mL),摇床(33 ℃、180 r/min)培养18~24 h,从一级种子液中以体积分数3%的接种量接种于二级种子液,再从二级种子液中相同的接种量接种于基础发酵培养基(100 L发酵罐,装液量60 L),在33 ℃、200 r/min、罐压0.045 MPa的条件下培养36 h。
1.3.2临界胶束浓度(critical micelle concentration,CMC)的测定
采用Whilhelmy白金板法测定表面张力,将制备液相纯化的Surfactin同系物混合并测定含量(10.75 g/L)稀释至不同倍数:30、40、50、60、80、100、150、250、500、1 000、2 000、4 000、6 000 倍;对应为358.33、268.75、215.00、179.17、134.38、107.50、71.67、43.00、21.50、10.75、5.38、2.69、1.79 mg/L。测定添加以上质量浓度Surfactin纯水的表面张力;并根据表面张力的变化趋势确定CMC。
1.3.3NaCl浓度对Surfactin溶液表面张力的影响
配制1×10-3、2×10-3、4×10-3、6×10-3、8×10-3、10×10-3mol/L浓度的NaCl溶液,并以水做对照,测定Surfactin质量浓度为10.75 mg/L的水表面张力。
1.3.4温度对Surfactin溶液表面张力的影响
在20、40、60、80、100、121 ℃温度条件下,处理10.75 mg/L的Surfactin溶液20 min;冷却至室温,测定其表面张力。
1.3.5pH值对Surfactin溶液表面张力的影响
在pH 2、4、6、8、10、12条件下测定10.75 mg/L的Surfactin溶液的表面张力。
1.3.6乳化性和乳化稳定性的测定
1.3.6.1浊度法
配制0.1、0.2、0.4、0.8、1.6 g/100 mL的Surfactin样品,每10 mL样品溶液加入3 mL大豆油,10 000×g乳化10 s,立即从底部取样20 μL并加入0.1%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)20 mL测定500 nm波长处的吸光度(A0)作为乳化性(emulsifying activity,EA)[7],同样的方法,在15 min后测定A15。乳化稳定性(emulsify stability,ES)[8]的计算见下式。

式中:A0为0时刻的吸光度;ΔT为时间差/min,此处取5 min;ΔA为ΔT内的吸光度差,即ΔA = A0-A15。
1.3.6.2离心法
配制0.1、0.2、0.4、0.8、1.6 g/100 mL的Surfactin样品,每10 mL样品溶液加入5 mL所需亲水亲油平衡(hydrophile lipophilic balance,HLB)值为14的油相,振荡乳化10 s后立即于3 000 r/min分别离心5 min和10 min,测定乳化层高度,其中离心5 min后测定乳化层高度并按下式计算得EA,离心10 min后测定乳化层高度,按下式计算得ES[9]。

式中:h'为液体总高度/cm;h为离心5 min或10 min后乳状层高度/cm。
1.3.7HLB值的测定
用大豆油(所需HLB = 6)和松节油(所需HLB = 16)配制成所需HLB值分别为6、8、10、12、14、16的油相。每15 份油相中加入5 份质量浓度为0.1 g/100 mL的Surfactin样品,振荡乳化10 s,立即从底部取样20 μL并加入0.1 g/100 mL的SDS 10 mL,取样在500 nm波长处测定吸光度。其中乳化稳定性最好的油相所需HLB值就是Surfactin样品的HLB值[10-11]。
2 结果与分析
2.1CMC的测定结果
当表面活性剂在溶液中的质量浓度达到一个定值会自发聚集成胶束,表面活性剂的这一质量浓度叫做CMC[12]。所以通过对液体表面张力变化的测定就可以测出某种表面活性剂的CMC。本实验采用白金板法测定CMC,将Surfactin稀释成13 种质量浓度,测定各质量浓度Surfactin溶液的表面张力,根据表面张力的变化趋势确定CMC,结果如图1所示。

图1 不同Surfactin质量浓度下溶液的表面张力Fig.1 Surface tension of surfactin at different concentrations
由图1可知,纯水的表面张力为(73.98±0.02) mN/m,随着Surfactin质量浓度的增加,溶液的表面张力显著下降,当质量浓度大于91.38 mg/L时,溶液的表面张力基本保持不变,维持在27.48 mN/m。表明Surfactin的CMC为 9.03×10-5mol/L。
2.2NaCl浓度对Surfactin溶液表面张力的影响
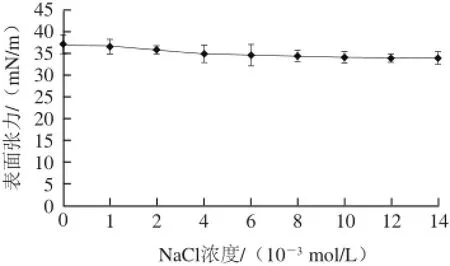
图2 NaCl浓度对Surfactin溶液表面张力的影响Fig.2 Effect of NaCl concentration on surfactin surface tension
由图2可知,随着NaCl浓度由低升高,溶液的表面张力逐渐减小,最低(NaCl浓度14×10-3mol/L)降至33.768 mN/m。即在浓度为1×10-3~1.2×10-2mol/L的NaCl溶液中,Surfactin溶液的表面张力随NaCl浓度升高逐渐降低并最终稳定在34 mN/m,说明Surfactin对NaCl浓度具有较高的耐受性[13],在较高的NaCl浓度下仍具有较强的表面活性,为其在食品工业中的应用提供依据。
2.3温度对Surfactin溶液表面张力的影响

图3 温度对Surfactin溶液表面张力的影响Fig.3 Effect of temperature on surfactin surface tension
由图3可知,Surfactin在20~100 ℃温度处理后表面活性稳定在36 mN/m左右,121 ℃时表面张力略有增大,达到37.1 mN/m,说明高温高压同时作用会分解少量的Surfactin。但总体来看,Surfactin还是具有优良的热稳定性[14]。
2.4pH值对Surfactin溶液表面张力的影响
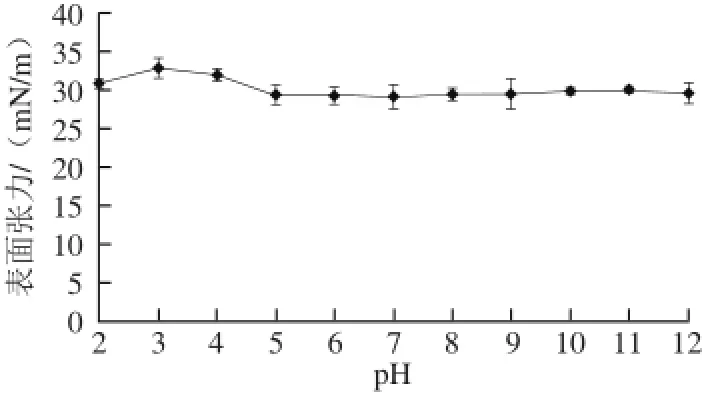
图4 pH值对Surfactin溶液表面张力的影响Fig.4 Effect of pH on surfactin surface tension
由图4可知,Surfactin在pH值为2~12的水溶液中表面活性稳定,表面张力稳定在29~33 mN/m之间。在pH值为2~4时,溶液表面张力略有上升,其中pH值为3时表面张力最大(32.80 mN/m),这大概是因为Surfactin的等电点接近3,在该pH值附近Surfactin的溶解度较低所导致的[15]。
2.5HLB值的测定结果
为了鉴别Surfactin是水包油(O/W)还是油包水(W/O)型的乳化剂,需对其HLB值进行测定,在HLB值分别为6、8、10、12、14、16的油相中测定,结果见图5。

图5 Surfactin对不同油相的乳化性和乳化稳定性Fig.5 Emulsify capacity and emulsion stability as a function of HLB value of oil phase
由图5可知,Surfactin在不同油相中具有不同的乳化性和乳化稳定性。在所需HLB值为6~10的油相中,Surfactin表现出较弱的乳化性,在HLB值为12~16的范围的油相内,Surfactin的乳化性逐渐增强达到最大,并维持在稳定的范围内[16]。Surfactin的乳化稳定性表现在所需HLB值为12、14、16的油相中较强,在HLB值为14时最为稳定,由此说明Surfactin的HLB值约为14,是O/W型的乳化剂,同时说明Surfactin在所需HLB值为12~16的油相中有较强的乳化性且具有最好的乳化稳定性。
2.6乳化性和乳化稳定性的测定结果
2.6.1浊度法测定的乳化性和乳化稳定性
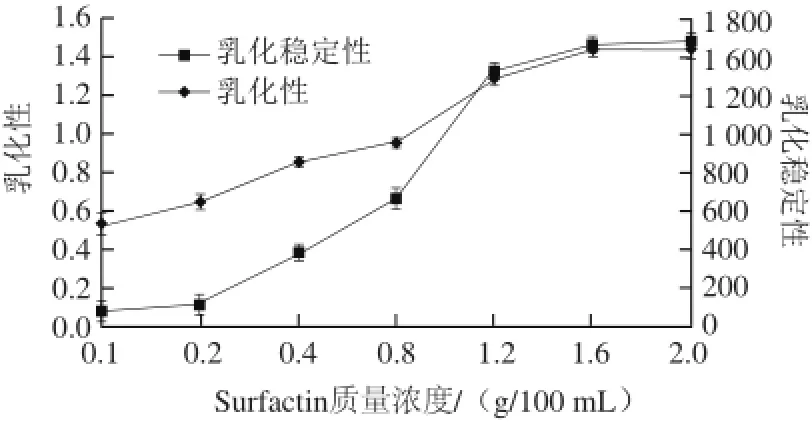
图6 浊度法测得Surfactin的乳化性与乳化稳定性Fig.6 Emulsifying properties of surfactin determined by turbidimetry
浊度法通过测定乳浊液在破乳的过程中的浊度比来反映液体的乳化性能,浊度比作为时间的函数,简单快捷、准确性较高,其测定结果如图6所示。随着Surfactin质量浓度的升高,乳化性增强,乳化稳定性在0.2~1.2 g/100 mL范围内迅速上升,当Surfactin质量浓度达1.6 g/100 mL时,乳化性和乳化稳定性达到最大并趋于稳定,说明Surfactin的质量浓度≥1.6 g/100 mL时,表现出较好的乳化性和乳化稳定性。
2.6.2离心法测定的乳化性和乳化稳定性
离心法是将乳浊液快速离心,测定乳化层高度与总高度之比,适于快速测试和实验室快速评价,进一步确定Surfactin乳化的最佳质量浓度,结果见图7。

图7 离心法测得Surfactin的乳化性与乳化稳定性Fig.7 Emulsifying properties of surfactin determined by centrifugation
由图7可知,随着Surfactin质量浓度的上升,乳化性和乳化稳定性也呈逐渐上升的趋势,在Surfactin质量浓度为1.6 g/100 mL处达到最大并维持稳定,这与浊度法的测定结果一致[17],进一步佐证Surfactin的最佳乳化质量浓度为1.6 g/100 mL,且此质量浓度下Surfactin具有较好的乳化稳定性[18]。
3 讨 论
Surfactin具有的独特双亲特性,双亲分子会自动形成极性基向水碳氢链向内的集合体形成胶束。本研究中,Surfactin质量浓度低于CMC时,若增加Surfactin的质量浓度,Surfactin将迅速聚集在水面,使水和空气的接触面减小,表面张力急剧下降,直到达到临界胶束浓度后,表面张力不再降低。这是因为继续增加Surfactin质量浓度只能使水溶液中的Surfactin分子以几十或几百个单体聚集成胶束,由于胶束存在于液面以下,不具有降低水表面张力的作用,故表面张力不会进一步降低[19-21]。本实验测得Surfactin的临界胶束浓度为9.03×10-5mol/L,这与Peypoux等[22]报道的[Ile2,4,7] Surfactin CMC浓度为9.0×10-5mol/L相一致。
目前已经报道的产生物表面活性剂的微生物虽然较多,但其中大多数微生物产生表面活性剂的能力较弱,发酵液的表面张力主要集中在30~35 mN/m之间[23]。Surfactin的表面活性极强,可将水的表面张力由72 mN/m降到27 mN/m,C13~C15中不同碳链的Surfactin同系物所表现出来的这一活性也是不同的,Razafindralambo等[24]的研究表明,C15的Surfactin具有最强的表面活性,6.76×10-5mol/L的浓度即可将水的表面张力降至33.84 mN/m,而C14和C13则分别在34.45 mN/m和37.85 mN/m,这说明C链越长,其表面活性越强。李翌等[25]也通过对微极性以及胶束粒径和形态的研究发现Surfactin的表面活性是随着脂肪链长度的增加而增加的,并且在溶液中倾向于形成更大的聚集体。而本研究所用Surfactin大部分为C14,是C13、C14和C15的混合物,在6.09×10-5mol/L的浓度下可将水的表面张力降至31.92 mN/m,与Razafindralambo等[24]的研究结果较为吻合。在NaCl溶液中,由于Na+与Surfactin肽链上的-COO-相结合,使得亲水基团数由2.1(-COOH)上升至19.1(-COONa),这大大加强了Surfactin的亲水性,使得在该溶液表面张力表现为降低[26]。
纯化的Surfactin具有较高的HLB值为14,并在所需HLB值为12~16的油相中乳化性能良好。因此,Surfactin良好的乳化性和乳化稳定性显示了其在食品中的应用价值,尤其是Surfactin高的HLB值,使其适宜用于O/W的油水体系中[27],例如花生、核桃等乳饮料的制作,鉴于其较好的抑菌性[28],对食品的防腐保鲜也起到了作用,这些都将为Surfactin工业化生产和应用提供依据。
[1] 王宇. 乳化剂的作用机理及其应用[J]. 山东化工, 2012(3): 111-113.
[2] 付红菊, 刘玮. 食品乳化剂复配在食品生产中的应用[J]. 黑龙江科技信息, 2012(3): 264-269.
[3] 房玉玺. 生物表面活性物质产生菌Bacillus sp. SAC-11发酵条件优化及所产表面活性剂的纯化[D]. 济南: 山东大学, 2012.
[4] 黄德民, 赵国华, 周梅. 乳化剂对面粉淀粉作用[J]. 粮食与油脂,2004(11): 11-13.
[5] 杨铭铎. 乳化剂在面包生产中的作用效果与作用机理[J]. 食品与发酵工业, 1989, 15(1): 14-21.
[6] 张佳程, 周浩. 乳化剂在食品中的作用原理[J]. 食品科技, 1997,22(3): 22-24.
[7] 经纬, 李军生, 黄国霞. 羧甲基丝素的制备工艺优化及其乳化性能[J].应用化学, 2013, 30(1): 73-78.
[8] 胡娜, 乔美靓, 刘毅, 等. 乳化型猪皮胶原蛋白的溶解性和乳化性研究[J]. 肉类研究, 2010, 24(6): 10-14.
[9] 申瑞玲, 王章存, 姚惠源. 燕麦β-葡聚糖的乳化性研究[J]. 食品与机械, 2004, 20(4): 4-6.
[10] MAGALI D, JOSEPH L, LAURENCE L, et al. Effects of surfactin on membrane models displaying lipid phase separation[J]. Biochimica et Biophysica Acta (BBA) -Biomembranes, 2013, 1828(2): 801-815.
[11] CORIN K C, CONNOR C T O. A proposal to use excess Gibbs energy rather than HLB number as an indicator of the hydrophilic-liphophilic behavior of surfactants[J]. Minerals Engineering, 2014, 58: 1016-1024.
[12] HADDAD N I A, GANG Hongzong, LIU Jinfeng, et al. Optimization of surfactin production by Bacillus subtilis HSO121 through Plackett-Burman and response surface method[J]. Protein & Peptide Letters,2014, 21(9): 885-893.
[13] 古扎努尔·艾斯卡尔. 表面活性剂对大豆分离蛋白及其水解物物化特性影响的研究[D]. 杭州: 浙江大学, 2014.
[14] 彭丽丽. 脂肽类生物表面活性剂的发酵优化及其性质和应用研究[D].广州: 华南理工大学, 2011.
[15] 刘祥玉, 张贵峰, 张羽飞, 等. 化学-酶催化法合成基于鱼鳞胶原蛋白的脂肽类表面活性剂及其在提高原油采收率中的应用[J]. 过程工程学报, 2013(4): 103-110.
[16] 刘江红, 陈逸桐, 贾云鹏, 等. 生物表面活性剂应用研究进展[J]. 化学通报, 2013(7): 83-92.
[17] 沈玉江, 段宝颜, 杜春玉. 脂肽类生物表面活性剂发展现状[J]. 黑龙江科技信息, 2013(30): 117-123.
[18] 肖连冬, 程爽, 李杰. 大豆分离蛋白起泡性和乳化性影响因素的研究[J]. 中国酿造, 2014, 33(4): 21-29.
[19] 赵喆, 王齐放. 表面活性剂临界胶束浓度测定方法的研究进展[J].实用药物与临床, 2010, 13(2): 140-144.
[20] JU J, KYUNG O Y, AHMAD B R, et al. Improvement of surfactin production in Bacillus subtilis using synthetic wastewater by overexpression of specific extracellular signaling peptides, comX and phrC[J]. Biotechnology and Bioengineering, 2012, 109(9): 1002-1113.
[21] 陈露, 李淑芹, 薛燕芬. 一株产脂肽类表面活性剂的碱性Dietzia菌及特性研究[J]. 微生物学通报, 2012, 39(11): 1573-1579.
[22] PEYPOUX F, BONMATIN J M, WALLACH J. Recent trends in the biochemistry of surfactin[J]. Applied Microbiology and Biotechnology,1999, 51(5): 553-563.
[23] 张建, 邱宇, 于道永. 同步荧光光谱法测定十二烷基苯磺酸钠的临界胶束浓度[J]. 应用化学, 2009, 26(12): 1480-1483.
[24] RAZAFINDRALAMBO H, THONART P, PAQUOX M. Dynamic and equilibrium surface tensions of surfactin aqueous solutions[J]. Journal of Surfactants and Detergents, 2004, 7(1): 41-46.
[25] 李翌, 邹爱华, 叶汝强, 等. 表面活性素分子结构对其胶束化行为的影响[J]. 物理化学学报, 2011, 27(5): 1128-1134.
[26] 曹娟, 刘怡辰, 张振华, 等. 脂肽类生物表面活性剂产生菌的分离及特性研究[J]. 环境科学学报, 2009, 29(10): 2056-2062.
[27] 周家华, 崔英德, 吴雅红. 表面活性剂HLB值的分析测定与计算[J].精细石油化工, 2001, 32(4): 38-41.
[28] 章栋梁. Surfactin工业分离纯化工艺及其对肉品的防腐保鲜效[D].南京: 南京农业大学, 2013.
Emulsifying Properties of Lipopeptide Biosurfactant Surfactin
DAI Chao, GUO Fangfang, LU Zhaoxin, BIE Xiaomei, ZHANG Chong, L☒ Fengxia*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The activity of the lipopeptide biosurfactant surfactin was measured by Wilhelmy plate method and its emulsifying properties were investigated by turbidimetry and centrifugation. The results showed that the critical micelle concentration (CMC) of surfactin was 9.03 × 10-5mol/L, and it could reduce the surface tension of water from 73.98 mN/m to 27.48 mN/m. When sodium chloride was present at a concentration between 1 × 10-3mol/L and 1.2 × 10-2mol/L, the surface tension of surfactin solution decreased with increasing salt concentration and stabilized at 34 mN/m finally. The surface tension of surfactin after treatment at 121 ℃ for 20 min remained at 37.10 mN/m; surface activity of surfactin revealed a good stability in the pH range of 2-12. Therefore, surfactin has a strong tolerance to salt, temperature, and pH. Hydrophile-lipophile balance (HLB) value measured by turbidimetry was 14, and surfactin had good emulsifying properties for oil phase that required an HLB value between 12 and 16.
lipopeptide biosurfactant; surfactin; emulsifying properties; hydrophile lipophilic balance (HLB)
TS201.3
A
1002-6630(2015)15-0040-05
10.7506/spkx1002-6630-201515009
2014-09-18
“十二五”农村领域国家科技计划项目(2011BAD23B05)
戴超(1988—),男,硕士,研究方向为食品生物技术。E-mail:790192009@qq.com
吕凤霞(1963—),女,教授,博士,研究方向为酶工程。E-mail:lufengxia@163.com
