术中荧光显像辅助切除颅内肿瘤的初步研究
2015-11-02董国俊杨佳李莹张家墅赵艺宁王群卜博陈晓雷
董国俊 杨佳 李莹 张家墅 赵艺宁 王群 卜博 陈晓雷
术中荧光显像辅助切除颅内肿瘤的初步研究
董国俊*杨佳*李莹△张家墅*赵艺宁*王群*卜博*陈晓雷*
目的 探讨荧光素钠术中荧光显像辅助切除颅内肿瘤的技术可行性和安全性。方法 回顾性分析2014年10月至2015年4月在解放军总医院神经外科接受手术治疗的18例颅内肿瘤患者,其中男8例,女10例。年龄1~70岁,平均47岁。所有患者于肿瘤暴露前90~120min给予静脉推注荧光素钠注射液(1mg/kg)。术中使用带有荧光素钠荧光显像模块的专用手术显微镜进行肿瘤荧光显像并指导肿瘤切除。本组病例于术后1、3、6个月随访,随访时常规进行临床及影像学检查并评价此技术对肿瘤切除的程度影响。结果本组18病例,术中均能在荧光模式下清楚地观察到肿瘤荧光,并辅助进行肿瘤切除。无患者出现荧光素钠注射相关不良反应。术后无颅内感染,脑脊液漏等相关并发症。随访期内无死亡病例。术前病变平均体积42.6 cm3(3.4~144.1 cm3)。肿瘤全切16例(88.9%),次全切2例(11.1%)。术中肿瘤荧光素钠的显像信号强度与肿瘤的病理学特征密切相关。结论 本研究初步证实了荧光素钠术中荧光显像辅助切除颅内肿瘤的安全性和可行性,但仍需更大样本的队列研究来证实此技术的真正临床价值。
荧光素钠 荧光显像 脑肿瘤 外科治疗
在颅内肿瘤切除术中,准确的辨认肿瘤和正常脑组织的边界至关重要。然而,由于颅内肿瘤常常具有浸润性生长的特性,术中准确识别肿瘤边界非常困难。近年来,术中荧光技术的临床应用使得术中实时识别肿瘤边界成为现实。术中荧光显像设备已被成功地整合于神经外科手术显微镜并应用于神经外科相关手术操作,从而使该技术能够更广泛地被应用于神经外科临床。本中心自2014年10月使用带有荧光显像模块的专用手术显微镜进行术中荧光素钠肿瘤荧光显像,现将初步经验总结报告如下。
1 资料与方法
1.1一般资料 连续收集2014年10月至2015年4月于解放军总医院神经外科接受荧光素钠辅助颅内肿瘤切除的18例患者资料,其中男8例,女10
1.2影像学检查 术前患者常规行头颅MRI检查,使用1.5T高场强超导磁体(Siemens Espree,Erlangen,德国),术前影像学资料DICOM数据导入导航计划工作站(VectorVisionSky,BrainLAB,德国)。用iPlan 3.0软件制定术前计划,并计算出术前病变体积,术前计划传输到导航工作站用于术中神经功能导航。
1.3手术方法 所有病例于暴露肿瘤前90~120min(通常在患者入手术室后,麻醉前)给予静脉推注荧光素钠注射液(历设得,Alcon Laboratories,美国)1mg/kg。术中使用带有荧光显像模块的专用手术显微镜(FLλ模块,OH5显微镜,Leica,德国)进行荧光素钠肿瘤荧光显像,同时在导航下进行切除肿瘤,并依据术前计划的制定,避开重要的脑功能区,白质传导束和重要的血管等。本组病例常规行术中磁共振(intraoperative MRI,iMRI)扫描。扫描结束后,术者根据有无病变残留,以及残留病变与脑功能区的关系进而决定是否继续手术。同时根据病变的术中荧光显像情况,决定是否进行病变的扩大切除。所切除的残留肿瘤病变经病理组织学分析,以明确荧光显像结果和MRI影像显示的残留肿瘤是否吻合,记录相应结果的吻合率。
1.4术后处理及随访 术后经病理结果证实为高级别胶质瘤的患者,术后给予6个疗程的替莫唑胺标准化疗,证实为转移癌及梭形细胞恶性肿瘤的患者给予相应的放疗、化疗处理。WHO I-II级的低级别胶质瘤如切除程度>90%,则术后严密随访,不进行放、化疗。如切除程度<90%,则进行放、化疗。对脑膜瘤、成熟畸胎瘤、炎症性肌纤维母细胞性肿瘤患者则仅严密随访。所有患者出院后1、3、6个月进行随访,常规行临床及MRI影像随访。本组患者随访时间自3个月至10个月,中位随访时间6个月。
2 结果
2.1治疗结果 本组术中在荧光模式下均能够清楚的区分肿瘤及周边正常的脑组织的荧光特征。术后病理证实为星形细胞瘤7例,其中WHOⅠ级1例,WHOⅡ-Ⅲ级2例,WHOⅣ级4例;脑膜瘤5例,其中WHOⅠ级4例,WHOⅢ级1例肾透明细胞癌脑转移1例,成熟畸胎瘤1例,局灶性皮层发育不良1例,梭形细胞肿瘤1例,孤立性纤维瘤1例,炎症性肌纤维母细胞性肿瘤1例。通过术后病理结果与术中肿瘤荧光显像对比,荧光素钠的显像信号强度与肿瘤的组织病理学特征密切相关,吻合率18/18。本组肿瘤全切除16例,次全切2例。术中及术后注释荧光素钠注射液无过敏等不良反应。术后无颅内感染,脑脊液漏等相关并发症。随访期内无死亡,1例恶性脑膜瘤全切除术后1月余复发。
2.2典型病例男,60岁,因头痛,左侧肢体偏瘫和认知功能障碍1个月入院。术前行头颅MRI提示右侧额叶、基底节区巨大占位,不均匀环形强化,周边水肿明显,中线明显左移(图1A-C)。术前多模态脑功能成像提示患者的右侧锥体束紧邻肿瘤,并被推挤,向后明显移位(图1D)。经常规术前准备后,使用术中磁共振及多模态神经导航进行手术,并以术中荧光素钠显像辅助肿瘤切除。术中,硬膜打开后,脑皮层表面未见明显荧光,切开皮层进入脑白质后,根据导航显示,在肿瘤周边水肿带,观察到了较强的绿色荧光(图2)。经测量,距离MRI T1增强像所示之肿瘤增强边界尚有1cm距离。在此处取标本(标本1)送检后,开始肿瘤切除。当切除至肿瘤核心时(T1增强像无强化区),进行术中荧光显像,未见明显荧光(图3)。在导航影像上标记此处后,取组织标本(标本2)送检。继续切除至肿瘤内侧时,根据导航提示,正位于肿瘤边缘环形强化处,进行荧光显像,提示有较强荧光(图4),再次在导航影像上标记后,取标本(标本3)送检。最终,根据荧光显像,将有异常荧光的组织全切除。经过术中磁共振扫描,提示肿瘤(增强部分和周边约1cm水肿带)已全切除。术后患者恢复良好,左侧肢体肌力及认知功能均有明显改善。术后病理报告如下:标本1,星形细胞瘤II级(图5A);标本2,胶质母细胞瘤IV级,伴大量坏死(图5B);标本3,间变性星形细胞瘤III级(图5C)。经过计算机三维重建肿瘤后,如以T1增强影像上的肿瘤增强边界计算肿瘤体积,则肿瘤体积为93.8 cm3。但如将肿瘤三维模型边缘扩大至最早观测到明显荧光信号的瘤周水肿带(距肿瘤强化边缘1cm),计算荧光显像之肿瘤体积为171.2 cm3(图6)。
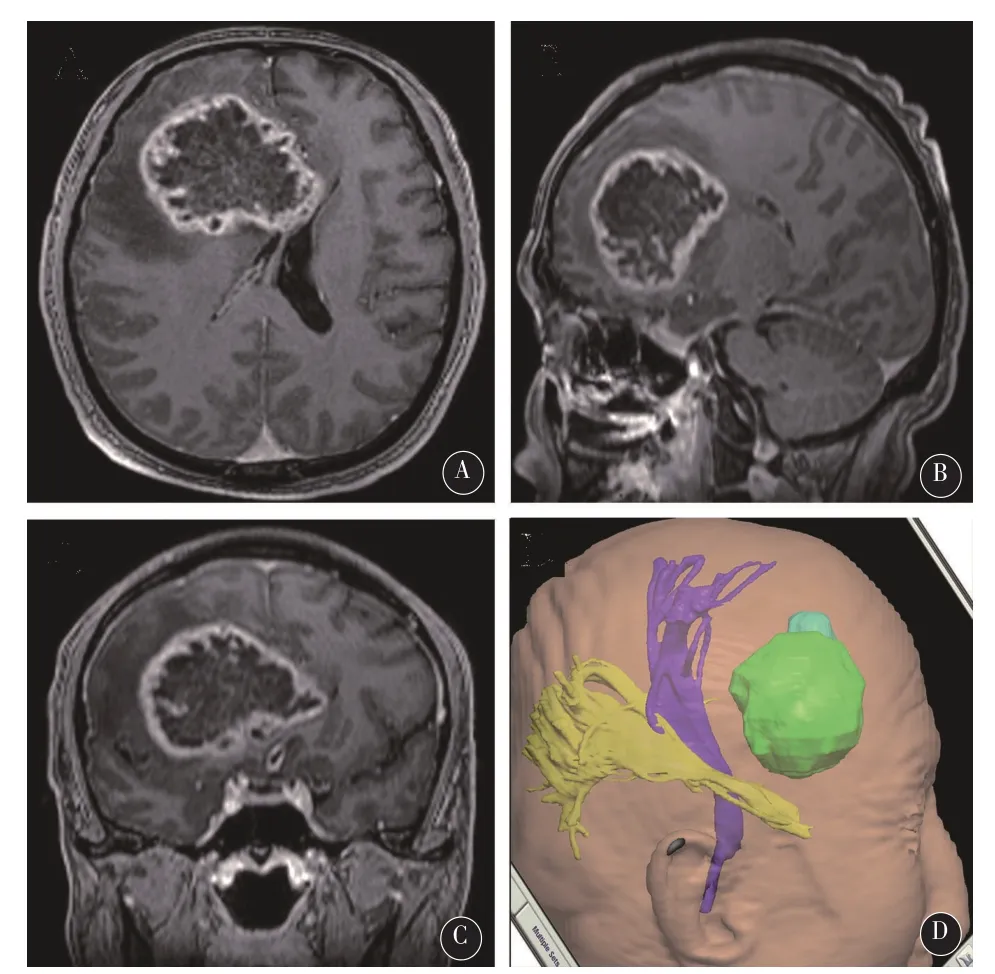
图1 典型病例1,头颅MRI提示右侧额叶、基底节区巨大占位,不均匀环形强化,周边水肿明显,中线明显左移。术前多模态脑功能成像提示患者的右侧锥体束紧邻肿瘤,并被推挤,向后明显移位
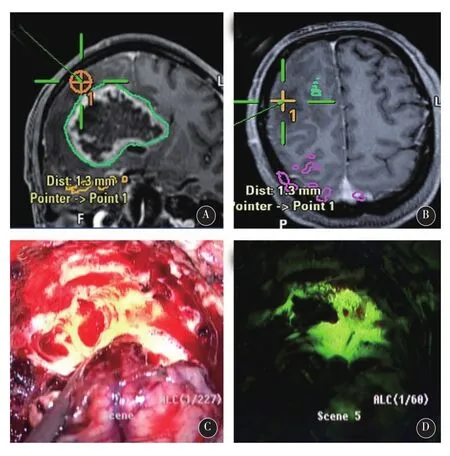
图2 术中荧光素钠显像辅助肿瘤切除。术中切开皮层进入脑白质后,根据导航显示,在肿瘤周边水肿带,观察到了较强的绿色荧光
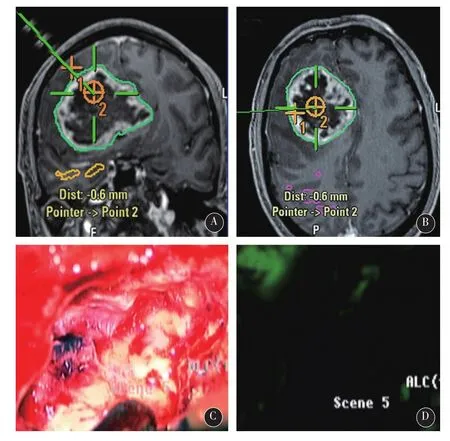
图3 当切除至肿瘤核心时(T1增强像无强化区),进行术中荧光显像,未见明显荧光

图4 切除至肿瘤内侧时,根据导航提示,正位于肿瘤边缘环形强化处,进行荧光显像,提示有较强荧光
3 讨论
目前,术中荧光显像设备已被成功地整合于神经外科手术显微镜并被用于指导颅内肿瘤切除。至今已有多个成功使用5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)进行高级别胶质瘤荧光显像的报道[3-6],其中2006年欧洲的一个多中心前瞻随机研究证实了5-ALA术中荧光显像能够显著提高高级别胶质瘤的切除率,提供了较高的循证医学证据[7]。然而,目前,5-ALA在美国(FDA Food and Drug Administration)[8]和我国并未得到相应国家医药管理部门(CFDA等)的正式批准。因此,在我国,法规的限制导致不能常规临床使用5-ALA进行肿瘤的术中荧光显像。
解决上述困难的一个办法是寻找替代的荧光药物和使用方法。荧光素钠就是一个较好的选择。荧光素钠已有50余年的临床使用历史,早期被应用于眼科,进行眼底血管荧光造影[9]。近年来,已被用于内镜经鼻蝶的脑脊液漏手术,以便能以内窥镜观察脑脊液漏的部位和寻找瘘口[10]。近期一些报道是在术中应用大剂量的荧光素钠(20mg/kg)在普通白光模式(White light)下进行胶质瘤或转移瘤的切除[11,12]。此外,也有被用于颅内肿瘤,尤其是高级别胶质瘤的切除[3,11,13,14],颅内动脉瘤[15],颅内动静脉畸形[16,17]等手术。然而,上述方法需要使用手术显微镜以外的专用设备,进行荧光显像时需要中断正常的神经外科手术流程,使用不便[13]。因此,需要研发整合于手术显微镜,并且不会明显干扰手术流程的新方法。
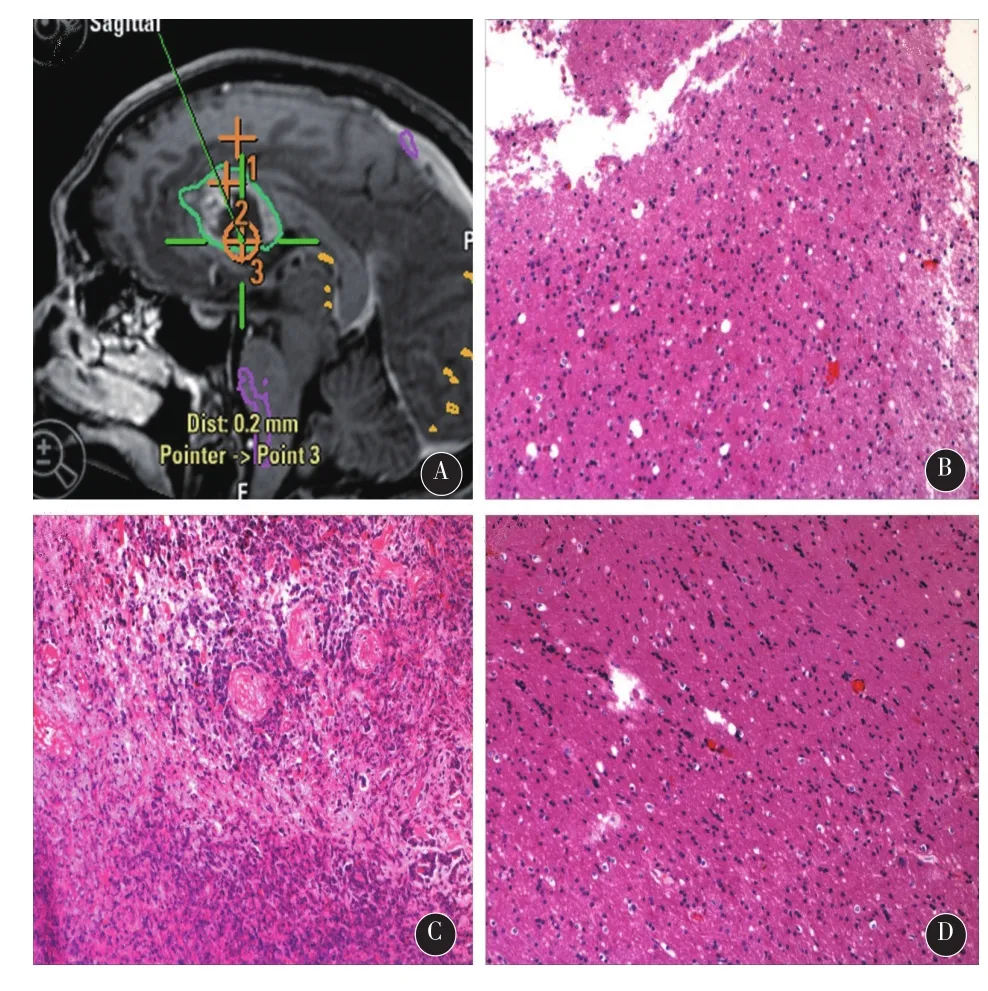
图5 术后病理:标本1,星形细胞瘤II级(A);标本2,胶质母细胞瘤IV级,伴大量坏死(B);标本3,间变性星形细胞瘤III级(C)

图6 以T1增强影像上的肿瘤增强边界计算肿瘤体积,则肿瘤体积为93.8 cm3。但如将肿瘤三维模型边缘扩大至最早观测到明显荧光信号的瘤周水肿带(距肿瘤强化边缘1cm),计算荧光显像之肿瘤体积为171.2 cm3
早在1948年就有荧光素钠术中荧光显像应用于颅内肿瘤开放活检手术的报道[18]。因为其能通过血脑屏障破坏的地方从而进入病变组织。本组18例患者手术使用Leica公司的OH5显微镜,术中荧光使用内置的FLλ模块,经过特制滤光片,重点采集波长在560nm的红外光,简便安全,患者均无术后的不良反应,技术上方便可行。证实了术中荧光素钠荧光显像切除颅内肿瘤的技术可行性和安全性。该技术的另一个优点是在手术显微镜目镜中可以直接观察到荧光影像和手术视野,因为可以在荧光模式下清楚的观察肿瘤及瘤周正常组织,术中大部分的肿瘤切除过程都可以在此模式下进行,所以无需转换到显微镜的普通白光照明。该特点与ICG荧光显像时,仅能在显示屏上观察相比,更为直观方便。而与5-ALA相比,荧光素钠除了具有国家政策法规允许使用的优势外,还有使用方便、价格便宜的的优点。此外,5-ALA需要在麻醉前2.5~3h口服,并将患者置于暗室中避光,以防止皮肤光过敏反应,加之5-ALA药剂非常昂贵(大约900欧元/瓶),而荧光素钠仅需要术前静脉注射即可,无需避光,价格约合5欧元/瓶[3,8,19]。术中使用荧光素钠荧光显像无需中断手术流程,术后患者无需特殊护理,上述优点都给临床使用带来了很大便利。
本研究存在的不足是仅为单中心的小样本前期可行性研究,病例数较少,随访时间较短,该问题有待于今后更大规模的多中心临床对照试验来解决。
新型显微镜整合的荧光素钠显像模块能够成功进行术中荧光成像,并被用于指导颅内肿瘤的切除。在高级别胶质瘤切除中实现了扩大切除,结合术中多模态神经导航和术中MRI成像,可以同时显示病变周边的重要功能结构并加以保护,从而实现最大安全切除(Maximal safe resection)。荧光素钠荧光显像的整合过程简便安全,没有明显中断外科手术流程。本研究的结果提示术中荧光显像的结果有可能影响肿瘤切除过程中的术中决策,并有可能扩大肿瘤切除范围。尽管我们的初步经验证实了该技术的可行性和安全性,仍然需要更大规模的前瞻随机对照研究来探索该技术的真正临床价值。另外,荧光素钠的使用剂量及注射最佳时机需要更进一步的研究和探讨。
[1]Raabe A,Nakaji P,Beck J,et al.Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery[J].J Neurosurg,2005,103(6):982-989.
[2]Dashti R,Laakso A,Niemela M,et al.Microscope-integrated near-infrared indocyanine green videoangiography during surgery of intracranial aneurysms:the Helsinki experience[J].Surg Neurol,2009,71(5):543-550.
[3]Li Y,Rey-Dios R,Roberts DW,et al.Intraoperative fluorescence-guided resection of high-grade gliomas:a comparison of the present techniques and evolution of future strategies[J]. World Neurosurg,2014,82(1-2):175-185.
[4]Stummer W,Tonn JC,Goetz C,et al.5-Aminolevulinic acid-derived tumor fluorescence:the diagnostic accuracy of visible fluorescence qualities as corroborated by spectrometry and histology and postoperative imaging[J].Neurosurgery,2014,74(3):310-319.
[5]Hickmann AK,Nadji-Ohl M,Hopf NJ.Feasibility of fluorescence-guided resection of recurrent gliomas using five-aminolevulinic acid:retrospective analysis of surgical and neurological outcome in 58 patients[J].J Neurooncol,2015,122(1): 151-160.
[6]Honorato-Cia C,Martinez-Simon A,Cacho-Asenjo E,et al. Safety Profile of 5-Aminolevulinic Acid as a Surgical Adjunct in Clinical Practice:A Review of 207 Cases From 2008 to 2013[J].J Neurosurg Anesthesiol,2015,27(4),304-309.
[7]Stummer W,Pichlmeier U,Meinel T,et al.Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma:a randomised controlled multicentre phase III trial[J]. Lancet Oncol,2006,7(5):392-401.
[8]Stummer W,Novotny A,Stepp H,et al.Fluorescence-guided resection of glioblastoma multiforme by using 5-aminolevulinic acid-induced porphyrins:a prospective study in 52 consecutive patients[J].J Neurosurg,2000,93(6):1003-1013.
[9]Rabb MF,Burton TC,Schatz H,et al.Fluorescein angiography of the fundus:a schematic approach to interpretation[J].Surv Ophthalmol,1978,22(6):387-403.
[10]Placantonakis DG,Tabaee A,Anand VK,et al.Safety of low-dose intrathecal fluorescein in endoscopic cranial base surgery[J].Neurosurgery,2007,61(3Suppl):161-5;discussion 165-166.
[11]Shinoda J,Yano H,Yoshimura S,et al.Fluorescence-guided resection of glioblastoma multiforme by using high-dose fluorescein sodium.Technical note[J].J Neurosurg,2003,99(3):597-603.
[12]Okuda T,Kataoka K,Taneda M.Metastatic brain tumor surgery using fluorescein sodium:technical note[J].Minim Invasive Neurosurg,2007,50(6):382-384.
[13]Kuroiwa T,Kajimoto Y,Ohta T.Development of a fluorescein operative microscope for use during malignant glioma surgery:a technical note and preliminary report[J].Surg Neurol,1998,50(1):41-48.
[14]Motekallemi A,Jeltema HR,Metzemaekers JD,et al.The current status of 5-ALA fluorescence-guided resection of intracranial meningiomas-a critical review[J].Neurosurg Rev,2015,38(4):619-628.
[15]Wrobel CJ,Meltzer H,Lamond R,et al.Intraoperative assessment of aneurysm clip placement by intravenous fluorescein angiography[J].Neurosurgery,1994,35(5):970-973.
[16]Feindel W,Yamamoto YL,Hodge CP.Red cerebral veins and the cerebral steal syndrome.Evidence from fluorescein angiography and microregional blood flow by radioisotopes during excision of an angioma[J].J Neurosurg,1971,35(2):167-179.
[17]Rey-Dios R,Cohen-Gadol AA.Technical principles and neurosurgical applications of fluorescein fluorescence using a microscope-integratedfluorescencemodule[J].ActaNeurochir(Wien),2013,155(4):701-706.
[18]MOORE GE,PEYTON WT,et a.The clinical use of fluorescein in neurosurgery;the localization of brain tumors[J].J Neurosurg,1948,5(4):392-398.
[19]Schebesch KM,Proescholdt M,Hohne J,et al.Sodium fluorescein-guided resection under the YELLOW 560 nm surgical microscope filter in malignant brain tumor surgery——a feasibility study[J].Acta Neurochir(Wien),2013,155(4):693-699.
R651
A
2015-08-15)
(责任编辑:甘章平)
10.3969/j.issn.1002-0152.2015.12.009
*中国人民解放军总医院神经外科(北京100853)
△中国人民解放军总医院眼科
