卒中前痴呆的危险因素分析
2015-11-02杨洁区腾飞解龙昌殷建瑞蒲蜀湘郑扬波陈梦宇高聪
杨洁 区腾飞 解龙昌 殷建瑞 蒲蜀湘 郑扬波 陈梦宇 高聪
卒中前痴呆的危险因素分析
杨洁*区腾飞△解龙昌*殷建瑞*蒲蜀湘*郑扬波*陈梦宇*高聪*
目的既往研究对卒中前痴呆(prestroke dementia,PSD)关注较少,特别是其危险因素的分析相对局限。有必要对卒中前痴呆的危险因素进行探讨。方法 筛选2012年7月至2013年6月期间,连续住院的首次发病的缺血性卒中患者,在住院期间及出院1个月内,使用老年人认知功能下降知情者问卷(informant questionnaire on cognitive decline in the elderly,IQCODE)完成认知功能测定,其中IQCODE平均评分≥4分定义为PSD。结果 共393例首次卒中患者入组。其中38例(9.1%)在卒中前3个月内有痴呆症状。Logistic回归分析结果显示:年龄(比数比OR=1.069,P=0.006),女性(OR=2.366,P=0.044)、顶叶萎缩(OR=2.624,P=0.049)及广泛脑萎缩(OR=3.623,P=0.009)是卒中前痴呆的独立危险因素。结论 卒中前痴呆的危险因素包括年龄、女性、顶叶萎缩及广泛脑萎缩。应尽早对此进行识别并给予相应干预。应积极寻找顶叶萎缩和广泛脑萎缩的危险因素,以期对高危人群进行早期干预,减少卒中前痴呆的发生。
卒中卒中前痴呆顶叶萎缩广泛脑萎缩
卒中前痴呆(prestroke dementia,PSD)是指在卒中前发生的痴呆,既往研究表明不同人群PSD的发病率约为6.9%~16.8%[1]。近期越来越多的研究证明,PSD的发生可以导致卒中急性期血管再通治疗后预后变差,包括更高的出血率及死亡率[2],还能导致卒中后中长期的残障程度加重及生存率下降[3-4],卒中后癫痫的分先更高[5]。既往分析显示慢性脑部退行性改变可能是导致PSD的危险因素,从而导致卒中及TIA患者的不良预后[6-7]。因此,关注PSD对评价患者此次卒中后的预后及治疗手段的选择具有相当重要的意义。由于既往研究涉及到的危险因素十分有限,本研究拟在连续入组的卒中患者中筛查PSD病例,并对多种可能的危险因素进行分析,以期明确PSD的危险因素,从而预防PSD发生发展,降低卒中患者的不良预后的发生。
1 材料与方法
1.1研究对象 广州医科大学第二附属神经内科及佛山市第二人民医院神经内科2012年7月至2013年6月连续入院的、确诊为卒中的患者,其中初次发病者为393例,其中男205例,女186例,平均年龄(70.0±11.6)岁。入选标准:①年龄≥18岁;②临床诊断为缺血性卒中。卒中按照世界卫生组织(World Health Organization,WHO)定义[8],指突发的局灶性或全面性神经功能缺损的临床征象,持续时间超过24 h。③脑血管事件发生的时间距就诊日期在14 d内;④获得患者本人或者合法监护人知情同意,并签字。。排除标准:①无症状及体征的静止性脑梗死;②非脑血管病事件;③发病至就诊的时间超过14 d;④拒绝参与评估者。
1.2研究方法 采用统一的调查表进行数据搜集,内容包括患者的一般情况(人口学特征)、既往史(高血压、高脂血症、糖尿病、心脏病等)、个人生活方式(吸烟、饮酒习惯)、辅助检查(空腹血糖、血脂、颈动脉及颅内动脉狭窄的测量)。详细的危险因素定义如下:高血压(安静状况下收缩压≥140 mmHg和/或舒张压≥90 mmHg或使用降压药物),高脂血症(空腹总胆固醇浓度≥5.2 mmol/L,或空腹低密度脂蛋白浓度≥2.6 mmol/L,或空腹甘油三脂≥1.7 mmol/L,或使用降脂药),糖尿病空腹血糖≥7.0 mmol/L,或随机血糖≥11.1 mmol/L),缺血性心脏病(既往有心肌梗塞,或心绞痛,或冠脉成形术,或冠脉搭桥术病史),心房纤颤(入院前或后至少一次心电图提示),吸烟(既往曾有),饮酒(既往曾有),颈动脉狭窄(由颈动脉彩超测量,≥50%狭窄),颅内动脉狭窄(由磁共振动脉成像MRA测量[9]:≥50%狭窄;或经颅多普勒TCD测量[10]:大脑中动脉平均血流速度Vm≥140 cm/s;颈内动脉颅内段Vm≥120 cm/s;大脑前动脉Vm≥120 cm/s;大脑后动脉及椎动脉/基底动脉Vm≥100 cm/s)。
其他脑部结构影像学指标采集均采用既往发表的方法,使用磁共振(magnetic resonance imaging-T1weighted,MRI-T1)加权,MRI-T2加权及液体衰减翻转恢复(fluid attenuated inversion recovery,FLAIR)序列扫描,弥散加权成像(diffusive weighted imaging,DWI)。未做MRI的患者,使用计算机断层(computed tomography,CT)扫描结果进行评估。以下观察指标在CT/MRI图像中的测量均具有较好的一致性[9],包括:脑白质病变(white matter changes,WMC)[11]:0分,无WMC;1分,有散在斑片状WMC;2分,部分融合WMC;3分,大面积融合WMC。额叶萎缩及顶叶萎缩[12]:0分,无;1分,轻-中度;2分,重度。广泛脑萎缩(global brain atrophy,GBA):使用脑室-大脑比(ventricle-to-brain ratio,VBR)测定法进行测量[13]。内侧颞叶萎缩(medial temporal atrophy,MTA)[14]:0分,无;1分,轻度;2分,中度;3分,重度;4分,极重度。陈旧性腔隙性脑梗死[15]:记录其部位及个数,≥4个定义为多发腔隙性脑梗塞。
在住院期间及出院后1个月内的时间中,由一名接受过培训的神经内科医生对熟悉患者近况(卒中前3个月内)的照顾者进行一次问卷式认知功能评价,采用中文版IQCODE问卷[16],其中IQCODE平均评分≥4分定义为PSD[17]。
1.3统计学方法 采用SPSS13.0进行数据处理。先应用卡方检验或t检验对入选因素进行单因素分析,筛选出对PSD有意义的影响因素。其中,部分半定量因素再分组后进行分析,包括:①WMC:轻度及以下(0~1分),中重度(2~3分);②VBR:将数值从小到大分为四个分位数区间,其中第3~4分位数区间VBR赋值为1,第1~2分位数区间赋值为0;③额叶萎缩及颞叶萎缩:无萎缩(0分);有萎缩(1分);MTA:轻度及以下(0~1分),中重度(2~4分)。将单因素分析中有意义的变量引入多因素Logistic回归分析,以比数比(OR)值及95%置信区间(95%CI)估计各因素的危险度。检验水准α=0.05。
2 结果
所有393个病例均完成问卷,其中38例(9.1%)符合PSD诊断。所有人均完成头颅CT扫描,其中320例(81.4%)完成头颅MRI扫描。
2.1单因素分析 组间比较显示,年龄、性别、受教育年限、既往吸烟史、糖尿病、额叶萎缩、顶叶萎缩、内侧颞叶萎缩、广泛脑萎缩、多发腔隙性脑梗塞为卒中前痴呆的影响因素(见表1)。
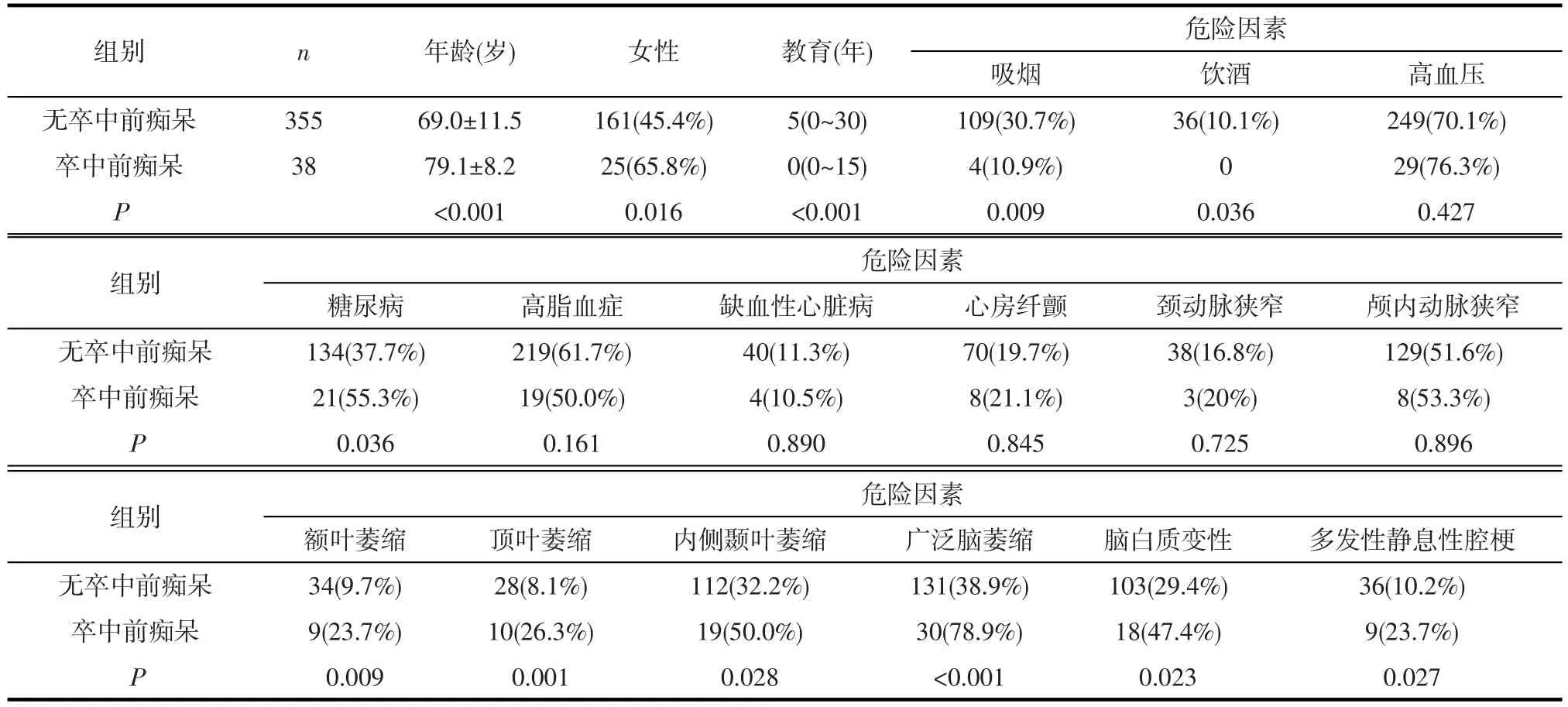
表1 有无卒中前痴呆的临床资料比较
2.2多因素Logistic回归分析 将单因素分析中有意义的危险因素分别引入多因素Logistic回归分析,结果显示:年龄、女性、顶叶萎缩、广泛脑萎缩是卒中前痴呆的独立危险因素(见表2)。
3 讨论
除了年龄和性别因素之外,本研究发现PA与GBA是卒中前痴呆的独立危险因素。既往对PSD的研究表明,脑部退行性改变多集中于颞叶萎缩及海马萎缩[1],而对于顶叶在认知功能中如何具体发挥作用,目前尚无清晰认识,但已有众多研究表明顶叶参与了情景记忆、记忆重现及记忆信息整合的多个过程,而PA可导致情景记忆功能部分受损[18]。PA与阿尔茨海默病(AD)及路易体痴呆(LBD)相关[19],提示其是脑部退行性疾病发生的危险因素;同时,近期的PIB-PET研究也表明,在排除了淀粉样斑块聚集的血管性认知功能下降的患者中,血管性痴呆患者的脑部后部皮层厚度(包括顶叶)也较轻微认知功能下降的患者明显减小[20],提示PA在血管性认知功能下降中起到了重要作用。
广泛脑萎缩(GBA)不仅是年龄相关的脑部退行性病变,也是AD的重要病理改变,并且在既往的研究中也显示其与PSD相关[17]。近期的人群研究也显示,在有脑白质病变的人群中,GBA与认知功能的进行性下降相关[21]。其原因可能包括:①白质病变导致皮层下萎缩,进一步导致额叶-皮层下认知环路阻断,从而影响执行和记忆功能;②GBA可导致精神运动速度减慢。GBA的危险因素除了高龄之外,近期的研究也显示其与糖尿病相关,可能由长期高血糖、胰岛素抵抗或血糖不稳定导致,但具体机制未明[22]。由于糖尿病在卒中患者中比例较高,如能明确GBA与糖尿病之间的关系,对于控制萎缩进展及缓解其造成的认知功能障碍将具有非常积极的临床意义。
综上,卒中前痴呆的危险因素包括老龄、女性、顶叶萎缩及广泛脑萎缩。在临床工作中要尽早对此进行识别并给予相应的干预,包括急性期溶栓的安全性评估;对中长期生存质量的评价,指导照顾者给予患者相应的生活能力支持。应积极寻找顶叶萎缩和广泛脑萎缩的危险因素,以期对高危人群进行早期干预,减少卒中前痴呆的发生。

表2 卒中前痴呆的多因素Logistic回归分析
[1]Pendlebury ST,Rothwell PM.Prevalence,incidence,and factors associated with pre-stroke and post-stroke dementia:a systematic review and meta-analysis[J].Lancet Neurol,2009,8(11): 1006-1018.
[2]Busl KM,Nogueira RG,Yoo AJ,et al.Prestroke dementia is associated with poor outcomes after reperfusion therapy among elderly stroke patients[J].J Stroke Cerebrovasc Dis,2013,22(6): 718-724.
[3]Melkas S,Oksala NK,Jokinen H,et al.Poststroke dementia predicts poor survival in long-term follow-up:influence of prestroke cognitive decline and previous stroke[J].J Neurol Neurosurg Psychiatry,2009,80(8):865-870.
[4]Saposnik G,Cote R,Rochon PA,et al.Care and outcomes in patients with ischemic stroke with and without preexisting dementia[J].Neurology,2011,77(18):1664-1673.
[5]Cordonnier C,Henon H,Derambure P,et al.Influence of pre-existing dementia on the risk of post-stroke epileptic seizures[J].J Neurol Neurosurg Psychiatry,2005,76(12):1649-1653.
[6]Caratozzolo S,Riva M,Vicini CB,et al.Prestroke dementia: characteristics and clinical features in consecutive series of patients[J].Eur Neurol,2014,71(3-4):148-154.
[7]杨洁,区腾飞,解龙昌,等.短暂性脑缺血发作及轻型卒中患者认知功能下降的随访研究[J].中国神经精神疾病杂志,2015,41(2):98-101.
[8]The World Health Organization MONICA Project(monitoring trends and determinants in cardiovascular disease):a major international collaboration.WHO MONICA Project Principal Investigators[J].J Clin Epidemiol,1988,41(2):105-114.
[9]Yang J,Wong A,Wang Z,et al.Risk factors for incident dementia after stroke and transient ischemic attack[J].Alzheimers Dement,2015,11(1):16-23.
[10]Wong KS,Li H,Chan YL,et al.Use of transcranial Doppler ultrasound to predict outcome in patients with intracranial large-arteryocclusivedisease[J].Stroke,2000,31(11): 2641-2647.
[11]Xiong Y,Yang J,Wong A,et al.Operational definitions improve reliability of the age-related white matter changes scale[J].Eur J Neurol,2011,18(5):744-749.
[12]Victoroff J,Mack WJ,Grafton ST,et al.A method to improve interrater reliability of visual inspection of brain MRI scans in dementia[J].Neurology,1994,44(12):2267-2276.
[13]de Groot JC,de Leeuw FE,Oudkerk M,et al.Cerebral white matter lesions and cognitive function:the Rotterdam Scan Study[J].Ann Neurol,2000,47(2):145-151.
[14]Scheltens P,Leys D,Barkhof F,et al.Atrophy of medial temporal lobes on MRI in"probable"Alzheimer's disease and normal ageing:diagnostic value and neuropsychological correlates[J].J Neurol Neurosurg Psychiatry,1992,55(10):967-972.
[15]Potter GM,Marlborough FJ,Wardlaw JM.Wide variation in definition,detection,and description of lacunar lesions on imaging[J].Stroke,2011,42(2):359-366.
[16]Fuh JL,Teng EL,Lin KN,et al.The Informant Questionnaire on Cognitive Decline in the Elderly(IQCODE)as a screening tool for dementia for a predominantly illiterate Chinese population[J].Neurology,1995,45(1):92-96.
[17]Tang WK,Chan SS,Chiu HF,et al.Frequency and determinants of prestroke dementia in a Chinese cohort[J].J Neurol,2004,251(5):604-608.
[18]Cabeza R.Role of parietal regions in episodic memory retrieval: the dual attentional processes hypothesis[J].Neuropsychologia,2008,46(7):1813-1827.
[19]Foundas AL,Leonard CM,Mahoney SM,et al.Atrophy of the hippocampus,parietal cortex,and insula in Alzheimer's disease: a volumetric magnetic resonance imaging study[J].Neuropsychiatry Neuropsychol Behav Neurol,1997,10(2):81-89.
[20]Kim HJ,Ye BS,Yoon CW,et al.Cortical thickness and hippocampal shape in pure vascular mild cognitive impairment and dementia of subcortical type[J].Eur J Neurol,2014,21(5): 744-751.
[21]Jokinen H,Lipsanen J,Schmidt R,et al.Brain atrophy accelerates cognitive decline in cerebral small vessel disease:the LADIS study[J].Neurology,2012,78(22):1785-1792.
[22]Wisse LE,de Bresser J,Geerlings MI,et al.Global brain atrophy but not hippocampal atrophy is related to type 2 diabetes[J]. J Neurol Sci,2014,344(1-2):32-36.
Risk factors for prestroke dementia.
YANG Jie,OU Tengfei,XIE Longchang,YIN Jianrui,PU Shuxiang,ZHENGYangbo,CHEN Mengyu,GAO Cong.Department of Neurology,the Second Affiliated Hospital of Guangzhou Medical University,Guangzhou 510260,China.Tel:020-34153276.
Objetive Very few studies reported the risk factors for prestroke dementia(PSD).In this study,we aimed to explore the risk factors for PSD in stroke patients among a Chinese hospital-based cohort.Methods Consecutive stroke patients were recruited from two hospitals from July 2012 to June 2013.All the clinical features and risk factors were collected during hospitalization.The cognitive features of 393 patients were assessed by interviewing the caregivers using the Informant Questionnaire on Cognitive Decline in the Elderly(IQCODE)assessment.Results Total 393 consecutive first-ever stroke patients completed their assessment.Among all patients,there were 38(9.1%)suffering from PSD.The independent risk factors for PSD were age(OR=1.069,P=0.006),female gender(OR=2.366,P=0.044),parietal atrophy(OR=2.624,P=0.049)and global brain atrophy(OR=3.623,P=0.009).Conclusion It is necessary to evaluate the prestroke cognition among stroke patients.The risk factors for PSD include old age,female gender,parietal atrophy as well as global brain atrophy.In further study,we should make any effort to explore the risk factors for parietal atrophy and global brain atrophy in order to provide the ultimate intervention as early as possible and also prevent the occurrence of PSD.
Stroke Prestroke Dementia Parietal Atrophy Global Brain Atrophy
R749.1
A
2015-06-10)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2015.12.005
*广州医科大学附属第二医院神经内科(广州510260)
△佛山市第二人民医院神经内科
