长白猪TAS2R1基因克隆及序列分析
2015-10-31魏成晓
魏成晓
(青岛农业大学,山东 青岛 266109)
长白猪TAS2R1基因克隆及序列分析
魏成晓
(青岛农业大学,山东 青岛 266109)
本研究通过引物合成、PCR扩增、胶回收和测序对长白猪苦味受体基因1(TAS2R1基因)进行序列分析。将测序得到的结果同GenBank中的TAS2R1基因序列进行比对,共发现3处突变位点。分别位于该基因的228 bp、583 bp和712 bp处。其中,在228 bp处由T突变成C,属于同义突变,其编码的氨基酸无变化;在583 bp处由C突变成G,属于错义突变,编码的氨基酸由亮氨酸突变为缬氨酸;在712 bp处由A突变成G,属于错义突变,编码的氨基酸由亮氨酸突变为缬氨酸。通过生物学信息软件DNAMAN分析,发现其与GenBank中的TAS2R1基因序列一致性达99.67%。
基因克隆;长白猪;TAS2R1;序列分析
生物对苦味物质的感知主要是通过苦味受体转导的,由许多苦味受体基因家族编码所决定该受体的功能。由于苦味受体基因所表达的苦味物质在自然界中的丰富性,以及膜蛋白在此种实验中在细胞膜上难以表达[1],因此必须利用分子技术进行苦味受体基因的研究。现在新兴的分子层面的技术包括比较基因组学和分子进化理论以及进化基因学手段,可以使我们了解苦味基因家族的演化历史和演化驱动力,从而使我们在苦味基因的研究上取得一定的进展。科学家对脱氧核糖核酸数据库进行分析,通过比对遗传草图上脊椎动物对苦味敏感的基因座位的具体方位,发现了动物体内的2种相似的苦味受体基因[2],将其定名为TRB与TAS2R。通过对人和小鼠的苦味受体基因探究,又重新发现了人具有10个TAS2R基因,而小鼠则具有30个TAS2R基因。至此,苦味基因在脊椎动物中的所有成员全部被找到。
本试验成功克隆并分析了长白猪的TAS2R1基因序列,具体揭示了长白猪的这一段基因组成及发生突变的具体位置,为进一步研究TAS2R1基因在其生长发育过程中的作用及分子进化奠定了基础。
1 试验材料与方法
1.1试验材料和主要仪器设备
长白猪耳样取自青岛农业大学试验基地,放入无水乙醇中保存带回,于-20 ℃贮存。
所需10×PCR Buffer、dNTP、rTaq DNA聚 合 酶;PCR扩 增 仪(BIO RAD,美国);凝胶成像系统(Alpha Innotech,美国);低温高速离心机(Heraeus,德国);-80 ℃超低温冰箱(海尔,中国);移液器(Eppendorf,德国);超纯水系统(Milli-Q);高压灭菌锅(Hirayama,日本)等。
1.1.1主要试剂的配制
1)50×TAE 的配制。先精确称取C4H11NO3 242 g,EDTA-2Na 37.2 g放在烧杯内,其次添加900 mL的去离子水,经过充分搅拌后使其溶解。最后添加57.2 mL的CH3COOH,使其完全混匀,最后用去离子水定容达到1 L,放置在室温下储存。
2)1×TAE 的配制。精确量取20 mL 50×TAE 浓储液,向其中添入蒸馏水定容,使之达到1 000 m L,上下颠倒充分混匀待用。
3)1MTris·Cl(pH8.0)。把24.22 gTris放置于80 mL双蒸馏水中使其溶解,向其中加入浓HCl,将其pH调节到8.0,定容到200 mL,进行高压灭菌后,于4 ℃保存。
4)10%SDS。在60 ℃的条件下,将20 gSDS加入超纯水中溶解,通过滴加稀HCl,将其pH调节到7.2,定容到200 mL,放置于室温保存。
5)0.5MEDTA(pH8.0)。称出93 gNa2EDTA·2H2O在160 mL超纯水中溶解,将其混合均匀后加入2 g左右NaOH,将其pH调节到8.0,使其定容到200 mL,于4 ℃高压灭菌后保存。
6)蛋白酶K(20 mg/mL):将200 mg蛋白酶在10 mL超纯水中溶解,混合均匀后,定容至500 µL分装,放置在-20 ℃冷冻储藏。
1.2耳样的采取
将耳号钳用75%的酒精棉消毒,剪下刚出生仔猪的耳样1~2块,放入1.5 mL盛有75%酒精的离心管内,带回实验室,于-20 ℃保存。
1.3DNA的提取
取猪耳样一小块,洗净后,用剪刀剪碎放在于1.5 mL的灭菌离心管内,按照以下步骤进行操作:
1)加入600 µL组织提取液(10mM EDTA(pH=8.0)+10 mM Tris-Hcl(pH=8.0)),其 次 向 其 中 加 入10%SDS10 mL/mL蛋白酶K使最终浓度达到1%、100 µg/mL,55%消化过夜;
2)于第2天将溶液冷却使其达到室温后,导入入体积相等的三羟甲基氨基甲烷饱和酚,将管盖盖紧,使离心管缓慢颠倒,颠倒10 min以上即可,12 000 r/min下离心15 min;
3)将体积相等的饱和酚加入上层清液中:氯仿(1:1),将管盖盖紧,将离心管缓慢颠倒,颠倒最少10 min以上,12 000 r/min下离心15 min;
4)取上层清液,向其中加入体积相等的三氯甲烷:异戊醇(24:1),将管盖盖紧,使离心管缓慢颠倒,最少持续10 min以上,12 000 r/min下离心15 min;
5)取上层清液,加入1/10体积的2 mol/L CH2CH3NaO2和2倍体积的C2H5OH,管盖盖紧后,使离心管缓慢颠倒,出现白色絮状DNA为止,12 000 r/min下离心4~6 min;
6)将上层清液倒掉,并加入400 µL70%无水乙醇经过2次洗涤后,管盖盖紧后,将离心管缓慢颠倒,12 000 r/min下离心4~6 min,弃掉管内乙醇,把离心管颠倒在吸水纸上,经干燥处理后,使其溶解,放置于-20 ℃下用来保存以及以后使用。
1.4引物的设计与合成
依据目的基因TAS2R1设计一对引物,通过上海生工合成:
上游引物:5′AGCAAATGTCT GCCATCTTCC 3′,
下游引物:5′GGACATCTTTG CTGGGCTGG 3′。
PCR的 反 应 体 系:10xBuffer 2.5 µL,18.3 µL灭菌蒸馏水,dNTPMix1 µL,上游引物1 µL,下游引物1 µL,TapDNApolymerase(5U/ µL)0.2 µL,DNA模板1 µL。
PCR的反应条件:95 ℃,将其预变性3 min;94 ℃,变性30 s;58 ℃,退火40 s;72 ℃,延伸50 s;返回到变性过程并运用30个循环;72 ℃,延伸10 min;然后于4 ℃保存。PCR反应完成时选取5 µL产物,采用1.5%琼脂糖凝胶电泳进行检验。
1.5基因片段的回收、纯化、和测序
PCR的产物经由1%琼脂糖凝胶电泳后,对切下的目的基因(1189 bp)片段,选取胶回收纯化试剂盒进行回收。具体的方法如下:
1)将每100 mg凝胶加入约400 µL的BindingBuffer,放置于50 ℃水浴10 min,每2 min颠倒混匀1次。
2)用2.0 mL收集管中的吸附柱收集融化的胶溶液,在室温下静置2 min后,室温下8 000 r/min离心2 min。
3)将吸附柱拿下,收集管中的废液全部倒掉,把UNIQ-10柱插入收集管内,将600 µLWash Solution加入其中,10 000 r/min室温离心40 s。重新洗涤1次。
4)将吸附柱拿下,收集管中的废液全部倒掉,把UNIQ-10柱插入收集管内,室温下10 000r/min离心15 s。
5)将吸附柱放进新管中,将20µL Elution Buffer,55 ℃水浴2 min。25 ℃ 10 000 r/min离心3 min,将DNA片段进行回收,就是离心管内的液体。
2 试验结果
2.1PCR产物琼脂糖凝胶电泳结果
通过1%琼脂糖凝胶电泳显示在1 189 bp处获得一条清晰的条带(图1),与目的条带大小基本一致。
2.2序列测定结果
测序结果显示和GenBank里的TAS2R1基因序列一致性达99.67%。DNAMAN序列比对结果如下:
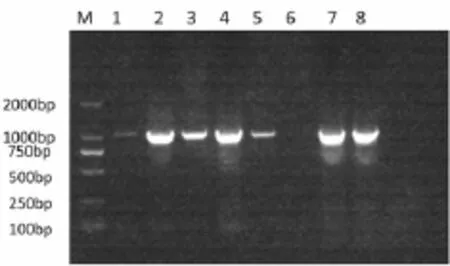
图1 TAS2R1基因PCR产物琼脂糖凝胶电泳结果图
2.3SNPs分析
通过查看TAS2R1基因扩增产物序列测定结果,共显示3个双峰位置。将所检测出的SNPs与GenBank中的TAS2R1进行比对,发现3个突变位。上述结果表明,第228 bp处发生了突变,由T变成了C,该突变为同义突变;第583bp处发生了突变,由C变成了G,该突变为错义突变,编码的亮氨酸变成了缬氨酸;第712 bp处发生了突变,由A变成了G,该突变为错义突变,编码的氨基酸由异亮氨酸变成了缬氨酸。通过DNAman比对发现一致性达99.67%。将所检测出的SNPs与GenBank比对,发现3个突变位点中有3个在外显子区域,其中导致错义突变的有2个。
3 结论与讨论
本研究对长白猪TAS2R1基因的研究结果表明,长白猪该基因的结构与人、牛、马、羊和小鼠等其他哺乳动物种类的一样,基因内部无内含子,即整个阅读框架只有1个外显子组成,其起始密码子ATG上游的第3个核苷酸是腺嘌呤,紧跟在ATG后面的核苷酸是鸟嘌呤,这与“Kozak序列”特征一致。符合大多数真核生物起始密码子所具有的结构特征,说明本研究得到的TAS2R1基因结构是正确的。苦味受体基因家族,具有3个细胞外环和3个细胞内环,并且相互对应。处于TAS2R1细胞外的N端非常短,也许作为配体结合区域,多态性特别明显,可与多种结构的苦味物质相结合。苦味受体细胞中则具有3个环状结构,其保守性很高,作为细胞中G蛋白偶联片段。TAS2R1受体能够识别苦味物质,主要依赖于基因家族中不同的受体基因能够与不同的苦味受体物质结合。若是长白猪屡次和具有特殊苦味的物质接触,也许会增强它们在日后辨别该特种有毒物质的能力。经过对有限的基因序列资料进行整合,可以打破TAS2R1基因序列数目有限的缺陷,使得到的研究结果能够为我们提供些许TAS2R1基因的演化过程。尽管不同猪物种的食性不同,但是通过研究长白猪的食性选择,或许能够揭示食性选择在基因进化中的动力作用。kim等(2003)对与苯硫脲(phenyl thiocarbamide,PTC)苦味感知相关的苦味受体T2R38的研究结果则表明,PTC味感知者和PTC味非感知者间的差异仅仅是由于T2R38氨基酸序列上3个氨基酸的替换所致。根据Kim等的研究结果,我们可以推测本研究中发现的3处SNPs可能会对苦味物质识别产生一定的影响。通过这个研究,我们或许能够深入的探讨物种形成机制的差异[3]。

图2 DNAMAN序列比对结果

图3 TAS2R1基因测序结果峰图
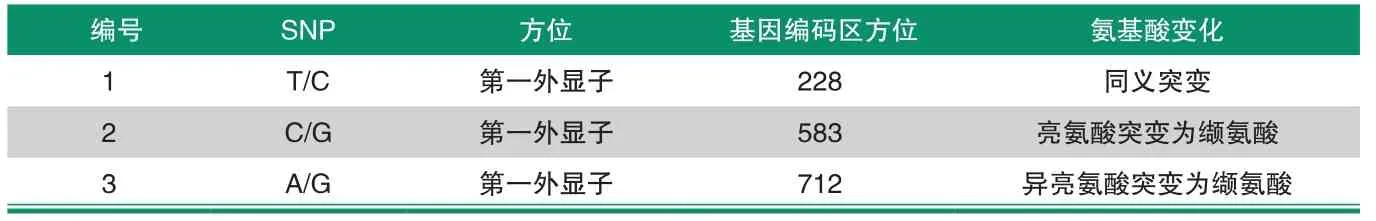
表1 TAS2R1基因的SNP分布
本研究通过对长白猪TAS2R1基因的nucleotide和它的脱氧核苷酸所编码蛋白的序列进行分析,揭示了其序列特征。对TAS2R1基因的多样性、基因表达调节和长白猪苦味受体的分子演化顺应等方向的研究具有一定意义,同时为长白猪苦味基因遗传资源的开发和保护应用提供了有力支持。然而,多个基因成员组成了苦味受体基因家族,TAS2R1基因也只是在其中占据了一小部分。为了深入透彻的揭晓长白猪苦味系统的遗传特征,需要我们进行更深层次的探究。
[1] Nowark R M. Walker's Mammals of the Wodd[M]. Baltimore:Johns Hopkins Univ Press, 1999,9(3):364-417.
[2] Flynn J J,Nedbal MA.Phylogeny of the Carnivora(Mammalia):congruence vs incompatibility among multiple data sets[J]. MolPhylogenet Evol,1998, 9(3):414-426.
[3] Moon SJ,Kttgen M,Jiao Y,et al. A taste receptorrequired for the caffeine response in vivo[J].Curr. Biol,2006(16):1812-817.
2015-10-22)
