金刚烷胺ELISA试剂盒的研制
2015-10-31吴小平王文珺刘萤邢维维苏丽芳
吴小平王文珺刘萤邢维维苏丽芳
(1.北京维德维康生物技术有限公司 北京 100095;2.北京出入境检验检疫局)
金刚烷胺ELISA试剂盒的研制
吴小平1王文珺1刘萤2*邢维维1苏丽芳1
(1.北京维德维康生物技术有限公司 北京 100095;2.北京出入境检验检疫局)
[目的]研制金刚烷胺ELISA快速检测试剂盒,用以检测鸡肉中金刚烷胺残留量。[方法]在金刚烷胺单克隆抗体基础上,用直接竞争酶联免疫吸附法研究试剂盒的各项指标。[结果]研制的试剂盒标准曲线线性范围为0.5-40.5 μg/L,线性回归方程为y=-2.0574x+0.4763(R2=0.9967),IC50浓度值为1.9 μg/L;对鸡肉中金刚烷胺的检出限为0.25 μg/kg,添加回收率范围为76.0%-109.0%,批内、批间变异系数均小于15%。[结论]该试剂盒具有快速、灵敏、稳定的特点,各项指标性能良好,可用于鸡肉中金刚烷胺残留的定性或半定量检测。
金刚烷胺;试剂盒;检测;鸡肉
1 前言
金刚烷胺(amantadine,AMT)属于三环胺类,多以盐酸盐形式存在,分子式:C10H18NCl[1]。常温下为白色结晶性粉末,在乙醇和水中易溶,在三氯甲烷中溶解,呈碱性[2]。金刚烷胺可以抑制病毒穿入宿主细胞,并影响病毒的脱壳,抑制其繁殖,可用于各种A型流感病毒及帕金森综合症的治疗[3,4]。但金刚烷胺对食用者可能产生嗜睡、失眠、眩晕、抑郁、恶心、食欲减退等多种不良反应,具有一定的毒副作用[1]。而且,长期使用金刚烷胺可以使病毒产生不同程度的耐药性,诱导产生新型耐药病毒[5]。因此,我国农业部2005年第560号公告明确规定金刚烷胺和金刚乙胺等抗病毒药物在兽医上禁止使用,美国FDA于2005年也禁止将金刚烷胺和金刚乙胺等人类抗病毒药物用于畜禽类[6,7]。
目前,检测金刚烷胺的方法有气相色谱质谱法(GC-MS)、液相色谱法(HPLC)和液相色谱质谱法(LC-MS),这些方法所需仪器昂贵,前处理过程复杂,操作时间过长,无法在基层检测机构推广[8,9]。以免疫学检测技术为基础建立起来的酶联免疫检测(ELISA)试剂盒可为建立监控动物性食品中金刚烷胺残留提供技术支持。
2 材料与方法
2.1材料
2.1.1试剂
乙腈(分析纯)等生化试剂:购自上海华美公司;阿莫西林、氯唑西林、苯唑西林、头孢噻呋标准品:购自sigma公司。
2.1.2仪器
均质器(JZ-II型):购自莆田市南荣贸易有限公司;电子天平(2000SBL):购自美国Setra;氮吹仪(KL512):购自美国Organomation;低速离心机(Anke TDL-40B):购自上海安亭科学仪器;漩涡混合器(QL-901):购自海门市其林贝尔仪器制造有限公司;酶标仪(MK3)、微量移液器:购自美国Thermo;生化培养箱(DHP-600):购自天津市中环实验电炉有限公司。
2.2方法
2.2.1溶液系统
各溶液参考宫慧芝所述方法配制[10]。
2.2.2抗体制备
分泌抗金刚烷胺单克隆抗体的杂交瘤细胞株由本公司建立,利用BALB/c小鼠体内诱生单克隆抗体的方法制备抗体,采用饱和硫酸铵法对腹水进行纯化。抗体的特异性和灵敏度采用间接竞争ELISA法进行测定。
2.2.3ELISA方法建立
将上述制备的抗金刚烷胺单克隆抗体包被于酶标板微孔,配制质量浓度分别为0、0.5、1.5、4.5、13.5、40.5 μg/L的金刚烷胺标准液,参照刘百红所述方法建立直接竞争ELISA检测体系。检测步骤如下:加入100 μL标准品或样品于设定酶标板微孔中;然后加入金刚烷胺酶标抗原工作液50 μL;轻敲微孔板边缘混匀1 min,25℃恒温箱中避光反应30 min;洗板3次,每次加入洗涤液250 μL,最后一次甩干余液,并在吸水纸上拍干;加入底物液100 μL,在25℃恒温箱中避光反应15 min后加入终止液100 μL;用酶标仪在450 nm波长下检测各孔吸光度值(Optical density,OD)[11]。
2.2.4样品前处理
用均质器将动物组织样品均质;称取样品3.0± 0.05g至50mL离心管中,加入乙腈6mL和金刚烷胺纯化试剂(无水硫酸钠)1.0 g,用涡旋仪涡动3 min;25℃、4 000 r/min离心10 min;取2 mL上层乙腈至干净玻璃试管中,置于60℃-70℃水浴锅中用氮气流吹干;加入0.5 mL金刚烷胺样品提取液(1%三氯乙酸+甲醇,以体积比1∶1混匀),用涡旋仪涡动2 min;取100 μL进行样品测试。
3 结果
3.1ELISA工作曲线
图l为金刚烷胺ELISA试剂盒标准工作曲线。曲线呈典型的S型,回归方程为:y=-2.0574x+0.4763,相关系数R2为0.9967,IC50浓度值为1.9 μg/L,标准曲线中各标准品浓度对应的吸光百分比值的标准误差(RSD)为1.7%-8.6%。结果表明金刚烷胺试剂盒在0.5-40.5 μg/L浓度范围具有良好线性。

图1 金刚烷胺试剂盒标准曲线
3.2基质干扰测试
分析PBS缓冲液、鸡肉样品处理液2种基质对绘制标准曲线的影响,将金刚烷胺分别溶于2种基质中,配制成浓度为0、0.5、1.5、4.5、13.5、40.5 μg/L标准液,按照金刚烷胺试剂盒的操作方法测定,绘制曲线进行分析,结果见图2。
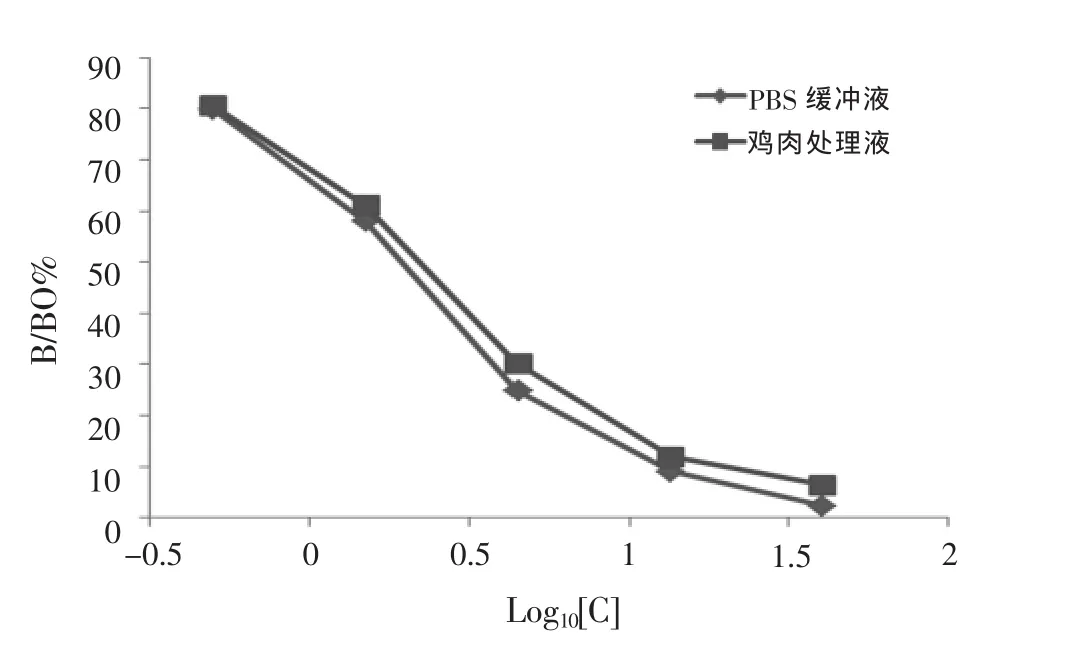
图2 不同基质对金刚烷胺-Kit影响
图2显示,不同基质的金刚烷胺标准品OD450nm值不同。鸡肉处理液测定标准曲线的回归方程为:y=-2.2322x+0.7257,相关系数R2为0.9909,IC50浓度值为2.2 μg/L,表明尽管不同基质对标准品的OD450nm值有一定影响,但其IC50变化差异不大,对金刚烷胺试剂盒的敏感性和检测结果影响不大,上述样品前处理方法可行。
3.3样品检出限
用本试剂盒检测20份空白鸡肉样品,结果见表1。空白样品的平均值()加3倍标准差(SD),即为鸡肉样本的检出限(LOD),LOD=+3SD。

表1 检出限结果
由表1可得,检测结果平均值为0.081 μg/kg,标准差为0.046,因此本试剂盒鸡肉检出限为0.22μg/kg。考虑到实际检测工作中的需要和操作方面的误差,最终确定本试剂盒对鸡肉的检出限为0.25 μg/kg。
3.4准确度和精密度测试
准确度和精密度分别以回收率和变异系数表示。分别在阴性鸡肉中添加不同浓度的金刚烷胺标准品,每个浓度添加5份样品,共用3个批次试剂盒进行检测,计算样品回收率和变异系数,以评价试剂盒的准确度和精密度,结果见表2。

表2 准确度和精密度测定结果
结果显示,回收率范围为76.0%-109.0%,批内变异系数范围为3.9%-11.8%,批间变异系数范围为9.1%-11.2%,均未超过15%,表明金刚烷胺试剂盒具有较高的准确度和精密度。
3.5实际样品检测验证结果
用ELISA试剂盒法和仪器法分别检测10份鸡肉盲样,比较测定结果。LC-MS方法参照DB 21/ 2394-2014《鸡肝和鸡肉中金刚烷胺、金刚乙胺的检测超高效液相色谱串联质谱法》进行,方法对鸡肉中金刚烷胺的检测限为0.5 μg/kg。以试剂盒检测限作为阴阳性判定值,小于试剂盒检测限试剂盒检测结果记为“-”,仪器结果记为“ND”,大于试剂盒检测限以实际检测值表示,结果见表3。结果显示,二者的符合率为100%。

表3 ELISA法与仪器方法比较结果
4 讨论
国家对食品安全问题越来越重视,因此ELISA检测技术在农药、兽药残留、生物毒素、毒品及真菌毒素等检测领域的应用越来越广泛,同时,对ELISA试剂盒的灵敏度、准确度和重复性等技术指标也提出了更高的要求。
基质效应可能抑制免疫结合反应,使竞争效率下降,从而导致曲线异常,斜率减小,IC50增大,灵敏度下降。本试剂盒对PBS缓冲液、鸡肉样品处理液2种基质所测标准曲线的IC50变化不大,说明本试剂盒所采用的样品处理方法可行。
5 结论
本研究研制的鸡肉中金刚烷胺残留检测ELISA试剂盒检出限为0.25 μg/kg,且性能良好,可用于鸡肉中金刚烷胺残留的定性或半定量检测。
[1]胡巧茹,周长朋,张玉春,等.高效液相色谱-串联质谱法测定辣椒及辣椒制品中金刚烷胺残留[J].分析测试学报,2014,33(10):1184-1188.
[2]苏文清,蒙君丽.取代禁用渔药的新药介绍(三)[J].河北渔业,2003,128(2):26-27.
[3]张向荣.抗病毒药物的应用及其研究进展[J].安徽医药,2001,5(4):254-255.
[4]王新德.帕金森病治疗进展概况[J].现代康复,2000,4(3):324-325.
[5]姚亚妮,杨新玲.新型多巴胺受体激动剂与帕金森病[J].中华神经医学杂志,2009,8(5):538-540.
[6]蒋增海,邓同炜,李文刚,等.猪群利巴韦林中毒病例[J].中国兽医杂志,2013,49(9):83-83.
[7]云环,崔风云,严华,等.超高效液相色谱-串联质谱法测定鸡肉中的利巴韦林和金刚烷胺[J].色谱,2013,31(8):724-728.
[8]武洁,王大为,何志强.LC-MS/MS法测定人血浆中的金刚烷胺浓度及其药动学[J].中国临床药学杂志,2008,17(2):109-111.
[9]葛孝忠,应黄慧,陈晓,等.金刚烷类药物的研究进展[J].中国医药工业杂志,2004,34(11):583-586.
[10]宫慧芝,计融,杨军,等.伏马菌素B1免疫学检测方法的建立[J].中国公共卫生,2006,22(7):840-842.
[11]刘百红,熊宁,王喜亮,等.直接竞争ELISA法快速检测动物源性食品中磺胺嘧啶残留[J].中国兽药杂志,2008,42(2):16-19.
Development of an ELISA Kit for the Determination of Amantadine in Chicken Muscle
Wu Xiaoping1,Wang Wenjun1,Liu Ying2*,Xing Weiwei1,Su Lifang1
(1.Beijing WDWK Biotechnological Corporation Ltd,Beijing,100095;2.Beijing Entry-Exit Inspection and Quarantine Bureau)
[Objective]Development of direct ELISA kit for the determination of amantadine(AMT)in chicken muscle.[Method]Under the optimal condition,development of a direct ELISA based monoclonal antibody for the determination of AMT in chicken.[Result]Linear range of AMT ELISA kit was 0.5-40.5 ng/mL;regression equation:y=-2.0574x+0.4763(R2=0.9967),IC50=1.9 ng/mL.The limit of detection(LOD)of ELISA for DEX in chicken was 0.25 ng/g.The average recoveries of DEX from fortified samples by ELISA were in a range of 76.0%-109.0%and inter-and intra-coefficients of variation(CVs)was less than 15%.[Conclusion]AMT ELISA kit established in this study was rapid,sensitive and stable,which is good enough for the qualitative or half-quantitative determination of AMT in chicken muscle.
Amantadine;ELISA Kit;Chicken Muscle
R446.61
E-mail:wuxiaoping@wdwkbio.com;*通讯作者E-mail:liuying@bjciq.gov.cn.
国家质检总局科技计划项目(2013IK306)
2015-06-09
